三氯生对羊肚菌霉菌性枯萎病病原菌的抑制作用
2022-09-30刘本洪
杨 春,刘本洪,刘 蕾,张 怡
(四川大学建筑与环境学院, 成都 610065)
【研究意义】羊肚菌(Morchellaspp.)是一类名贵食(药)用菌[1],在国际市场上有较大需求,价格颇高,2018年全国人工栽培羊肚菌干品批发价保持在900~1400 元/kg[2]。羊肚菌属于低温型真菌[3],适宜生长温度为18~22 ℃[4]。新鲜羊肚菌上市季节非常短暂,主要在春季[5]。中国羊肚菌商业栽培开始于2012年前后,主要栽培物种为梯棱羊肚菌(Morchellaimportuna)和六妹羊肚菌(Morchellasextelata),随后国内羊肚菌的人工栽培面积不断扩大,从2012年200 hm2[6]到2018—2019年8000~9333 hm2[7]。羊肚菌栽培在中国食用菌栽培行业占据重要地位,川渝地区是我国羊肚菌主产区[6]。与常规食用菌基质袋栽技术不同,羊肚菌整个栽培过程均暴露在复杂外部环境中,菌丝生长和子实体发育易受土壤微生物影响[8]。随着食用菌栽培产业迅速发展和栽培规模不断扩大,食用菌病害越来越普遍和频繁,成为制约产业发展的主要瓶颈[9],羊肚菌也是如此。在2013年3月,由Diploösporalongispora引起的霉菌性枯萎病(下文简称枯萎病)首次在湖北省和重庆市被发现,5%~8%菇体感染了枯萎病,如今该病害在栽培区域已十分常见[10]。【前人研究进展】以往的研究集中于致病真菌分离和鉴定。目前已知枯萎病是一种严重的真菌性病害且多发生于栽培后期,当环境温度升高时病害会迅速蔓延,染病部位呈白色绒毛状,随染病时间增加受侵染部位会萎缩、凹陷和破损。该病原菌分生孢子具有隔膜,通常直接由菌丝膨大而成,呈椭圆形或近梭形;该病原菌的厚垣孢子近球形,通常呈串珠状[11]。枯萎病防控措施主要为土地提前翻耕暴晒、及时撤走被污染的外源营养袋和及时采摘感病的菇体[8]。病原真菌与羊肚菌对药物敏感程度具有相似性,这就对化学药剂选用提出很高要求[12]。目前没有该病害相关抑菌剂研究报道。【本研究切入点】三氯生(Triclosan,下文简称TCS)是一种人工合成的抑菌剂,已经被广泛应用于口腔护理产品中[13],如牙膏[14]和漱口水[15]。含TCS的牙膏可以有效控制牙菌斑形成和保持牙龈健康[16]。TCS在较低浓度时即可有效抑制革兰氏阳性细菌、革兰氏阴性细菌、酵母菌和霉菌[17]。在与其他化学抑菌剂如六氯酚(Hexachlorophene)、氯碘羟喹(Clioquinol)、氯喹那多(Chlorquinaldol)和庆大霉素(Gentamicin)等的对比中,TCS对细菌和真菌作用效果明显,表现为对多种细菌和真菌具有更低的最小抑制浓度[18]。TCS曾应用于平菇(Pleurotusostreatus)、大球盖菇(Strophariarugosoannulata)和蛹虫草(Cordycepsmilitaris)等食药用菌的液体发酵,由于液体菌种在实际生产中极易受到杂菌污染,在配制液体培养基时加入TCS(浓度为1~30 mg/L)能够抑制杂菌生长,提高发酵成功率[19]。根据TCS在食药用菌液体发酵中的应用,推测TCS具有抑制羊肚菌杂菌病害的可能性。【拟解决的关键问题】本文研究了TCS抑杂菌能力和不同浓度TCS对六妹羊肚菌和枯萎病病原菌生长产生的影响,并关注了在不同TCS浓度下六妹羊肚菌和枯萎病病原菌微观结构的变化,为研发控制羊肚菌枯萎病的抑菌剂提供资料参考,有利于羊肚菌栽培行业的发展。
1 材料与方法
1.1 固体培养基
实验在马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基的基础上增加麦麸作为培养基原料,制得麦麸马铃薯葡萄糖琼脂(下文简称WPDA培养基)培养基,每1 L培养基加入200 g马铃薯、20 g葡萄糖、20 g麦麸和21 g琼脂。需灭菌的培养基均在1.5×105Pa下灭菌40 min。
1.2 菌种
六妹羊肚菌母种由四川省成都市科创菌业有限公司提供。在羊肚菌收获期间从四川省德阳市中江县某羊肚菌栽培基地(31.023°N,104.737°E)收集出现枯萎病症状的菇体,用灭菌的接种环挑取感病部位的白色菌丝接种于WPDA培养基,常温培养4 d后可发现培养基上出现具有浓密白色菌丝的菌落,将其转接至新的WPDA培养基中纯化培养。镜检观察到该菌种的分生孢子呈梭形且具隔膜,还具有呈串珠状的厚垣孢子。委托四川省成都市罗宁生物科技有限公司对病原菌菌种进行分子生物学鉴定,使用真菌通用引物ITS1和ITS4进行ITS rRNA基因的PCR扩增,使用NCBI的blastn进行碱基序列的对比,供试菌株的ITS序列与Paecilomycespenicillatus和D.longispora均具有99%的一致性,枯萎病病原菌D.longispora曾被错误地鉴定为P.penicillatus[12]。结合分生孢子和厚垣孢子的形态特征可判断该菌种为D.longispora。六妹羊肚菌母种和纯化后得到的枯萎病病原菌菌种均放置在培养箱中(18±0.5)℃条件下培养。
1.3 主要试剂和仪器
TCS(山东临沂优索化工科技有限公司)、全温培养箱HZP-250(上海精宏实验设备有限公司)、高压蒸汽灭菌锅XFS-280A+(浙江新丰医疗器械有限公司)、立式显微镜AXIOSKOP40(卡尔·蔡司股份公司)。
1.4 TCS抑杂菌能力检验
首先,将0.50 g的TCS加入500 mL的纯净水中,配制得到1000 mg/L的TCS悬浮液原液。将原液按比例与WPDA培养基混合可得到含不同浓度TCS的培养基。与原液混合后的培养基液体被分装进玻璃试管(18 mm×180 mm)中,分装完成后使用脱脂棉塞封口。
设置2组实验,每组实验的TCS浓度如表1所示。TCS浓度为0 mg/L的处理为对照组(Control check,CK)。实验1中培养基设置灭菌与不灭菌2种处理,这与评价亚麻籽环肽混合物对霉菌的抑制作用[20]和有机肥对黄瓜枯萎病的防治效果[21]的实验设计类似,不灭菌基质中带有各种杂菌,接近自然条件。实验1主要是为了探究TCS在发挥抑杂菌能力的同时又对六妹羊肚菌产生较小影响的浓度范围,为实验2的浓度设置提供参考依据。
实验2中,将六妹羊肚菌与枯萎病病原菌接种于同一试管培养基上,接种枯萎病病原菌3 d后再接种六妹羊肚菌,通过这种方式模拟土壤中存在枯萎病病原菌的情况。实验2中所有培养基都经过高压蒸汽灭菌后再接种。
实验1和实验2的每一种处理都设置10个重复。在实验2的浓度条件下培养了单一的枯萎病病原菌,用以观察不同TCS浓度下病原菌菌丝的微观结构差异。接种后的培养基均放入培养箱中(18±0.5)℃培养。
1.5 测量菌丝生长长度
菌丝生长长度可用于评估真菌生长情况,参考在原种培养基中测量菌丝在竖直方向上的延伸长度的方式[22-25],测量菌丝在试管中的延伸长度。实验1在接种六妹羊肚菌3 d后测量菌丝生长长度。使用不锈钢卷尺测量菌丝纵向的生长长度,当菌丝长至试管底部时测量范围为试管底部至菌丝延伸上边界,某些处理组中菌丝未长至试管底部,此时测量范围为菌丝延伸的下边界至上边界。
实验2中六妹羊肚菌与枯萎病病原菌在同一试管培养基上共同培养,六妹羊肚菌接种较枯萎病病原菌接种晚3 d。在接种枯萎病病原7 d后测量菌丝生长长度。测量菌丝生长长度的方式为测量接种块中心位置至菌丝延伸最长处的距离。
1.6 光学显微镜下观察菌丝微观结构
实验期间进行多次使用光学显微镜观察六妹羊肚菌和枯萎病病原菌菌丝结构变化。
1.7 TCS喷施的初步对比试验
试验地点选择中国四川省德阳市中江县某羊肚菌栽培基地(31.023°N,104.737°E),该基地多个地块的羊肚菌菇体出现枯萎病病害症状。选择4个出现感病菇体的区域,采用背负式电动喷雾器喷施浓度为40 mg/L的TCS悬浮液,喷施对象为明显感染枯萎病的菇体,观察喷施TCS悬浮液一周后枯萎病病症变化。
1.8 数据统计分析
以均值(x)±2倍标准差(s)判断每组数据的异常值。使用Kolmogorov-Smirnov检验和Levene检验分别对数据是否服从正态分布和是否具备方差齐性进行检验(显著性水平α=0.05)。当数据服从正态分布且具有方差齐性时,采用单因素方差分析(α=0.05)检验各组处理菌丝生长长度间是否存在统计学意义上的差异,事后多重比较选择LSD法(α=0.05)。当数据服从正态分布,但不具备方差齐性时,事后多重比较选择Dunnett’s T3法(α=0.05)。如果数据不服从正态分布,就采用Wilcoxon符号秩和检验(α=0.05)。数据统计分析使用SPSS 25.0。
2 结果与分析
2.1 不同浓度TCS处理下未灭菌的培养基杂菌污染和六妹羊肚菌菌丝生长情况
对照组(0 mg/L)培养基表面出现了大量杂菌,肉眼可见地抑制了六妹羊肚菌菌丝生长(图1-a),统计分析结果也证实了这一点,对照组六妹羊肚菌菌丝生长长度显著地低于20、40、80 mg/L处理下的菌丝生长长度。当TCS浓度为20 mg/L时,六妹羊肚菌菌丝生长长度显著地高于0、40、60、80和100 mg/L处理下六妹羊肚菌菌丝生长长度,但是在培养基表面仍能发现较多杂菌(图1-b)。高浓度TCS在抑制杂菌的同时,也抑制六妹羊肚菌的生长,TCS浓度为60和100 mg/L时,六妹羊肚菌菌丝生长长度与对照组无显著性差异。
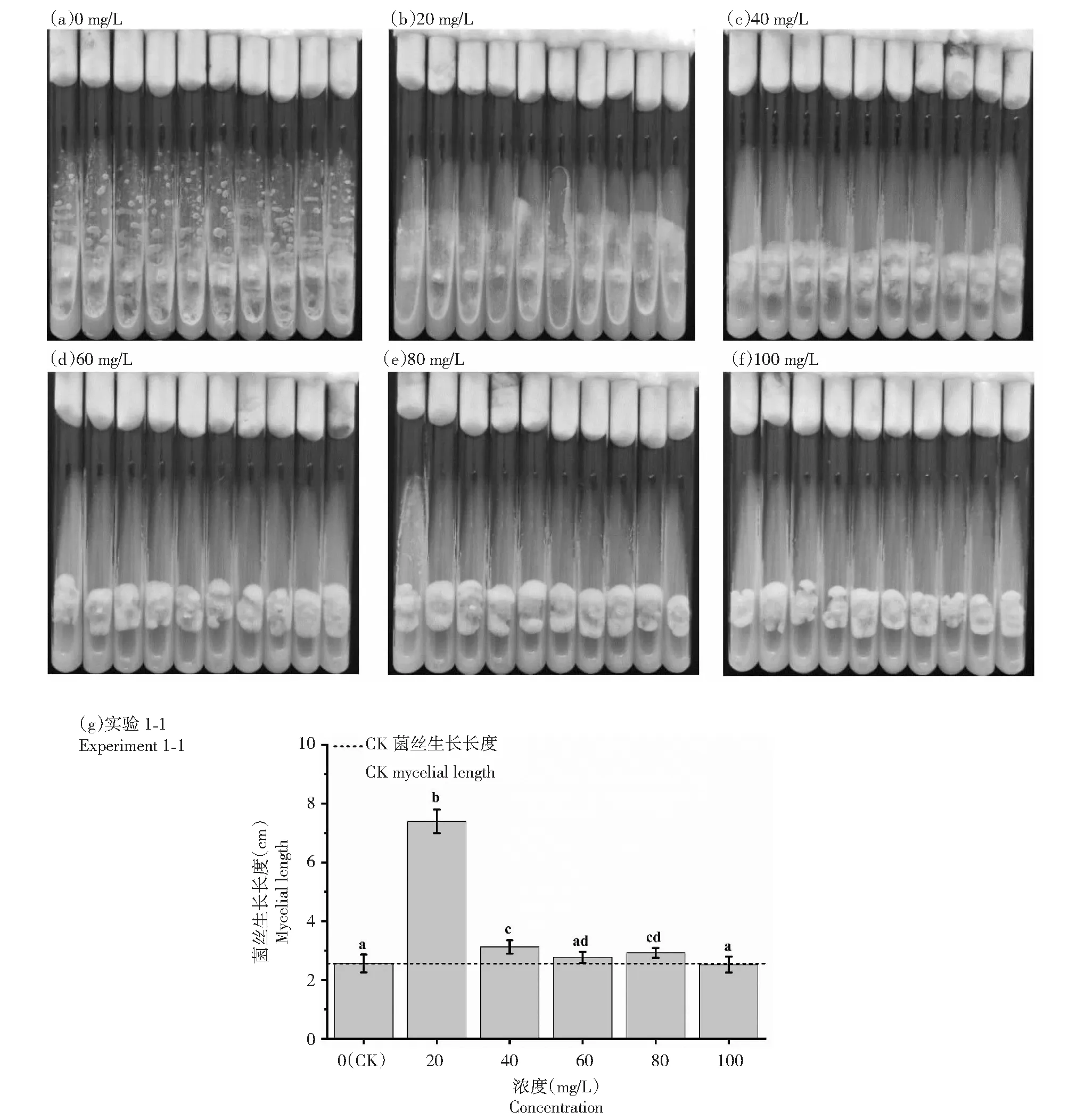
数据以x±s形式展示,带有相同英文字母表示菌丝生长长度在显著性水平为0.05的条件下不具有统计学意义上的差异。下同Data are presented as x±s, with the same English letter indicating that the mycelial length did not show a statistically significant difference at the level of 0.05.The same as below图1 不同浓度TCS处理下未灭菌的试管培养基接种六妹羊肚菌3 d后的菌丝生长长度和培养基杂菌生长情况Fig.1 Mycelial length and undesired microbes’ growth after 3 days of inoculation of M. sextelata on unsterilized test tube media under different concentrations of TCS
在不灭菌的情况下,与对照组相比,加入TCS的培养基出现杂菌的情况明显减少,且随着TCS浓度的增加,抑杂菌效果就越明显。但是,当TCS浓度过高(100 mg/L)时,TCS对六妹羊肚菌菌丝生长的抑制作用不可忽视,甚至与杂菌对六妹羊肚菌生长产生的抑制类似。

表1 各组实验的TCS浓度设置
2.2 不同浓度TCS处理下灭菌后培养基六妹羊肚菌菌丝生长情况
实验1-2中对照组的六妹羊肚菌菌丝生长长度最长,显著地高于其他处理组。40 和100 mg/L TCS处理浓度下,六妹羊肚菌菌丝生长长度没有显著性差异。培养基不灭菌处理主要是为了检验TCS是否具有良好的抑杂菌效果。培养基灭菌处理可检验在没有杂菌影响的情况下TCS浓度对六妹羊肚菌生长的影响。可发现随着TCS浓度增加,六妹羊肚菌菌丝生长长度呈下降趋势。从菌丝外观可以看出,当TCS浓度为40~100 mg/L时,菌丝主要呈团状(图2-d~图2-f);当TCS浓度较低时,菌丝生长较为整齐。

图2 不同浓度TCS处理下灭菌试管培养基接种六妹羊肚菌3 d后的菌丝生长长度Fig.2 Mycelial length and undesired microbes’ growth after 3 days of inoculation of M. sextelata on sterilized test tube media under different concentrations of TCS
2.3 不同浓度TCS处理下枯萎病病原菌与六妹羊肚菌共同培养时的生长情况
2.3.1 枯萎病病原菌和六妹羊肚菌菌丝生长情况 从菌丝外观可以看出,随着TCS浓度的增加,枯萎病病原菌和六妹羊肚菌的菌丝生长形态逐渐畸形(图3),这与实验1观察到的现象一致。
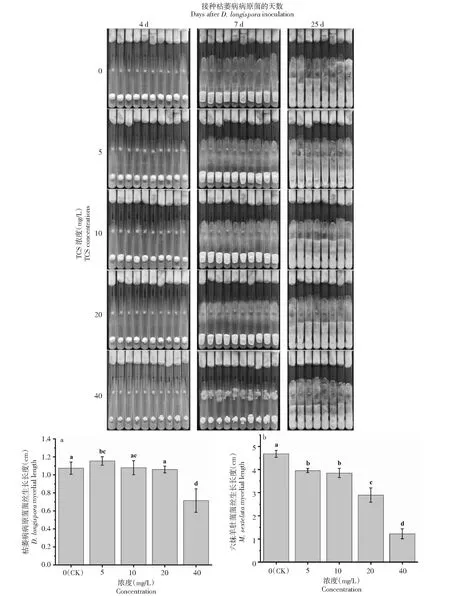
接种枯萎病病原菌25 d后每组处理已有2支培养基被用于观察光学显微镜下的菌丝微观结构;(a)接种7 d后;(b)接种4 d后,此时是接种枯萎病病原菌7 d后Two test tube media of each treatment were used to observe the microstructure of mycelium after 13 days of D. longispora inoculation; (a) After 7 days of inoculation; (b)After 4 days of inoculation, 7 days after D. longispora inoculation图3 不同浓度TCS处理下六妹羊肚菌与枯萎病病原菌共同培养时菌丝生长长度Fig.3 Mycelial length in co-cultures of M. sextelata and D. longispora under different concentrations of TCS
接种枯萎病病原菌7 d后,40 mg/L TCS浓度下霉菌性枯萎病病原菌菌丝生长长度最短,显著地低于0、5、10和20 mg/L处理下的菌丝生长长度。0、10和20 mg/L处理下的枯萎病病原菌菌丝生长长度之间没有显著性差异。同时随着TCS浓度的增加,六妹羊肚菌的菌丝生长长度也随之减小。因为已有2支试管种被用于观察显微镜下微观结构,所以接种枯萎病病原菌25 d后每组处理剩余8支试管种。此时可观察到枯萎病病原菌与六妹羊肚菌交叉生长,从外观上可看出,枯萎病病原菌菌丝在与六妹羊肚菌菌丝相接后仍逐渐向上延伸,培养基中未添加TCS的对照组中可观察到枯萎病病原菌菌丝长满整个培养基的现象。
2.3.2 显微镜观察下的微观结构 在显微镜下观察,可在六妹羊肚菌菌丝体周围发现枯萎病病原菌串珠状的厚垣孢子(图4-a、c、d),且病原菌菌丝可能侵入了羊肚菌菌丝(图4-b、e、f)。显微镜下未观察到六妹羊肚菌的分生孢子。羊肚菌在人工栽培过程中容易产生分生孢子,但是在实验室培养中没有观察到分生孢子的产生[26]。

接种枯萎病病原菌35 d后,箭头指出附着在羊肚菌菌丝周围的枯萎病病原菌菌丝和孢子After 35 days of D. longispora inoculation.Arrows point to the mycelia and spores of D. longispora attached to mycelia of M. sextelata图4 不同浓度TCS处理下六妹羊肚菌与枯萎病病原菌交叉生长区域菌丝形态Fig.4 Mycelial morphology in the co-growth area of M. sextelata and D. longispora under different concentrations of TCS
在40 mg/L的TCS处理浓度下,枯萎病病原菌产生的分生孢子出现畸形、破裂和内容物外泄现象(图5)。在其他TCS处理浓度(0、5、10、20 mg/L)下未观察到此现象。

图5 接种单一枯萎病病原菌41 d后不同浓度TCS处理下分生孢子形态Fig.5 Conidia morphology under different concentrations of TCS after 41 days of D. longispora inoculation
2.4 TCS喷施的初步对比试验结果
真菌性病害爆发速度快,会很快地扩散至周围区域[11]。初步对比试验的结果表明对感染枯萎病的羊肚菌喷施40 mg/L的TCS悬浮液后,枯萎病未出现大范围扩散现象。可明显看出生长在感病菇体周围的大部分健康菇体在7 d后并未出现枯萎病感染症状(图6-e~图6-h)且生长正常。
3 讨 论
食用菌病害包括侵染性病害和竞争性病害,如木霉菌(Trichodermaspp.)是最常见的食用菌侵染性病害病原菌[27]。在对峙实验中可观察到棘孢木霉(T.asperellum)的分生孢子附着在平菇菌丝周围[28],多个木霉菌株都能侵入香菇(Lentinusedodes)菌丝体中[29]。本实验发现枯萎病病原菌孢子附着于六妹羊肚菌菌丝周围且病原菌菌丝侵入六妹羊肚菌菌丝的现象,这与木霉侵染平菇和香菇的表现一致,然而目前病原真菌侵染食用菌菌丝的具体过程还没有深入研究[29],仅推测枯萎病属于侵染性病害。
抑制病菌的菌丝生长是抑菌剂产生效果的表现。枯萎病病原菌的菌丝生长长度随着TCS浓度的增加而降低,表明TCS对羊肚菌枯萎病病原菌的菌丝生长表现出了抑制作用。这一结果与以下抑菌剂对某些致病菌菌丝造成的抑制效果相似:氰烯菌酯和种菌唑对水稻恶苗病病原菌(Fusariumfujikuroi)具有很高的抑真菌活性,表现为对菌丝生长产生抑制[30]。从香荚兰(Vanillaplanifolia)中萃取的o-Vanillin能够抑制污染粮食作物的真菌Aspergillusflavus菌丝生长,表现为随着o-Vanillin剂量的提高,菌落直径减小,菌丝抑制率不断增加[31]。
TCS可以抑制细菌在FabI(烯酰—酰基载体蛋白还原酶)步骤中的脂肪酸合成,这种抑制作用会造成膜完整性的丧失[32]。虽然TCS的作用机制被归结为对脂肪酸生物合成的抑制,但有研究证明TCS的抑菌作用至少部分是通过嵌入磷脂膜,造成膜结构扰动介导的,它可能发挥了一种独立于抑制脂肪酸生物合成的抑菌作用[33-34],但是这些作用都最终表现为细胞膜完整性的破坏。此外,TCS可干扰FabB(3-氧代-酰基载体蛋白合成酶I),从而防止细菌形成菌落[35],这解释了在不灭菌处理下添加了TCS的培养基很少或几乎没有细菌污染的现象。
在真菌性病害中,病原菌和食用菌同属于真菌,无性孢子是病原菌的初侵染与再侵染源,因此控制病原菌的孢子萌发非常重要[36]。在40 mg/L的TCS处理下枯萎病病原菌分生孢子的畸形、破裂和内容物的外泄,说明在该浓度处理下,TCS对枯萎病病原菌已表现出良好的抑真菌活性。细胞膜是真菌细胞吸收营养并与周围环境交换物质能量的重要屏障,它的完整性在维持细胞活力方面起着重要作用[37],破坏细胞膜的完整性是抑菌剂发挥作用的一种方式[38]。在喷施40 mg/L的TCS悬浮液后,羊肚菌枯萎病扩散现象得到有效抑制。
目前,多种化学抑菌剂被用于防治食用菌的杂菌污染和病害,选择抑菌剂应该坚持高效、低毒和低残留的原则,其次是考虑食用菌对抑菌剂的敏感性[39]。病原菌与食用菌同属于真菌,具有类似的生理特征,对病原菌有强烈抑制作用的抑菌剂可能无法避免对食用菌也有抑制作用[36]。因此,应选择具有良好防治病菌效果,又对食用菌本身影响较小的抑菌剂。中国农药信息网(http://www.icama.org.cn/hysj/index.jhtml)的农药登记数据中,可查询到13 条用于食用菌(蘑菇)生产的抑菌剂,包含的农药种类有咪鲜胺锰盐、二氯异氰尿酸钠、百菌清和噻菌灵,施用方法一般为拌料或喷雾。目前还未见到用于羊肚菌栽培生产的农药备案[11]。
多菌灵常用于抑制食用菌生产过程中的杂菌生长。在PDA平板中不同浓度多菌灵对茶树菇(Agrocybeaegerita)菌丝生长产生明显抑制作用,不同浓度的处理组(10、15、20、25、30、35和40 μg/mL)与对照组菌丝生长速度差异极显著(P<0.01),且随着浓度增大抑制作用增强[40]。对绿色木霉(T.viride)菌丝有抑制作用的多菌灵对平菇菌丝生长也具有抑制作用,500、1000、2000、4000倍稀释的多菌灵对平菇菌丝生长速度的影响与对照相比差异极显著(P<0.01),抑制作用与施加药剂浓度呈正相关[41]。测试杀真菌剂对菌盖疣孢霉菌(Mcogoneperniciosa)和双孢蘑菇(Agaricusbisporus)菌丝的毒力差异,得到咪鲜胺类杀菌剂施保功和施保克对菌盖疣孢霉菌菌丝、疣孢霉菌分生孢子和双孢蘑菇菌丝都具有较强的抑制作用,而施保功在双孢蘑菇上已取得登记,可以应用于生产[42]。

方框圈出菇体感染枯萎病的部位Boxes mark the part of morels infected by D. longispora图6 喷施的TCS悬浮液(40 mg/L)7 d后感染枯萎病的羊肚菌生长状态Fig.6 The growth state of morels infected by D. longispora after 7 days of spraying TCS suspension(40 mg/L)
TCS浓度的增加会造成六妹羊肚菌菌丝生长受到抑制。TCS浓度越高,抑制作用越明显。这与上述某些在现实中得到应用的化学抑菌剂对食用菌产生的影响具有一致性。因此,选择合适的抑菌材料和控制施用浓度十分重要。
慢性毒性试验中,在Sprague-Dawley大鼠的饮食中以4种剂量水平(0、300、1000和3000 mg/L)施用TCS,为期2年。另外的实验组以6000 mg/L的剂量施用1年。结果显示,TCS对大鼠死亡率没有显著影响,在饮食TCS剂量为3000 mg/L的大鼠中观察到肝脏疾病,但在1000 mg/L的剂量水平下未发现大鼠肝脏组织变化,可认为1000 mg/L是TCS长期口服的“无影响水平”,毒理学和药代动力学研究以及临床调查表明,TCS对人类一般没有毒性潜力[13]。
《牙膏用原料规范》 (GB 22115—2008)中规定的TCS最大允许使用浓度为0.3%[43],本研究结果表明40 mg/L的TCS足够抑制羊肚菌枯萎病,该浓度仅占牙膏中最大允许使用浓度的1.3%,且并不需要长期施用。欧洲消费者安全科学委员会(Scientific Committee on Consumer Safety)评估了TCS应用于消费品的安全性,在总结中表明漱口水中0.2%的最大TCS添加浓度和牙膏中0.3%的最大TCS添加浓度是安全的[44]。尽管TCS能够以0.3%的最大浓度被添加到牙膏(口腔护理产品)中,它在羊肚菌这一食用菌栽培上的应用安全性仍需要在未来得到进一步的研究。
4 结 论
(1)TCS能够有效控制羊肚菌菌种生产和栽培过程中的杂菌污染,对特定的枯萎病病原菌也具有良好抑制效果,表现为对菌丝生长的抑制和孢子完整性的破坏。
(2)在田间栽培环境中病菌污染风险远大于实验室环境,特别是在栽培环节,羊肚菌栽培种被直接播种于土壤中,病菌污染的可能性更大。TCS喷施的初步对比试验结果表明在这种高风险环境下,TCS仍表现出了肉眼可见的抑制羊肚菌枯萎病扩散的良好效果。
(3)高浓度的TCS会对六妹羊肚菌的生长具有抑制作用,但是与病菌污染造成的抑制作用相比,一定浓度范围内(10~40 mg/L)TCS产生的抑制作用影响较小。本实验的发现表明TCS可能成为一种具有前景的应对羊肚菌枯萎病的抑菌材料。
致 谢:感谢中国科学院成都山地灾害与环境研究所的邱敦莲研究员在文章撰写和修改过程中给予的意见和建议。
