应用非变性质谱-行波式离子淌度谱表征完整糖蛋白复合物的稳定性及小规模结构差异
2022-09-29柴胡玲潇王冠博
徐 香,柴胡玲潇,王冠博
(1.南京师范大学化学与材料科学学院,江苏 南京 210023; 2.深圳湾实验室细胞分析研究所,广东 深圳 518132;3.北京大学生物医学前沿创新中心,北京 100871)
蛋白的糖基化是最为常见和多样化的翻译后修饰,影响着蛋白质的构象、稳定性和溶解度,同时在分子识别、信号传导和免疫防御等方面具有关键作用[1-2]。研究糖蛋白生物功能有赖于对糖蛋白进行多层次结构分析和动态性分析。其中,获取关于糖蛋白修饰程度、蛋白型(proteoform)分布、糖蛋白相互作用、结合计量关系、构象动态变化等方面的信息,则有赖于在完整糖蛋白或完整复合物层面的结构表征。作为与X射线晶体衍射、冷冻电镜、核磁共振等经典生物物理学手段高度互补的技术,生物质谱能够在分析物尺寸、纯度或复杂度、空间分辨能力(部分情况下)、即时性等方面突破局限,已成为生物大分子结构表征的有力工具[3]。在结构质谱策略中,非变性质谱能够在分析过程中最大限度地保持生物大分子体系中关键的非共价作用[4],从而维系完整的复合物体系和初始构象,在蛋白质高级结构和动态学分析中发挥独特作用[5]。为丰富可获取的结构表征信息,科研人员将非变性质谱与串联质谱联用以增加结构表征的深度,并与离子淌度谱联用以增加结构表征的维度[6]。离子淌度不仅可基于不同离子的气相淌度差异实现离子分离、降低质谱图复杂度,还可在行波式(travelling-wave)离子淌度等特定类型的淌度方案中实现碰撞截面积(CCS)的测定,提供分析物几何形貌层面的结构信息[7]。行波式离子淌度模块可置于质谱仪器内部的不同质量分析器之间,利用行波原理取代传统的漂移管原理,能够大幅减少离子损失,提高灵敏度[8]。这一特性对于分析生物大分子具有独特优势,离子淌度谱与非变性质谱的结合已在蛋白质及蛋白质复合物分析中发挥了重要作用,在分析蛋白质构象变化、去折叠/重折叠、蛋白凝集、蛋白质复合物的组装和结构演变等方面提供关键信息[9]。
除以上提及的大规模结构变化外,小规模结构变化或差异的表征对于糖蛋白结构分析也具有重要意义。糖蛋白分子中含有分子质量及个数各不相同的单糖残基,形成宏观异质性(糖基化位点的占据程度差异)和微观异质性(各糖基化位点的糖链结构差异),由此产生的各蛋白型呈现一定的分子质量分布[10]。糖蛋白的蛋白型异质性解析和针对特定蛋白型亚群分布的分析对于糖基化与构象关联性等结构研究[11]、糖基化与亲和力关联性等功能研究[12]、以及蛋白质药物的关键质量属性分析[13]等具有重要意义。离子淌度谱已被用于在游离糖链或糖肽层面进行异质性或异构体解析[14-19],并在完整蛋白层面体现了部分蛋白型的淌度差异[20-21],但对于是否能够实现蛋白型的有效分离尚有待深入验证。在蛋白质-配体复合物结构分析方面,离子淌度可揭示配体结合所引起的构象变化[22],然而糖蛋白自身的异质性增大了糖蛋白自身复合物的异质性,进而增大了复合物与其他分子所形成的高阶复合物的复杂程度,离子淌度对此类高阶复合物的分辨能力有待证明。此外,蛋白质复合物的质谱分析常使用减电荷试剂降低蛋白离子价态以降低谱图的复杂性或强化生物大分子复合物的稳定性[23],也常使用增电荷试剂提高蛋白离子价态以改善串联质谱性能[24]。明确这些电荷调控操作是否会造成蛋白质分析物结构的人为改变以及改变程度对于方法准确性评价至关重要,尤其在已有证据表明部分增电荷试剂可导致一定程度构象变化的情况下则更具迫切性[25-26]。离子淌度已被用于监测增、减电荷试剂对蛋白构象的影响[27-30],但不同蛋白型在电荷调控条件下的结构和稳定性是否存在差异尚有待深入研究。
针对上述问题,本研究以亲和素复合物及亲和素-生物素复合物作为模式蛋白体系,利用与行波式离子淌度相结合的非变性质谱及串联质谱探究离子淌度对于复合物层面及亚基层面的蛋白型亚群分辨与分离、亚基解离过程伴随的构象变化、复合物结合小分子形成高阶复合物的形态变化、电荷调控条件下的结构响应等方面所能提供的结构信息收益;并通过对由不同物种表达的亲和素在上述方面的CCS差异,探索离子淌度应用于蛋白复合物稳定性评价的可行性。
1 实验部分
1.1 主要仪器与装置
Synapt XS三重四极杆-离子淌度-飞行时间质谱仪:英国Waters公司产品,配有静态纳升电喷雾离子源(nanoESI);5424R台式冷冻离心机:德国Eppendorf公司产品;DS-11+光谱仪:美国Denovix公司产品。
1.2 主要材料与试剂
重组亲和素(avidin 1,由玉米细胞表达,经亲和纯化提取,≥12 units/mg,纯度≥80%,质量水平200)、天然亲和素(avidin 2,由鸡蛋蛋白经亲和纯化提取,≥10 units/mg,纯度≥98%,质量水平200);牛血清白蛋白(BSA)、牛红细胞细胞泛素(ubiqutin)、马心肌肌红蛋白(myoglobin)、马心肌细胞色素c蛋白(cytochrome c)、生物素(biotin,色谱级)、乙酸三甲基铵(triethylammonium acetate, TEAA,色谱级)、间硝基苄醇(m-nitrobenzyl alcohol,m-NBA,质谱级):均为美国Sigma-Aldrich公司产品;醋酸铵(NH4Ac,色谱级):阿拉丁(中国)公司产品;乙酸(色谱级):麦克林(中国)公司产品;甲醇(色谱级):美国Thermo Fisher公司产品;离心超滤套装(分子质量截留10 ku):美国Merck Millipore公司产品。
1.3 实验条件
1.3.1样品制备 将蛋白粉末用150 mmol/L醋酸铵溶液溶解,使用10 ku截留的超滤管,以11 000 r/min离心过滤,将亲和素等蛋白质样品的原缓冲液置换为150 mmol/L醋酸铵溶液,制得浓溶液。对于非变性条件的蛋白样品,以150 mmol/L醋酸铵溶液将蛋白浓溶液稀释至7 μmol/L(亲和素)或10 μmol/L(其他校正蛋白);对于变性条件的蛋白样品(仅用于校正),以甲醇-水-乙酸溶液(49∶49∶2,V/V/V)将校正蛋白浓溶液稀释至10 μmol/L。向亲和素溶液中加入过量生物素以制备亲和素-生物素复合物。
1.3.2质谱条件 使用静态纳升电喷雾离子源进样,离子源温度120 ℃,补偿30,源离子引导波速10 m/s,波形高1 V,四极杆分辨4.7。在高纯氮气(纯度>99.99%)下进行离子淌度测定,波速4.6 m/s,波形高43.3 V;传输波速17.1 m/s,波形高4 V。在亲和素单体测定中,采用碰撞诱导解离(CID)将亲和素单体从四聚体形式解离出来。为获得更宽的单体价态分布,且减弱四聚体母离子的特定价态对单体价态及去折叠程度的影响,四聚体的全部价态均用作生成单体的母离子。
1.4 数据处理
质谱及离子淌度数据使用MassLynx v4.2(Waters,英国)、DriftScope v2.9(Waters,英国)及Origin Pro(OriginLab,美国)软件处理。离子淌度测定中的迁移时间校正及CCS校正依据文献[31-32]进行。
2 结果与讨论
2.1 同种糖蛋白复合物不同蛋白型的分辨与分离
尽管来自鸡蛋白的avidin 2及由玉米细胞表达的重组avidin 1蛋白的氨基酸序列完全一致,但由于糖基化等修饰程度不同而呈现明显的分子质量分布差异。非变性条件下,avidin以四聚体形式存在,肽链的理论分子质量为57.2 ku。Avidin 1及avidin 2四聚体最高丰度蛋白型的实测分子质量分别为62.3、63.7 ku,示于图1a。与avidin 1相比,avidin 2四聚体的分子质量分布更宽,且呈现可部分分辨的多重亚群分布。其中,将丰度次高及最高的亚群分布分别记为分布Ⅰ和分布Ⅱ,各自对应的最高丰度蛋白型的实测分子质量分别为62.3、63.7 ku。Avidin 1及avidin 2的各价态四聚体离子均呈现稳定的迁移时间差异(示于图1b,取覆盖最高丰度蛋白型、半峰宽m/z150的分布亚群),糖基化程度较高、分子质量较大的avidin 2迁移时间稍长。分别提取avidin 2分布Ⅰ和Ⅱ中亚群离子的迁移时间谱(取覆盖最高丰度蛋白型、半峰宽m/z50的分布亚群),二者在各价态上均呈现稳定的差异,糖基化程度较高、分子质量较大的亚群离子迁移时间更长,示于图1c。尽管avidin 2分布Ⅰ的分子质量略高于avidin 1,但前者的迁移时间短于后者。针对上述糖蛋白复合物的CCS计算结果,avidin 1的CCS介于avidin 2的分布Ⅰ和Ⅱ之间,示于图1d。结果表明,利用行波式离子淌度模块可以在迁移时间维度上有效地分离糖基化程度不同的蛋白型亚群。由于上述复合物的分子质量差异源自糖基化成分,而对于具有分支结构的糖链,其空间伸展程度并不单纯地与分子质量相关(不对称性较高的糖型结构,如Man5GlcNAc2比分子质量相近的对称糖型空间伸展程度更高;具有多重分支结构的糖型,如Man5GlcNAc5比分子质量相近的具有双分支主体结构的其他常见糖型伸展程度更低;这些糖型均存在于avidin中[33]),这表明由玉米细胞表达的avidin 1糖链结构整体伸展程度高于avidin 2。
随后,本工作研究了基于离子淌度分离维度上针对糖基化程度不同的蛋白型亚群进行分离的可行性。在0.2 ms迁移时间窗口、不同迁移时间内,经质谱检测的单一价态离子呈现显著收窄的分子质量分布,有效地分离了部分主要蛋白型,示于图1e,这种分离模式与色谱-质谱联用相似。在完整蛋白层面,同种糖蛋白不同蛋白型之间多肽链主干及宏观构象相同,糖基化差异体现的化学或物理性质差异难以体现蛋白整体的理化性质差异,因此,难以利用常规的液相色谱等方式进行分离。在质谱测定中,较大尺寸的糖蛋白及其复合物随着糖基化位点和糖型组合的增多,各蛋白型的分子质量差异不足以超过蛋白型亚群分子质量的分布宽度,因此质谱信号高度重叠,难以实现有效地蛋白型分离。在行波式离子淌度与质谱联用条件下,多个蛋白型亚群的气相分离得以实现,能够可控地提取特定分布的蛋白型亚群,为大型糖蛋白及糖蛋白复合物的异质性解析和精细结构分析提供了有效的方案。
2.2 糖蛋白复合物解离所得亚基的结构差异
Avidin四聚体经CID作用可解离为亚基单体。由于单体所含糖基化位点减少、各糖型组合的可能性减少,各蛋白型信号在飞行时间质谱中得以充分分辨,示于图2a。与avidin 1相比,avidin 2单体的蛋白型分布更复杂,分子质量分布更宽,且高丰度蛋白型分子质量数值更大,与对avidin四聚体的分子质量分布表征结果一致。值得注意的是,在avidin 2的单体信号中出现了显著的不同价态信号交错现象,看似同一价态的信号簇内实际上包含不同价态的蛋白型信号,因此需对单体信号进行细致地价态和分子质量分析,以免引起CCS值的错误计算。分子质量不同的各蛋白型在离子淌度测定中呈现程度不等的迁移时间差异,导致差异程度不等的CCS计算值。本工作在avidin 1中选取分子质量分别为15.38、15.51、15.68 ku的3种主要蛋白型(记为A、B、C)作为示例,示于图2b。3种蛋白型在+8~+10的3个主要价态下的CCS排序与分子质量排序一致,均仅呈现微小的CCS差别(小于0.1 nm2)。而avidin 2中分子质量分别为14.29、14.55、15.57 ku的3个蛋白型(记为D、E、F)之间则体现了较大的CCS差异,示于图2c。蛋白型D与E的分子质量相差0.3 ku,但二者之间的CCS差异可超过0.4 nm2,远超过同样具有0.3 ku分子质量差异的avidin 1蛋白型A与C之间的CCS差异。

注:红色表示avidin 1,蓝色表示avidin 2;箭头所示为用于离子淌度分析的蛋白型A-B的+9价离子对应的质谱信号图2 由四聚体解离获得的avidin 1和avidin 2单体蛋白的质谱图, avidin 1单体蛋白型A~C(b)和avidin 2单体蛋白型D~F(c)的CCS值Fig.2 Mass spectra of monomeric avidin 1 and avidin 2 released from the corresponding tetramers (a), cabculated CCS values of proteofroms A-C of avidin 1 (b) and proteofroms D-F of avidin 2 (c)
在avidin四聚体的离子淌度测定中,avidin 2的蛋白型整体CCS高于avidin 1,示于图1d;但在对解离单体的离子淌度测定中,avidin 2单体的CCS普遍低于avidin 1,甚至分子质量较高的avidin 2蛋白型F的CCS也并未高于分子质量较低的avidin 1蛋白型C,示于图2c。由于此处测定的avidin单体均由四聚体经CID碎裂产生,单体的空间伸展程度既与自身结构相关,也受碰撞过程中能量传递的影响。在对蛋白质复合物的非变性质谱及基于CID的串联质谱测定中,蛋白亚基解离往往伴随非对称电荷分配现象,即被解离的亚基所携带的电荷占母离子整体电荷的比例远高于其质量占比[34],其自身也发生高度的去折叠[35],二者之间可互为因果[5]。Avidin 1及avidin 2解离单体的CCS值均远大于四聚体实测CCS值的1/4(已接近60%),体现了离去亚基的去折叠程度。离去亚基发生去折叠所需的能量来源于碰撞过程,去折叠程度与能量相关[5]。由于各样品中不同蛋白型离子均在相同的碰撞条件下生成,可获取的额外能量均等,但克服分子间相互作用脱离原复合物所需的能量可能因蛋白型的修饰程度不同而异。分子质量相近的不同蛋白型,如因糖链组成和结构差异引起的亲和力差异[36],可能导致在具有相同碰撞能量输入的情况下,克服解离所需能垒后剩余的额外能量不同,从而使解离产物中呈现不同的去折叠程度,导致CCS值的差异。而avidin 2解离单体CCS值普遍低于avidin 1的现象表明,天然的avidin 2复合物内亚基间亲和力高于人工重组的avidin 1。
2.3 高阶糖蛋白复合物结构
与过量biotin(分子质量244.3 u)混合后,每1分子avidin四聚体与4分子biotin结合形成高阶复合物,分子质量增大977 u。由于biotin与avidin的亲和力极高(Kd≈10-15mol/L)[37]、结合计量比高度确定,因此biotin的结合不改变avidin蛋白型的原有分布,示于图3a。Biotin的结合使avidin四聚体的CCS值略有增大,但对于avidin 1和avidin 2四聚体,biotin结合前后引起的CCS变化均不大于分子质量差异更小的avidin不同蛋白型分布之间的CCS差异,示于图3b。在水溶液中,biotin取代若干处于与avidin结合态的溶剂分子而与avidin结合,结合位点处于复合物空间结构内的空腔区域,并不引起水合半径的显著变化[38]。离子淌度测定结果表明,在非变性质谱分析中,avidin-biotin复合物进入气相后,原处于空腔区域的biotin并未显著暴露于外部,CCS值并未显著增加,符合非变性质谱条件不显著改变蛋白复合物原有架构的预期。结合biotin后,糖基化程度不同的avidin复合物蛋白型之间仍呈现原有程度的CCS差异。
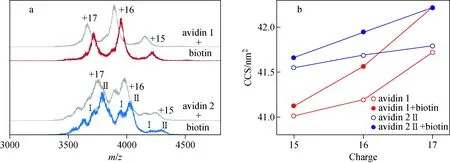
注:红色表示avidin 1与biotin的复合物;蓝色表示avidin 2与biotin的复合物;灰色表示未与biotin结合的adivin图3 Avidin 1、avidin 2四聚体与biotin复合物及未结合biotin四聚体的质谱图(a), avidin四聚体与biotin结合前后的CCS值比较(b)Fig.3 Mass spectra of tetrameric avidin 1 and avidin 2 in complex with biotin and unbound tetramers (a), comparison of calculated CCS values of avidin tetramers before and after binding with biotin (b)
2.4 电荷调控条件下糖蛋白复合物及亚基构象变化
使用TEAA对avidin进行减电荷处理后,四聚体的主要价态由常规条件下的+15~+17减小到+11、+12,示于图4a。相应地,使用mNBA对avidin进行增电荷处理后,四聚体主要价态显著升高,其中avidin 1的升高程度显著高于avidin 2。此外,在增电荷测定中,未施加任何源内碎裂条件下,avidin 2仍保持稳定的四聚体复合状态,而avidin 1发生了显著解离,在质谱图中呈现游离的二聚体及单体信号。这些解离产物的电荷密度较高,体现了不对称电荷分配,因此可判定为气相解离产物而非溶液相解离产物[5]。这表明,经mNBA处理后的avidin 1四聚体稳定性显著减弱,在未施加源内碎裂的常规温和条件下易发生气相解离。而同样经mNBA处理后的avidin 2四聚体仍保持完整,验证了2.2节中关于天然avidin 2复合物内亚基间亲和力高于人工重组avidin 1的推论。对比常规条件及电荷调控条件下avidin四聚体的CCS测定值,增、减电荷处理均使不同价态间四聚体离子的CCS差异增大,示于图4b。在人工调控电荷的条件下,复合物整体价态升高意味着表面电荷密度增大,电荷间斥力可导致气相蛋白离子能量升高、稳定性降低、松散程度增大;反之亦然。离子淌度测定结果与此相符。经mNBA增电荷获得的avidin 1和avidin 2四聚体离子CCS较常规条件获得的离子CCS增加幅度可分别达到19%和4%,后者与同样使用mNBA增电荷处理的630 ku复合物CCS增加幅度相当[26],凸显了avidin 1在增电荷试剂作用下的显著失稳效应。经TEAA减电荷获得的avidin 1和avidin 2四聚体离子CCS较常规条件获得的离子CCS分别减小8%和7%,幅度高于以咪唑作为减电荷试剂对分子质量超过800 ku的大型复合物产生的CCS减小效果(约5%)[28]。此外,增电荷条件下,avidin 1四聚体CCS随价态升高的上升幅度显著大于avidin 2,进一步佐证了avidin 2复合物的稳定性强于avidin 1。离子淌度数据与质谱数据对稳定性评价的一致性表明,在评价环境条件对蛋白复合物稳定性影响时,CCS变化幅度可作为评价指标。在条件变化不足以破坏复合物完整性时,单纯的质谱数据难以提供评价依据,此时离子淌度测定可发挥重要作用。
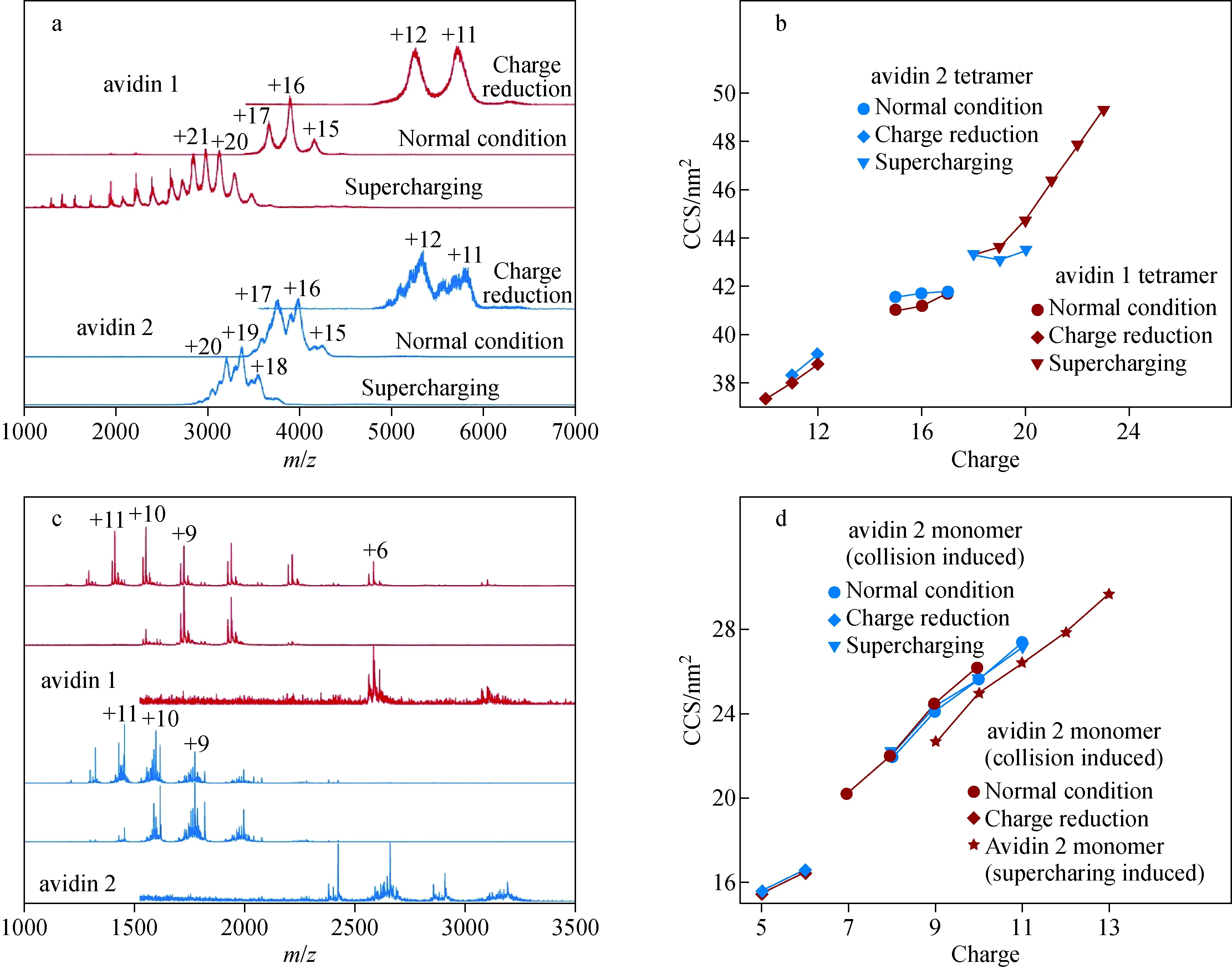
图4 Avidin 1、avidin 2在减电荷、常规及增电荷条件的质谱图(a);avidin四聚体在常规 及电荷调控条件的CCS值对比(b);avidin 1、avidin 2在增电荷、常规及减电荷条件下 通过CID所得单体的质谱图(c);avidin单体在常规及电荷调控条件下的CCS值对比(d)Fig.4 Mass spectra of avidin 1 and avidin 2 acquired under charge-reduction, normal and supercharging conditions (a); comparison of calculated CCS values of avidin tetramers under normal and charge manipulation conditions (b); mass spectra of monomeric avidin 1 and avidin 2 released through CID under supercharging, normal and charge-reduction conditions (c); comparison of calculated CCS values of avidin monomers under normal and charge manipulation conditions (d)
在电荷调控条件下,由于复合物整体稳定性和复合物可提供的电荷总量发生变化,由复合物解离所得的单体价态分布随之发生相应变化。Avidin四聚体增电荷处理后,经CID解离所得单体的最高丰度价态提升1~2个单位,而减电荷处理后单体价态可降低3个单位,示于图4c。本工作选取avidin 1的最高丰度蛋白型B和avidin 2的最高丰度蛋白型F进行CCS分析,示于图4d。在减电荷条件下,avidin 1和avidin 2的单体CCS值差异程度与常规条件相当,表明减电荷操作未引起二者去折叠程度的显著差异。在增电荷条件下,avidin 2经CID所得单体CCS值并未显著增加,表明增电荷条件并未显著提升单体的去折叠程度,进一步验证了avidin 2复合物的稳定性未受显著影响。增电荷avidin 1在一级质谱条件下所得单体的CCS值(图4d星状数据点)显著低于上述高价态avidin单体的CCS值。这表明,尽管在弱碰撞条件下获得的单体价态分布与CID条件所得的单体难以区分,但可在CCS值上呈现显著差异。非变性质谱条件下的价态分布常用作蛋白构象的变化依据[39],基于离子淌度分析获得的CCS值可以更灵敏地反映构象变化。
3 结论
本工作以由不同物种表达avidin作为模式糖蛋白复合物体系,针对常见的糖蛋白复合物表征需求,在蛋白型分辨与分离、糖蛋白复合物亚基解离、高阶复合物结构、电荷调控条件下的构象变化等方面,考察了行波式离子淌度分析在非变性质谱分析中可为糖蛋白复合物稳定性和小规模结构变化表征发挥的作用。离子淌度具备在完整糖蛋白或复合物水平上对部分蛋白型亚群分布进行气相分离的能力,能够可控地提取特定分布的蛋白型亚群,有利于完整糖蛋白及复合物的异质性解析;能够反映非变性质谱条件下高阶复合物的架构维系;能够以较高的分辨能力灵敏地反映蛋白质在气相解离、电荷调控以及经电荷调控的气相解离条件下的构象变化程度,从而应用于蛋白复合物体系的稳定性分析。不同物种表达的avidin复合物体现了显著的稳定性差异,以及自身结构对电荷调控的响应差异。这些结果证明了离子淌度在完整蛋白层面对糖蛋白及复合物稳定性和小规模结构变化及差异的分析能力,可与多种质谱手段结合,为糖蛋白及复合物的多层次精细结构及动态结构解析提供灵活有效的研究方案。
致谢:感谢深圳湾实验室多组学质谱平台提供的仪器支持,以及殷海娣博士的技术协助。
