丹参SmCOP1与调控丹参酮和丹酚酸合成相关转录因子互作筛选*
2022-09-29邓淮钰郭园艺张骥骜郭宏波麻鹏达
邓淮钰,李 倩,郭园艺,张骥骜,郭宏波**,麻鹏达**
(1. 西北农林科技大学化学与药学院 咸阳 712100;2. 西北农林科技大学生命科学院 咸阳 712100)
丹参(Salvia miltiorrhizaBunge)是唇形科鼠尾草属的药用植物,被誉为治疗心脑血管类疾病的重要中药材之一,其干燥根及根茎通常作为药材被使用,富有诸多有效药用成分如丹参酮Ⅰ、隐丹参酮、二氢丹参酮和丹参酮ⅡA 等脂溶性成分,以及丹酚酸A、迷迭香酸以及丹酚酸B 等水溶性成分[1]。但是丹参中有效药用物质的含量受各种因素影响,不同产地来源的丹参药用成分含量的差异高达10 倍[2-3]。近年来大多研究集中在提高丹参药用成分含量和开发利用丹参资源等方面,对代谢过程中关键转录因子进行调控是重要方法之一,丹参重要药用活性成分丹参酮和丹酚酸类物质合成通路中关键转录因子家族包括bHLH 家族[4-5]、MYB 家族、ERF 家族、WRKY 家族以及AREB/ABFs 家族等[6],一方面可以过表达关键转录因子促进相应代谢物质的积累,如提高转录因子SmMYB36 表达量能有效促进丹参酮积累[7],过表达SmMYB98 能使丹参酮和丹酚酸的含量升高[8],另一方面可以对关键转录因子进行修饰来提高药用成分含量,但是转录因子如何调控丹参酮及酚酸类次生代谢物质合成通路并不完全清楚,泛素化修饰转录因子调控丹参活性物质合成的研究也较少。
泛素化修饰是植物细胞中蛋白质翻译后表达修饰的重要部分,主要通过在一组酶的作用下使得泛素分子靶向修饰底物即靶蛋白从而使其稳定性和亚细胞定位发生变化后改变植物生长发育以及次生代谢过程。其广泛参与细胞生命体各个活动,如通过参与ABA 信号来促进或抑制植物种子萌发[9]、介导植物冷胁迫相关激素信号通路响应冷胁迫[10]、参与对水分胁迫和干旱胁迫处理的负调节作用如与野生型水稻相比,Ubi:RNAi-OsPUB41敲除突变体和ospub41抑制突变体在蒸腾失水、长期脱水反应中表现出更强的抗旱性[11]。可见,泛素化修饰可参与信号传导从而调控植物生命活动。蛋白泛素化过程主要以三种酶完成,即E1 泛素活化酶、E2 泛素激活酶和E3 泛素连接酶。而E3泛素连接酶在泛素化过程中承担主要的作用,其负责识别目标蛋白从而使得泛素分子从E2 泛素连接酶上脱离而作用于靶蛋白[12]。E3 泛素连接酶COP1(constitutively photomorphogenic1)具有许多种类,在蛋白质泛素化过程中特异性识别靶蛋白,并通过26S 蛋白酶体系统参与靶蛋白的泛素化[13-14]。其是一个保守的RING 类型E3Ub(ubiquitin)泛素连接酶,通过Ub 蛋白酶体系统介导各种光形态发生促进转录因子的降解,而其他COP/DET/FUS 蛋白可能协助这一过程[15-17]。研究发现,COP1 可以介导拟南芥中转录因子MYB 和bHLH 对植物萌发生长、光形态建成以及次生代谢等生理过程的调控[18-19]。拟南芥COP1 受光照负调控,其大多与核定位蛋白结合抑制光形态建成[20]。如COP1定位细胞核内靶向结合bHLH 转录因子HFR1 并通过26S蛋白酶体途径进行降解,而光照可促进COP1从细胞核向细胞质转移而逆转该作用,从而促进HFR1 的积累[21]。COP1 也可以与光照共同影响拟南芥中的MYB 转录因子PAP1 和PAP2 蛋白稳定性[22]。苹果中E3 泛素连接酶MdCOP1 在黑暗条件下会与MdMYB1互作介导其降解,负调控苹果花青素生物合成[23]。水稻中具有E3泛素连接酶活性的ZFP181过表达可导致GA 信号途径中相关基因表达量下降,内源GA 含量降低,同时会导致氨基酸衍生物和吲哚衍生物的合成途径相关蛋白水平降低,说明E3泛素连接酶会影响植物的激素信号转导过程以及代谢物合成过程[24]。目前COP1 参与的信号调控网络在模式植物拟南芥以及其他植物中得到了广泛研究,但是通过泛素化修饰丹参酮和酚酸等药用活性成分代谢途径中关键转录因子从而调控次生代谢物含量的研究较少。
本研究克隆丹参泛素连接酶SmCOP1 基因,并对其序列及所编码的蛋白质理化性质进行一定的生物信息学分析,通过与丹参酮和酚酸类物质合成通路中关键转录因子的互作初步筛选E3 泛素连接酶泛素化修饰的底物,预测丹参E3泛素连接酶通过介导植物激素信号传导过程参与次生代谢物质的合成,重点说明泛素化在植物次生代谢途径中所起到的关键作用,为采用遗传转化策略提高丹参药用成分含量以及改良丹参品质提供新的思路和理论基础。
1 材料与方法
1.1 所需材料
1.1.1 所需植物材料
无菌丹参苗,其种子于商洛基地的天士力公司获得。
1.1.2 所需试剂与酶
植物基因组RNA 提取试剂盒和普通琼脂糖凝胶DNA 回收试剂盒购自Tiangen Biotechnology(Beijing)公司;工具酶PrimeSTAR® Max DNA Polymerase 和高效cDNA 链合成试剂盒购自Takara 公司;pMD18-T 克隆载体购自Takara公司;E.coli DH5α大肠杆菌感受态细胞购自北京康为世纪公司;AH109 酵母感受态细胞购自上海唯地生物技术有限公司;质粒提取试剂盒购自美国OMEGA 公司;Gateway 系统BP 反应酶和LR 反应酶购自美国Invitrogen 公司;引物合成和测序由上海生工、西安奥科和Invitrogen 公司完成。
1.1.3 所需引物
使用Primer Premier 5.0 生物软件设计,送由TsingkeBiotechnology 公司合成,本实验所需引物序列见表1。

表1 引物序列
1.2 丹参cDNA的获得
先取少许种子用自来水于干净盆中浸泡12 h,接着流动自来水小水流冲洗12 h;将预处理的种子于超净台中灭菌消毒。首先提前准备无菌水、无菌枪头、0.1% HgCl2、75%乙醇以及0.1%琼脂水等灭菌材料。将丹参种子先于75%乙醇浸泡1 min,接着无菌水悬浮3-4 次;然后0.1% HgCl2 悬浮浸泡15 min,用无菌水冲洗7 次。注意在悬浮过程中要晃动溶液,保证种子与消毒液以及无菌水充分接触,避免消毒不彻底;最后用灭菌过的镊子将种子均匀放置于MS 培养基,结束后将其培养于温度和光照周期适宜的组培间。选择三周龄长势良好的丹参组培苗,取适量完整叶片,使用植物基因组提取RNA试剂盒将其进行液氮研磨提取丹参无菌苗的总RNA。提取结束后通过1%琼脂糖凝胶电泳看其RNA是否完整无降解,并采用核酸定量仪检测所提取RNA 浓度和纯度。用反转录试剂盒将上述RNA 进行反转录得到cDNA,并用核酸定量仪检测所提取cDNA的质量并记录。
1.3 COP1基因克隆与测序
采用Primer Premier 5.0 软件设计的引物COP1a-F/R、COP1b-F/R,以上述获得的cDNA 为模板,采用高保真酶进行目的片段的扩增,PCR 反应程序:98℃,5min;98℃,10 s;56℃,30 s;72℃,1min;34 个循环。PCR 体系为PrimeSTAR Max Premix 使用25 μL 终浓度为1X;分别使用10-15 pmol,终浓度为0.2-0.3 μM 的特异性引物Primer 1和Primer 2,最后使用灭菌蒸馏水将体系补至50 μl。
获得的PCR 产物通过琼脂糖凝胶电泳检测目的条带的存在情况并回收,使用加A 反应试剂盒获得目的片段,之后再次使用琼脂糖凝胶电泳和DNA回收试剂盒对获得的特异性片段进行检测和回收。采用Takara pMD™18-T Vector Cloning Kit 试剂盒将目的片段连接于pMD18-T。首先取0.1-0.3 pmol 的上述所回收目的片段和1 μL pMD18-T 放置于小型离心管中,ddH2O 补至5 μL,最后将反应液放置于PCR 扩增仪中16℃反应1 h。将全部连接产物转化DH5α 大肠杆菌感受态,平板上的阳性菌落扩摇后进行菌液PCR,取500 μL 阳性菌液送测。送测结果无误后进行下一步实验。
1.4 载体构建
采用OMEGA™质粒小提试剂盒提取实验室保存的pDONR207 质粒并保存。使用所构建载体pMD18-T-COP1a 作为PCR 反应模板,采用带有重组接头的特异性引物attb-COP1a-F/R 进行PCR 反应,结束后进行琼脂糖凝胶电泳检测其有无及位置大小并扩大反应体系将目的片段进行跑胶回收,使用Gateway™BP Clonase™II Enzyme mix试剂盒说明书将目的条带连接于pDONR207 质粒构建入门载体。使用Gateway™试剂盒,将所构建的入门载体和pDEST-GBKT7 表达载体以3:1反应体系进行LR反应连接。25℃过夜连接并第2天全部连接产物转化DH5α,挑菌扩摇后进行菌液PCR,将阳性菌液送测并将测序结果无误的单克隆菌液进行下一步实验。
1.5 E3连接酶SmCOP1的序列生物信息学分析
首先从NCBI 网站下载拟南芥中的蛋白序列,根据AtCOP1 蛋白序列在本实验保存的丹参基因组数据库中利用在线软件HMMER3程序搜索获得包含COP1蛋白相对保守结构域的序列,并使用在线程序SMART分析获得SmCOP1 基因家族序列。利用ExPASy 数据库中的在线ProtParam 软件分析丹参SmCOP1 蛋白的氨基酸数、分子量大小、不稳定系数以及等电点等基本相关信息,通过Protscale(https://web.expasy.org/protscale/)在线程序进行亲疏水性分析,通过ScanProsi在线软件预测其所包含的保守结构域,通过Netphos3.1(http://www.cbs.dtu.dk/services/NetPhos/)在线软件对SmCOP1蛋白序列进行激酶磷酸化修饰位点预测,通过NetOGlyc4.0(http://www.cbs.dtu.dk/services/NetOGlyc/)在线软件进行糖基化修饰位点预测,通过SingalP5.0 在线程序对其所含的信号肽预测,通过TMHMM 在线软件预测其所含的跨膜结构域,通过Psort Prediction 在线软件预测蛋白的亚细胞定位,通过MEGA7.0 采用邻位相连法构建系统进化树(neighbor-joining, NJ)。通 过 在 线 软 件SOPMA 和SWISS-MODEL 预测SmCOP1 蛋白的二级结构和三维模型。
1.6 E3 连接酶SmCOP1 调控丹参酮和酚酸类物质机制初探
从现有已知文献报道中筛选丹参酮和丹酚酸类物质合成通路中关键转录因子,如bHLH 家族中SmMYC2a[25]、MYB 家 族 中 的SmMYB9b[26]、SmPAP1[27],ERF 家族中的SmERF1L1[28]和SmERF6[29]、WRKY 家族中的SmWRKY1[30]、AREB/ABFs 家族中的SmAREB1[31]以及促进丹酚酸上调的SmTTG1[32]转录因子等,研究其与本研究所克隆的SmCOP1 之间的联系,以求进一步探索泛素化修饰调控药用活性物质机制。
将pDEST-GBKT7-COP1a 单转AH109 酵母感受态,涂布于SD-Trp 获得单转化菌株。挑菌落用SDTrp 液体培养基2ml 在10mlEP 管中28℃180 rpm 培养16-18 h,吸取100 μL 将其涂布于SD-Trp/-His/-Ade验证其是否存在自激活;再与pDEST-GADT7 杂交后在SD/-Trp/-His/-Leu/-Ade 四缺板上进一步验证其与DNA 激活domain 是否存在直接互作。将pDESTGBKT7-COP1a+pDEST-GADT7 为阴性对照和以pGBKT7-53+pGADT7-T 为阳性对照以及pDESTGBKT7-COP1a 分别与实验室已构建好的pDESTGADT7-PAP1、 pDEST-GADT7-WRKY1、 pDESTGADT7-MYC2a、 pDEST-GADT7-TTG1、 pDESTGADT7-ERF1L1、pDEST-GADT7-MYB9b、pDESTGADT7-AREB1、pDEST-GADT7-ERF6 等prey 表达载体分别共转AH109 酵母感受态中,均匀涂在SD/-Trp/-Leu 二缺板上,生长3-4 天后,有菌落生成则证实已获得杂交菌株,然后分别挑选单克隆,用SD--Trp/-Leu 液体培养基2 mL 在10 mL EP 管中28℃、180 rpm培养16-18 h,统一OD 值为0.5-0.6,分别吸取8 μL 菌液滴在SD/-Trp/-His/-Leu/-Ade 四缺板上,培养3-4天,观察拍照,做三个生物学重复。
2 结果与分析
2.1 SmCOP1基因克隆与载体构建
克隆到的丹参SmCOP1a和SmCOP1b基因测序结果如图1所示,克隆序列见附表1,得到了2400 bp左右位置的两条条带,与预测的基因序列比对结果于附图1 和附图2。结果表明,SmCOP1a与预测结果无差别,而SmCOP1b克隆得到的基因序列与预测序列相比出现1 个碱基的突变。最后得到SmCOP1a的基因长度为2470 bp,SmCOP1b为2412bp,随后通过Takara pMD™18-T Vector Cloning Kit 试剂盒将SmCOP1a和SmCOP1b基因片段连接于pMD18-T 载体上保存。最后将本实验所需目的片段SmCOP1a基因通过Gateway方法与酵母表达载体pDEST-GBKT7 连接,获得pDEST-GBKT7-COP1a重组载体进行下一步实验。

图1 SmCOP1基因PCR扩增电泳图

附图1 克隆SmCOP1a序列与预测序列比对结果

附图2 克隆SmCOP1b序列与预测序列比对结果

图2 SmCOP1蛋白氨基酸亲水性/疏水性预测

附表1 SmCOP1克隆序列

附表1 SmCOP1克隆序列
2.2 SmCOP1基因编码的蛋白质理化性质分析
本研究于丹参全基因组数据库中筛选到丹参SmCOP1基因,其家族有两个基因,分别为SmCOP1a和SmCOP1b(SmCOP1基因CDS 序列和所编码蛋白质序列于附表2 和附表3),之后采用ORF finder 在线软件分析找到序列的阅读框,使用ProtParam 在线软件分析其蛋白的理化性质如分子量、亲疏水性等,并且使用Protscale分析得到的亲/疏水信号图如图2。
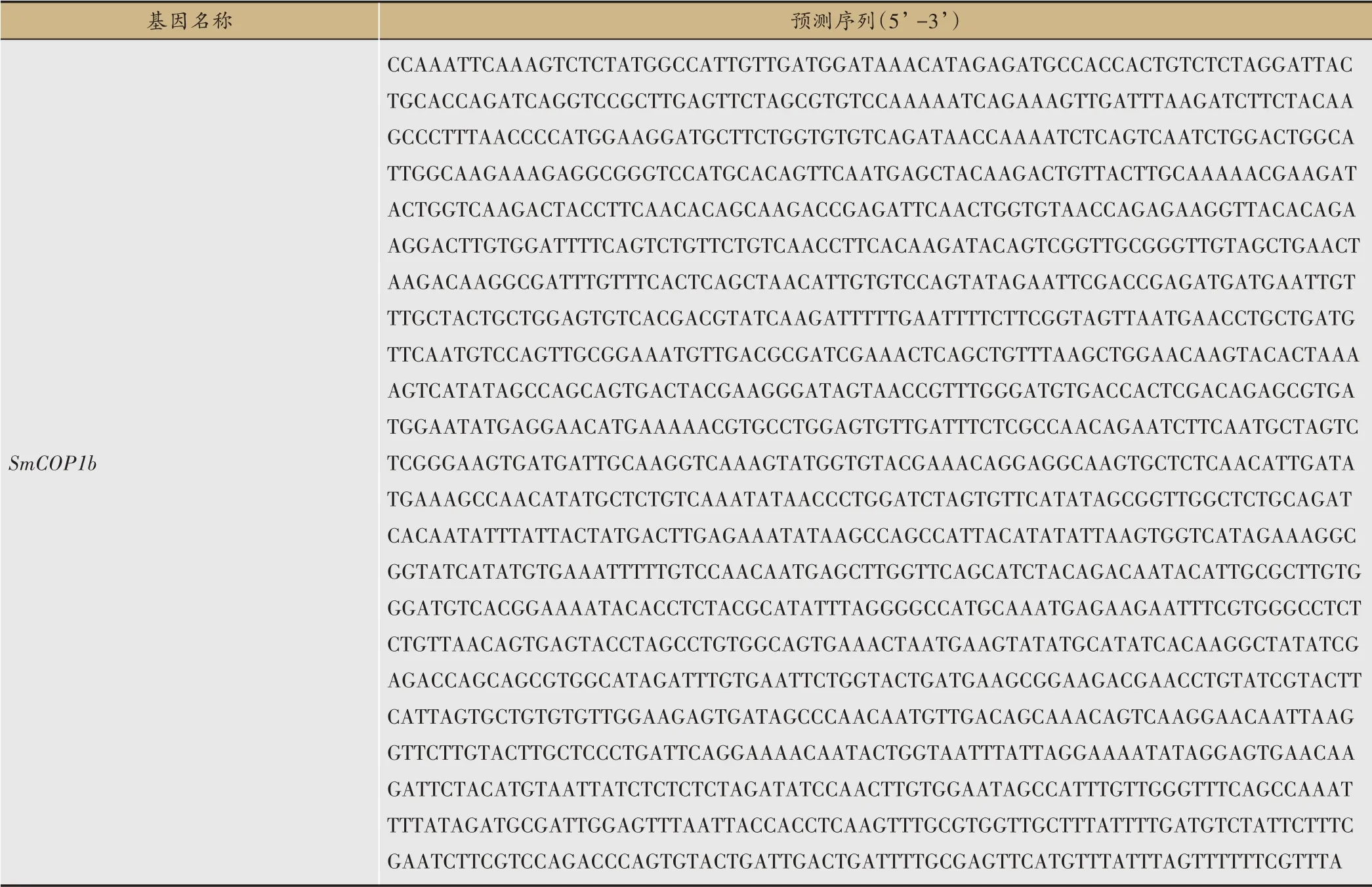
附表2 SmCOP1基因组预测CDS序列

附表2 SmCOP1基因组预测CDS序列

附表3 SmCOP1预测基因编码蛋白序列
SmCOP1a的ORF 长度为2007bp,编码668 个氨基酸,其分子量74891.47,分子式为C3261H5163N931O1032S33,而SmCOP1b的ORF 长度为2028 bp,编码675 个氨基酸,其分子量为76075.04,分子式为C3331H5283N937O1041S30。预测结果显示,SmCOP1 的2 个蛋白均为不稳定蛋白。其中SmCOP1b 蛋白的不稳定系数为55.87,表明SmCOP1b 蛋白与不稳定系数为59.46 的SmCOP1a 蛋白相比来说稳定性更强。亲疏水性方面,SmCOP1a 蛋白平均亲水性(Grand average of hydropathicity,GRAVY)达到-0.437,而SmCOP1b 蛋白的平均亲水性(Grand average of hydropathicity, GRAVY)数值达到-0.443,初步推测两者都是亲水性蛋白。脂溶性方面,SmCOP1b脂溶指数最高,为80.16,而SmCOP1a的脂溶指数为76.06。这一预测结果暗示SmCOP1b 的蛋白热稳定性可能比SmCOP1a 蛋白高。SmCOP1a 理论等电点6.42<7,,而SmCOP1b 理论等电点为6.67<7,两个都是弱酸性蛋白。从氨基酸组成特点来看,SmCOP 蛋白都包含常见氨基酸,SmCOP1a 中含量最高的为Ser(12.1%),其次为Leu(8.7%)和Ala(7.2%),含量最低的为Trp(1.2%),其负电荷残基数(Asp+Glu)为88,正电荷残基数(Arg+Lys)为82。SmCOP1b 蛋白中含量最高的为Ser(11.1%),其次为Leu(9.0%)和Val(7.1%),含量最低的为Trp(1.5%),其负电荷残基数(Asp+Glu)为85,正电荷残基数(Arg+Lys)为82。
根据Protscale 分析得到的亲/疏水信号图可知,SmCOP1a 蛋白中间氨基酸部分呈现出概率较高的亲水性,如A206 残基此处表现出亲水性达到顶峰(-2.856),而疏水性于A48/A49 此处残基表现最强(2.122)。而SmCOP1b 蛋白N 端含有亲水头部,中间氨基酸部分呈现出亲水性较多,最强亲水性位于A151残基(-3.078),而A167 残基(2.889)此处疏水性是最强的。从图中可以看出,两个SmCOP1 蛋白亲/疏水峰值信号大概率都分布于-0.5 以下,从另一方面又可证明SmCOP1两个蛋白皆是亲水性蛋白。
2.3 SmCOP1/SPA蛋白的结构域预测分析
采用ScanProsi 在线分析工具预测其所包含的保守结构域,如图3 结果表明SmCOP1 蛋白均具有一个WD40结构域,只不过两者之间长度不一样,这可能是两者在进化上有差异的原因之一。SmCOP1a 与SmCOP1b 蛋白均具有典型的COP1 类蛋白结构特征,N-端存在E3 泛素连接酶的保守结构域即环形锌指结构域(RING-finger),而C-端存在COP1 蛋白与其底物结合的关键位置[33]即WD40重复结构域。

图3 SmCOP1蛋白保守结构域分布
2.4 SmCOP1蛋白的系统进化树构建
采用生物分析软件MEGA7.0构建丹参SmCOP1a/b蛋白与玉米ZmCOP1(Zea mays:AQK56296.1)、拟南芥AtCOP1(NP_180854.1)、树 棉GaCOP1L(Gossypium arboreum: KHG27191.1)、水 稻OsCOP1(Oryza sativa Japonica Group: XP_015627602.1)、番 茄SlCOP1L(Solanum lycopersicum: XP_004250243.1)、苹 果MdCOP1-1、 MdCOP1-2(Malus domestica:BAM08276.1、XP_028943470.1) 、辣 椒 CaCOP1(Capsicum annuum: KAF3621537.1)、油 菜BnCOP1(Brassica napus: ADL59932.1)等蛋白的NJ 进化树(图4)。构建系统进化树过程中使用RBH 法结果表明SmCOP1a和SmCOP1b是旁系同源基因的关系,而SmCOP1b是AtCOP1的直系同源基因。

图4 SmCOP1蛋白的系统进化分析
2.5 SmCOP1基因所编码蛋白质的修饰位点预测
采用NetPhos3.1 进行磷酸化位点分析,预测结果表明如图5,在系统预设的阈值内SmCOP1a 蛋白预测到9 个酪氨酸(tyrosine)磷酸化位点,17 个苏氨酸(threonine)磷酸化位点以及56 个丝氨酸(serine)磷酸化位点。而SmCOP1b 蛋白预测有10 个酪氨酸(tyrosine)磷酸化位点,22 个苏氨酸(threonine)磷酸化位点以及51个丝氨酸(serine)磷酸化位点。

图5 SmCOP1蛋白的磷酸化位点分析
通过NetOGlyc4.0 在线软件对蛋白质的糖基化位点进行分析,结果表明SmCOP1a 蛋白具有14 个可能的糖基化修饰位点而SmCOP1b 蛋白具有19 个可能的糖基化修饰位点。
2.6 SmCOP1 基因编码蛋白质的信号肽、亚细胞定位及跨膜区预测分析
利用SignalP 5.0 对于SmCOP1 蛋白的信号肽序列进行分析,结果并未发现信号肽和剪切位点,推想SmCOP1 蛋白属于非分泌型蛋白,即SmCOP1 蛋白可能不存在转运过程,直接在细胞质基质中发挥功能。
利用TMHMM 2.0 预测了SmCOP1 蛋白的跨膜结构域,结果并未发现跨膜结构域和膜内的氨基酸序列,推测SmCOP1蛋白位于膜外,属于非膜蛋白。
根据Psort Prediction 预测结果(表2),SmCOP1a蛋白定位于叶绿体基质(Chloroplast stroma),叶绿体类囊体膜(Chloroplast thylakoid membrane),叶绿体类囊体腔(Chloroplast thylakoid spac)和细胞核(nucleus)中。SmCOP1b 蛋白定位于内质网膜(endoplasmic reticulum(membrane)),内质网腔(endoplasmic reticulum lumen),过氧化物酶体(peroxisome)和细胞外中。结合信号肽和跨膜结构域的预测结果,推测SmCOP1a蛋白在游离核糖体上合成蛋白多肽,随后一部分借助叶绿体转运肽定位到叶绿体,并进一步穿过叶绿体膜进入基质中,另一部分进入细胞核,推测可能大部分在叶绿体基质和细胞核中发挥功能。而SmCOP1b翻译合成蛋白后一部分进入内质网,大部分位于膜上的非膜蛋白,推测可能是被其他膜定位蛋白招募过去的,另有少量SmCOP1蛋白定位于过氧化物酶体中。

表2 SmCOP1a蛋白的亚细胞定位分析
2.7 SmCOP1蛋白的二级结构分析
利用在线工具SOPMA 预测SmCOP1 蛋白的二级结构,结果见图6-图7。SmCOP1a 蛋白结果显示含有43.26%的无规则卷曲,31.29%的α 螺旋,延伸链占20.36%,β-转角占5.09%,而SmCOP1b 该蛋白质含有44.89%的无规则卷曲,29.33%的α 螺旋,延伸链占21.04%,β-转角占4.74%。

图6 COP1a蛋白二级结构预测
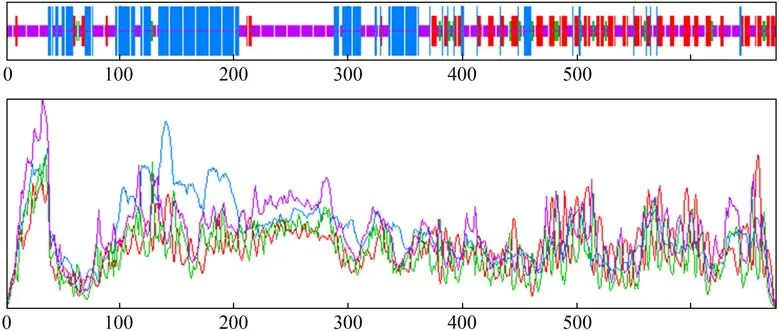
图7 COP1b蛋白二级结构预测
2.8 SmCOP1蛋白的三级结构分析
通过SWISS-MODEL进行SmCOP1 蛋白的三维结构预测,所构建的模型如图8。结果显示,SmCOP1a蛋白与SmCOP1b 蛋白建模以5igo.1.A 为模板,与目标蛋白序列的一致性分别为84.38%和83.95%,目标模型质量分别为-1.41 和-2.30,说明SmCOP1a 蛋白和SmCOP1b 蛋白序列与相应模板序列的一致度均超过80%。
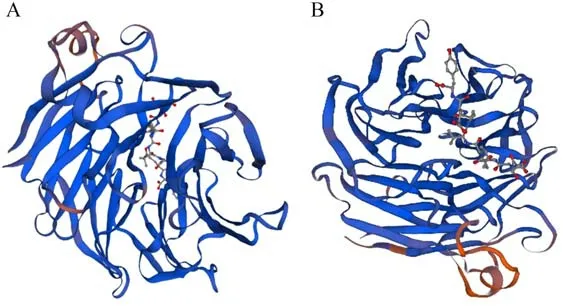
图8 SmCOP1蛋白的三维结构建模
2.9 Y2H 分析SmCOP1 调控丹参酮和酚酸物质机制初探
pDEST-GBKT7-COP1a 单转化菌株在SD-Trp/-His/-Ade 三缺板上无生长说明其无自激活现象,并且与AD-空载体杂菌杂交菌株在SD/-Trp/-His/-Leu/-Ade 四缺板上无生长说明其不存在与DNA 激活域的直接互作。如图9,共转质粒于感受态细胞AH109,2-3 天后观察发现在酵母缺陷性培养基SD/-Leu/-Trp二缺板上可以正常生长菌斑,显示质粒成功转化。在SD/-Ade/-His/-Leu/-Trp 平板上,阴性对照(pDEST-GBKT7-COP1a+pDEST-GADT7)和同时转化的 pDEST-GBKT7-COP1a 和 pDEST-GADT7-WRKY1、pDEST-GADT7-MYC2a、pDEST-GADT7-TTG1、 pDEST-GADT7-ERF1L1、 pDEST-GADT7-MYB9b、 pDEST-GADT7-AREB1、 pDEST-GADT7-ERF6 均无法正常生长,而pDEST-GBKT7-COP1a 与pDEST-GADT7-PAP1 的杂交菌株酵母却可以长出清晰的白色菌斑,说明COP1a 可能通过泛素化修饰靶向MYB 转录因子PAP1来调控酚酸类物质。由系统进化树分析SmCOP1a是SmCOP1b的旁系同源基因,则很大可能COP1b也参与MYB转录因子PAP1泛素化。

图9 Y2H分析SmCOP1a与转录因子互作
3 总结
泛素化是蛋白质组中中常见的翻译后修饰方式,植物能够通过泛素-26S 蛋白酶体途径降解细胞内的周期较短以及结构异常的蛋白,从而调控自身生长发育以及次生代谢过程来适应环境的变化[34-35]。COP1作为RING 型E3 型泛素连接酶能够特异性泛素化修饰多数底物,并通过26S 蛋白酶体系统促进底物水解[36],而目前对于COP1的研究仅集中于拟南芥等模式植物。
COP1 在植物和动物中高度保守,其直系同源物在细胞特性、生化活性和预测的分子结构方面具有高度相似性[37]。本研究预测并克隆丹参E3 泛素连接酶SmCOP1基因,对其编码的蛋白理化性质等进行了一定的生物信息学分析。结果显示SmCOP1蛋白理化性质不同,使得它们的稳定性存在差异,进而影响其自泛素化过程以及靶蛋白的积累。SmCOP1 具有COP1家族代表性结构特征,N-端具有环形锌指保守结构域即RING-finger,而C-端的WD40重复结构域则是与靶蛋白结合的关键区域。系统进化树分析SmCOP1a是SmCOP1b的旁系同源基因,SmCOP1a和SmCOP1b基因编码蛋白质的信号肽和跨膜区预测结果显示皆为非分泌性蛋白和非膜蛋白。且在蛋白质三级结构分析中,都以同一模板蛋白建模。亚细胞定位分析结果表明COP1a 主要聚集在细胞核内与核内蛋白结合促进其降解,而COP1b 具有细胞质定位信号通过抑制自身的表达提高靶蛋白的积累。本文研究其与核内转录因子的作用模式,故酵母双杂实验以COP1a 为代表做下游互作基因初步的筛选。
酵母互作结果表明SmCOP1a 与SmMYC2a、SmMYB9b、 SmERF1L1、 SmERF6、 SmWRKY1、SmAREB1 以及SmTTG1 转录因子等,体外不互作,却与R2R3-MYB 转录因子SmPAP1 互作。有研究表明,SmPAP1 激活了两个关键迷迭香酸生物合成途径基因即SmPAL1(苯丙氨酸解氨酶)和SmC4H(肉桂酸4-羟化酶)的启动子,并且过表达SmPAP1植物和过表达AtPAP1拟南芥的根能够大量积累迷迭香酸、丹酚酸B、总酚以及总黄酮等活性物质[38]。除此之外,SmPAP1通过与茉莉酸途径中主要调控转录因子MYC2相互作用激活编码关键酶的基因方式参与酚酸生物合成途径的调节[27]。说明SmCOP1 可能靶向泛素化修饰SmPAP1 后再与其它转录因子互作参与茉莉酸途径,从而调控酚酸生物合成。从另一个方面看,虽然Y2H实验显示其与其他关键转录因子不互作,但这并不代表SmCOP1a对其没有影响,可能也需要一个中间体去作为它们之间的桥梁。然而Y2H 实验结果只是说明其具有互作的可能性,仍还需要LCI和COIP 等方法进一步证实。
4 讨论
在植物中,E3泛素连接酶影响多种发育和环境反应以及激素信号通路,在脱落酸(ABA)、生长素、油菜素内酯(BR)、细胞激肽(CK)、乙烯、赤霉酸(GA)、茉莉酸(JA)、水杨酸(SA)和金合子内酯(SL)等植物激素信号通路中发挥核心调控作用[39]。植物激素会影响COP1 选择性泛素化降解多种转录因子来响应不同的信号,进而影响植物的多种生理过程,例如ABA 长期的处理会使得COP1介导GLK1泛素化降解,降低与光合作用相关的基因表达,影响叶绿体的形态[40];JA 可通过减少细胞核内COP1 蛋白的积累以及减少与SPA蛋白的相互作用来抑制COP1 活性,从而刺激子叶展开[41]。而丹参酮和丹酚酸等药用活性物质受到激素信号网络的调控,接下来可将目光聚焦在COP1 泛素化降解关键转录因子调控活性物质的合成。COP1 蛋白在光形态建成中起到重要的抑制作用[42],在黑暗条件下COP1通常在细胞核中富集[43],可针对多种光形态发生促进因子进行泛素化降解[44],而光照会使得相关转录因子积累,促进光形态过程。COP1的保守N端部分可与光信号传导过程中必不可少的转录因子HFR1结合,介导其泛素化降解,而光可消除该降解作用,促进光信号转导[45]。此外,COP1 对不同物种的HFR1 具有不同的结合亲和力,例如AtHFR1与COP1的结合比其他植物COP1 底物弱约100 倍[46],该结合能力的差异会影响HFR1 的稳定性,进而影响植物的光形态发生乃至于植物其他生命活动过程。由此可以推测COP1 在不同植物中对次生代谢物的调控作用也有可能存在差异。
目前有研究发现COP1 体内外都可以和4 个SPA蛋白在空间上形成复合体,通过物理互作的方式行使功能[47-48]。在体外COP1 活性较高,可自主发挥功能,而在体内需要以复合体形式参与靶蛋白的修饰[49]。尽管对SPA蛋白的初步研究主要集中在其增强COP1 E3连接酶功能中的辅助作用,但发现SPA1的N端结构域具有丝氨酸/苏氨酸激酶活性,可磷酸化靶蛋白促进COP1和SPA 蛋白中的WD40重复结构域与底物结合。因此同源激酶E3 连接酶复合体可选择性地与其底物相互作用,并以光诱导的方式快速降解[50]。未来需要进一步的实验来研究其他COP1-SPA 底物是否也被SPA 激酶磷酸化,以及同源激酶E3泛素连接酶模型是否也适用于丹参等植物和动物中的其他E3 连接酶复合物。据报道COP1-SPA可接着与其他复合体发生互作形成复合体形式如CUL4-DDB1COP1-SPA1,之后再发挥作用[47]。如发现CUL4COP1-SPA复合体作为一个激酶E3泛素连接酶复合体,用于快速光诱导降解PIF1 和PIF5[51]。这一现象说明了SmCOP1 可能直接与SPA 互作,也可能先与相关转录因子互作,再和SPA 作用形成复合体,进而泛素化靶蛋白。然而有报道曾指出在黑暗中PCH1 和PCHL 也与PIF1 相互作用,可抑制PIF1 的DNA 结合和转录激活活性或通过COP1/SPA复合体诱导PIF1的降解来调节PIF1,表明相关调节因子的泛素化降解有多种形式[52-53]。并且泛素化调控影响植物生命活动机制并不是单一的,它可能降解激素信号通路相互拮抗的两个调节因子,使其中一个生物角色占重要位置从而调节植物生命活动。在植物的整个生命周期中,光环境控制着植物发育的许多方面。CO 是控制拟南芥光周期开花的关键转录因子,尽管CO 和COL12 都是COP1/SPA 泛素连接酶的降解靶标,但它们对控制降温时间的作用是拮抗的。COP1/SPA 的主要功能是在黑暗中调节短日生植物中CO 的降解。相反,光对COL12 的稳定作用可能是通过抑制长日照植物白天CO 蛋白活性适应环境[54]。COP1/SPA 复合体对植物生命活动调节方式也可能存在于如丹参植物和其他动物中。将来可以先确定COP1s和SPAs是否存在互作,之后以互作形成的复合体形式深入探索其对丹参药用活性成分关键转录因子的泛素化修饰机制,还可以通过多种方式筛查确认是否有其他的E3连接酶在泛素化过程发挥重要作用。如利用Cell free 瞬时体系进一步验证筛选介导关键核心转录因子降解的E3泛素连接酶。
总之,本实验初步筛选到与丹参E3泛素连接酶互作的SmPAP1 蛋白,预测SmCOP1 通过泛素化修饰SmPAP1 促进酚酸等生物活性化合物的积累,并也可能影响SmPAP1 与茉莉酸信号通路中主要调控因子MYC2 的结合,进而调控植物次生代谢物的合成。本研究将有助于阐明上游E3 泛素连接酶对于调控丹参酮和酚酸合成通路中关键核心转录因子的泛素化修饰对丹参次生代谢调控的共同作用机制,拓宽了E3泛素连接酶在植物生命体中扮演的角色,也为提高丹参药用成分含量的研究提供了新的研究方向。
