慢性心功能不全病人PRA、CyP-A、sST2的表达及其相关性
2022-09-29赵茜茜崔晓博李金岭
杨 婷,赵茜茜,王 珅,崔晓博,李金岭
慢性心功能不全是心血管疾病终末期病人的一种状态,且病人5年内的病死率达50%,优化治疗可促进病人临床症状改善,减少病人死亡[1]。可溶性生长刺激表达因子-2(sST2)作为一种白细胞介素-1家族中重要成员,一旦心肌细胞发生机械性刺激,成纤维负荷发生变化,会促进大量的结合性生长刺激表达因子-2(ST2L)分泌,ST2L与白细胞介素-33(IL-33)特异性结合后,下游通路被激活,参与心肌重塑过程,对心肌起到一定的保护作用[2-3]。亲环素(CyP)能抑制细胞免疫,在蛋白质运输中发挥调节作用,对炎性细胞聚集有一定的诱导作用,在血管损伤中具有一定的作用,在动脉粥样硬化中起到至关重要的作用,CyP-A属于亲环素中关键蛋白[4]。肾素活性(PRA)能有效反映机体肾交感神经活性状况,研究指出,肾素-血管紧张素系统在心力衰竭发病中至关重要[5]。本研究探讨血清PRA、CyP-A、sST2水平与慢性心功能不全发病的关系。
1 资料与方法
1.1 一般资料 选取2020年1月—2020年12月在我院就诊的慢性心功能不全病人61例作为研究组,其中男31例,女30例;年龄50~84岁;体质指数(BMI)21~26 kg/m2。选取同时期我院年龄相匹配健康体检者40名为正常组,其中男18名,女22名;年龄52~85岁;BMI 20~27 kg/m2。两组研究对象一般资料比较差异均无统计学意义(P>0.05),具有可比性。
研究组纳入标准:符合《ACC/AHA成人慢性心功能不全诊疗指南》[6]中的诊断标准;初次在我院就诊病人;经过心脏超声、冠状动脉造影、心电图等确诊;病人及其家属均知情并签署知情同意书。排除标准:心律失常、感染等病人;合并恶性肿瘤、自身免疫系统疾病、肝损伤病人;精神异常病人。本研究获得我院伦理委员会批准。
1.2 方法
1.2.1 血脂指标检测 采集两组研究对象空腹肘部静脉血3 mL,2 000 r/min离心处理5 min,获取血清后-20 ℃保存。通过全自动生化分析仪检测两组总胆固醇(total cholesterol,TC)、载脂蛋白A(Apo A)、载脂蛋白B(Apo B)、高密度脂蛋白胆固醇(high desity cholesterol,HDL-C)、低密度脂蛋白胆固醇(low desity cholesterol,LDL-C)、三酰甘油(total triglyceride,TG)水平。
1.2.2 心功能指标检测 通过彩色多普勒超声(ViViD3 型,GE公司提供)检测两组左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end systolic diameter,LVESD)、左房内径(left atrial inner diameter,LAD)、室间隔厚度(interventricular septal thickness,IVST)及左室射血分数(left ventricular ejection fraction,LVEF)。
1.2.3 PRA、CyP-A、sST2水平检测 采用酶联免疫吸附法检测PRA、CyP-A、sST2水平将提前稀释好的血液标本100 μL加入相应的微孔板反应孔中,第1孔只加样品稀释液为零孔,混合均匀,在37 ℃下处理90 min,甩去孔内液体,吸干水分;将准备好的抗体加入到每孔中0.1 mL,在37 ℃下处理60 min,空白孔不加底物四甲基联苯胺(TMS);孔内液体甩出后,每孔中滴加0.01 mol/L磷酸缓冲盐溶液(PBS),浸泡2 min后,孔内液体甩出,水分吸干;每孔滴加90 μL 四甲基硅烷(TMS),避光20 min;每孔中加入90 μL TMS终止液,即蓝色变为黄色。
1.3 心功能分级标准 参考美国纽约心脏病协会(NYHA)分级标准[7],将心功能分为Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级。

2 结 果
2.1 两组临床资料比较 两组性别、年龄、BMI、血脂、血压等指标比较,差异均无统计学意义(P>0.05)。研究组LVEDD、LVESD、LAD、IVST水平高于正常组(P<0.05),LVEF水平低于正常组(P<0.05)。详见表1。
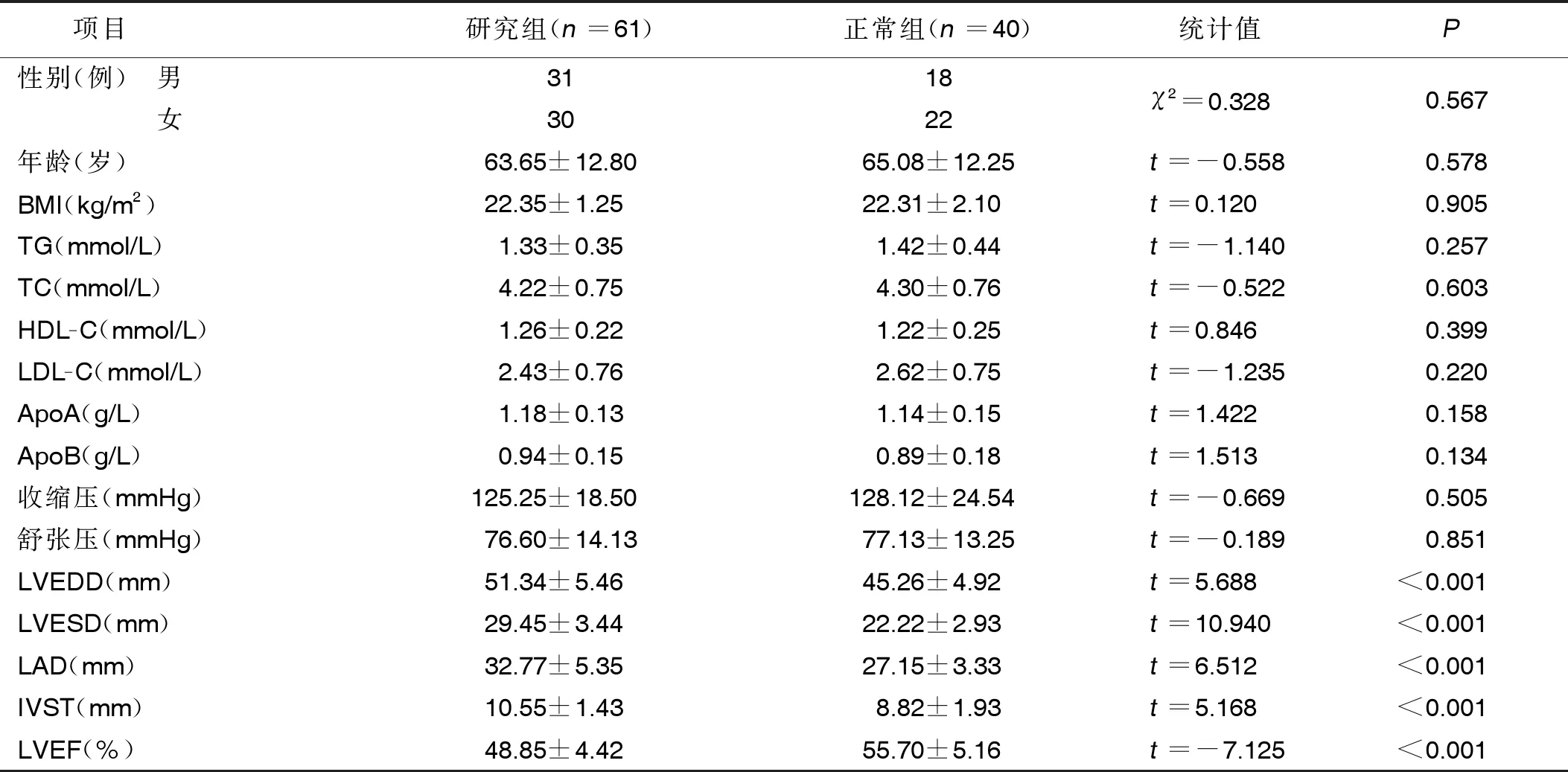
表1 两组临床资料比较
2.2 两组PRA、CyP-A、sST2水平比较 研究组PRA、CyP-A、sST2水平高于正常组(P<0.05)。详见表2。
表2 两组PRA、CyP-A、sST2水平比较(±s)
2.3 不同心功能分级慢性心功能不全病人PRA、CyP-A、sST2水平比较 Ⅱ级、Ⅲ级、Ⅳ级病人PRA、CyP-A、sST2水平均高于Ⅰ级病人(P<0.05);Ⅲ级、Ⅳ级病人PRA、CyP-A、sST2水平高于Ⅱ级病人(P<0.05);Ⅳ级病人PRA、CyP-A、sST2水平高于Ⅲ级病人(P<0.05)。详见表3。
表3 不同心功能分级慢性心功能不全病人PRA、CyP-A、sST2水平比较(±s)
2.4 PRA、CyP-A、sST2对慢性心功能不全的诊断价值 ROC分析显示,CyP-A、sST2、PRA预测慢性心功能不全的曲线下面积(AUC)分别为0.790[95%CI(0.678,0.902)]、0.788[95%CI(0.675,0.902)]、0.768[95%CI(0.648,0.888)]。CyP-A、sST2、PRA预测慢性心功能不全的灵敏度、特异度、阳性预测值、阴性预测值详见表4、图1。
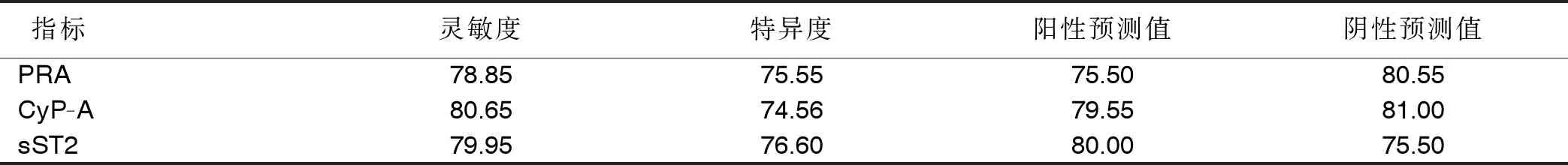
表4 PRA、CyP-A、sST2对慢性心功能不全的诊断效能分析 单位:%
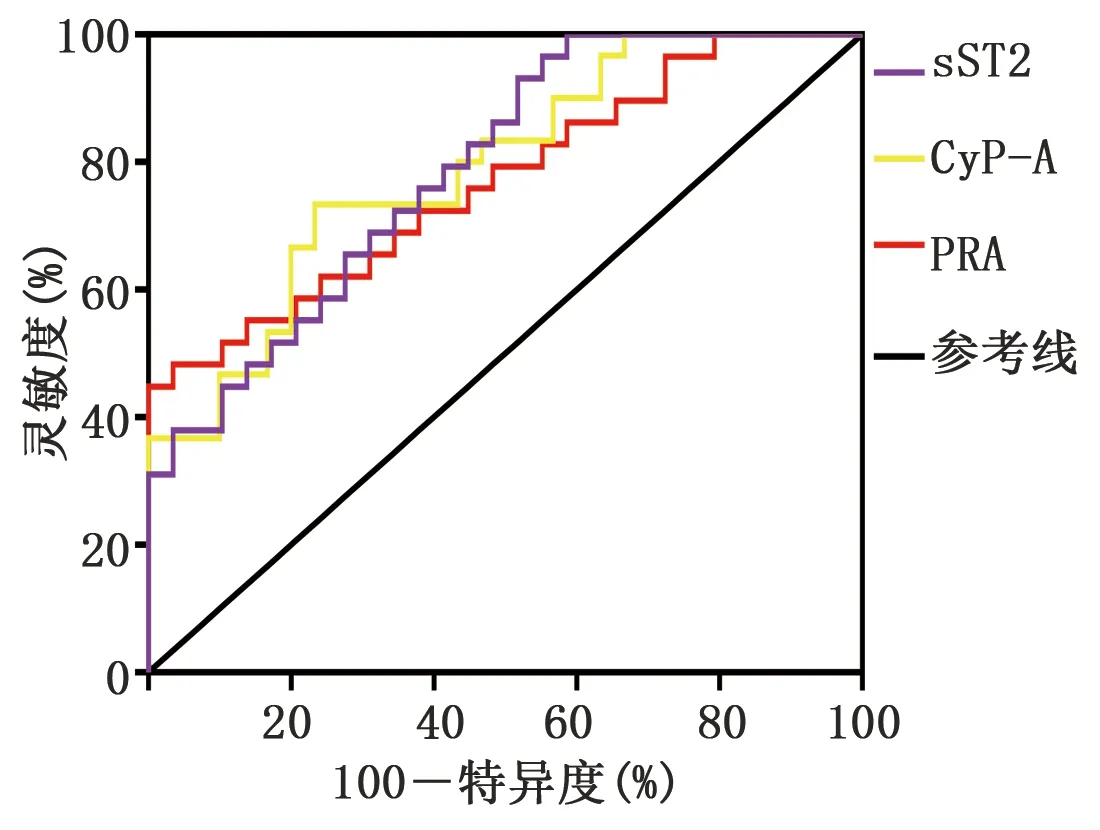
图1 PRA、CyP-A、sST2诊断慢性心功能不全的ROC曲线
2.5 PRA、CyP-A、sST2的相关性分析 PRA与CyP-A呈正相关(r=0.493,P<0.001),Cy-A与sST2呈正相关(r=0.373,P=0.003),PRA与sST2呈正相关(r=0.498,P<0.001)。详见图2~图4。
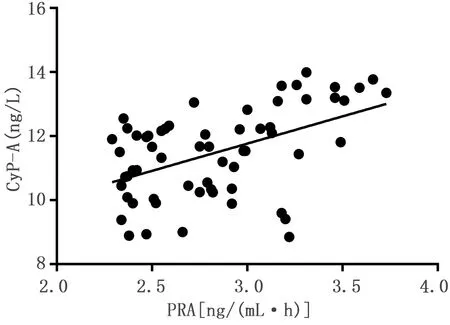
图2 PRA与CyP-A的相关性分析

图3 CyP-A与sST2的相关性分析
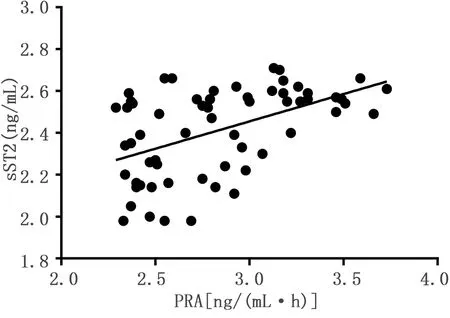
图4 PRA与sST2的相关性分析
3 讨 论
本研究通过多因素Logistic回归分析发现,血清PRA、CyP-A、sST2水平增高均为慢性心功能不全的独立危险因素,提示血清PRA、CyP-A、sST2水平可以作为临床预测慢性心功能不全的指标。
CyP-A是亲环素家族中主要成员,其表达水平的高低与机体中细胞炎性因子、血管细胞因子浓度有紧密的联系[8-9]。一旦机体发生氧化应激反应,或者是血管发生损伤,会有大量的CyP-A产生,血液中CyP-A浓度增加,促进大量的促炎因子在病人发病部位聚集,引发机体抗氧化能力下降,大量的内皮细胞增殖,肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)水平异常表达[10-11]。本研究表明,慢性心功能不全病人血清CyP-A水平升高,且CyP-A水平与慢性心功能不全存在密切关系,提示血清CyP-A水平升高是导致慢性心功能不全发病的危险因素。王群立等[12]研究也显示,心功能不全病人CyP-A水平高于正常水平,提示CyP-A水平与心力衰竭病人机体异常炎症反应有关,CyP-A可能作为心功能不全的独立高危因素,与本研究结果一致。本研究中ROC分析显示,CyP-A预测慢性心功能不全的AUC达0.790,提示CyP-A是慢性心功能不全的有效预测指标。
交感神经兴奋导致大量的去甲肾上腺素被释放,进入到血液,尤其是针对心力衰竭病人,去甲肾上腺素浓度受心功能不全病人病情严重程度、心功能分级的影响,从而对心力衰竭病人预后具有一定的预测价值[13-14]。PRA大量释放会导致病人交感神经兴奋。本研究显示,慢性心功能不全病人血清PRA水平较高,血清PRA水平升高与慢性心功能不全密切相关,说明PRA参与慢性心功能不全的发病过程。PRA参与慢性心功能不全发病机制:PRA会促进病人心肌肥大,心间质纤维发生纤维化,引发信使重构,造成大量的心肌细胞凋亡,引起肾上腺皮质球带发生水钠潴留,心肌细胞肥大,增加心脏负荷,加快心肌纤维化发展的速度。本研究同样显示血清PRA是慢性心功能不全发病的高能预警指标[15-16]。
有研究认为,心功能不全容易引起机体中成纤维细胞、心肌细胞产生大量的白细胞介素-33(IL-33)和ST2,进入血液,一旦ST2与IL-33竞争结合,阻断信号通路,导致心脏保护能力降低,诱导心肌纤维化发生,心肌细胞出现凋亡,心室重构[17-18]。Pascual-Figal等[19]研究指出,sST2、IL-33在心力衰竭临床诊断中具有较高的诊断价值,本研究中慢性心功能不全病人血清sST2水平均高于正常人,提示sST2是慢性心功能不全发病的危险因素。ROC分析显示,sST2预测慢性心功能不全发病的AUC达0.788,灵敏度和特异度分别为79.95%、76.60%,提示血清sST2可用于评估慢性心功能不全发病风险。汤丰宁等[20]研究也指出,sST2能有效反映病人心肌损伤、炎症反应状况,受肾功能等影响较小。本研究表明,PRA、CyP-A、sST2三者之间呈正相关,随着慢性心功能不全病人病情不断发展,PRA、CyP-A、sST2水平不断升高,参与病人病情发展过程。
综上所述,慢性心功能不全病人血清PRA、CyP-A、sST2水平升高,高水平的PRA、CyP-A、sST2可能是慢性心功能不全的独立危险因素,可为慢性心功能不全早期诊断提供参考。
