柴胡陷胸汤对高脂血清诱导人脐静脉内皮细胞损伤NF-κΒ炎性信号通路表达的影响
2022-09-29王建湘陈新宇
王建湘,廖 杨,易 琼,陈新宇
动脉粥样硬化(AS)发病机制的研究一直是热点,目前的研究认为动脉粥样硬化是一种慢性炎症和自身免疫性疾病[1-2], 炎症是致动脉粥样硬化发病的中介和中心环节[3]。核转录因子-κB(NF-κB)是一种公认的炎症细胞信号传导转录蛋白[4],血管内皮细胞受损的始发机制就是缘于NF-κB的激活[5-6],通过NF-κB的转录激活可促进细胞因子[肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)]、黏附分子[细胞间黏附分子-1(ICAM-1)和血管细胞间黏附分子-1(VCAM-1)]等基因的表达[7-9],也就是说动脉粥样硬化的发生及发展主要通过NF-κB调控炎症介质基因的转录来实现[10-11],NF-κB已经成为炎性疾病新的治疗靶点[12-13]。柴胡陷胸汤是由小柴胡汤与小陷胸汤二方加减而成的中医经典名方,既往开展的临床实践亦证实该方对冠心病心绞痛具有较好的治疗作用[14-15]。本研究拟通过高脂血清诱导人脐静脉内皮细胞株(ECV304)细胞损伤建立模型,探讨柴胡陷胸汤对细胞损伤时 NF-κB炎性信号通路相关因子蛋白和基因表达的影响,以阐明其抗动脉粥样硬化的作用机制,从而为其临床防治动脉粥样硬化疾病提供新的理论和实验依据。
1 材料与方法
1.1 细胞株传代培养 ECV304购自中国科学院上海细胞所,首先在含10%胎牛血清的DMEM 培养基中将细胞株复苏培养,再在37 ℃、5%CO2恒温培养箱中培养传代。
1.2 主要试剂与仪器 胎牛血清、胰蛋白酶、DMEM培养基均购自美国Sigma 公司,四甲基偶氮唑盐比色法(MTT)试剂盒、蛋白提取试剂盒、二喹啉甲酸(BCA)试剂盒均购自上海碧云天公司;人TNF-α购自上海酶联生物科技有限公司;聚合酶链式反应(PCR)引物由上海Gene Pharma合成;TRIzol RNA分离试剂及实时定量PCR(RT-PCR)试剂盒购自美国Thermo Fisher Scientific(中国)公司;兔抗人NF-κBp65、ICAM-1、VCAM-1、β-actin、山羊抗兔免疫球蛋白G(IgG)H&L辣根过氧化物酶(HRP)均购自英国Abcam公司;细胞培养箱购自美国Thermo Scientific公司,iMark680多功能酶标仪、蛋白转膜装置、Power PacTM 基础电泳仪、GC-800光密度扫描仪、ChemiDoc TMMP成像系统均购自美国Bio-Rad公司。
1.3 含药血清和高脂血清的制备 柴胡陷胸汤组方:柴胡10 g,法半夏10 g,黄芩10 g,黄连4 g,瓜蒌10 g,木香6 g,九香虫6 g,丹参15 g,甘草6 g等。将以上原药材称量后,先将药材用相当于药材量的5倍自来水浸泡2 h,煮沸后再以微火煎煮30 min,过滤后收集煎液,原渣再加水煎煮20 min,过滤取汁得第二煎液。将两次煎液混合,根据文献[16-17],为保证按人-兔等效剂量4倍、8倍、16倍给药,分别将柴胡陷胸汤药液水浴浓缩成2.6 g/mL、5.1 g/mL、10.2 g/mL。
选用清洁级健康新西兰大耳白兔15只,体质量1.85~2.25 kg,许可证号:SYXK(湘)2020-0010,随机分为正常组、柴胡陷胸汤低剂量组、柴胡陷胸汤中剂量组、柴胡陷胸汤高剂量组、辛伐他汀组,每组3只。其中正常对照组给予蒸馏水,柴胡陷胸汤低剂量组、柴胡陷胸汤中剂量组、柴胡陷胸汤高剂量组分别给予柴胡陷胸汤药液2.6 g/mL、5.1 g/mL、10.2 g/mL,辛伐他汀组给予辛伐他汀18 mg/(kg·d)。每组均按10 mL/kg体质量灌胃给药,每日2 次,连续灌胃7 d。末次给药后2 h自耳部中央动脉放血,分离血清,56 ℃水浴灭活30 min,0.22 μm微孔膜滤器过滤,无菌分装,制备成与实验分组相同数量的含药血清溶液,低温(-30 ℃)冷藏备用。每组新西兰雄性大耳白兔3只,每天每只给予高脂乳剂配方(含5 g胆固醇、5 g蛋黄粉、30 g猪油、2 g猪胆酸钠、2 g吐温-80、156 g蒸馏水),以20 mL/kg连续灌胃2周[18],所有动物均自由饮水,2周后,禁食不禁水16 h,以麻醉腹主动脉采血,分离血清,56 ℃灭活30 min,微孔滤膜过滤分装,制备浓度为50 mL/L高脂血清溶液,放置-80 ℃冰箱保存备用。
1.4 实验分组及处理 上述ECV304传代细胞调节至密度为5×105/mL,按每孔100 μL接种于96孔板,待细胞铺满孔底后,分为正常对照组(20%正常兔血清)、高脂血清组(20%正常兔血清预处理2 h后加入50 mL/L高脂血清20%)、柴胡陷胸汤低剂量组、柴胡陷胸汤中剂量组、柴胡陷胸汤高剂量组、辛伐他汀组,每组设10个复孔。其中柴胡陷胸汤低剂量组、柴胡陷胸汤中剂量组、柴胡陷胸汤高剂量组、辛伐他汀组采用各组含药血清(体积分数为20%)预处理2 h后加入50 mL/L高脂血清20%,各组细胞继续培养24 h。
1.5 检测指标
1.5.1 内皮细胞存活率检测 实验完成后收集各组ECV304细胞,在培养基中加入20 μL/mL的MTT溶液,吸取经过MTT培养后的细胞上清液,加入二甲基亚砜(DMSO)溶液,将培养板在摇床上低速振荡10 min,使用酶联免疫吸附试验在490 nm处检测各组细胞的吸光值。
1.5.2 蛋白免疫印迹法(Western Blot)检测NF -κB、TNF-α、ICAM-1、VCAM-1蛋白表达 各组细胞经药物处理后用预冷的磷酸缓冲盐溶液(PBS)洗涤2次,吸尽水分后加入放射免疫沉淀试验(RIPA)组织细胞裂解液适量,样品置于冰上裂解20 min,4 ℃、12 000×g下离心15 min。取上清,采用BCA蛋白浓度测定试剂盒测定蛋白浓度,按上样量计算,加入5×loading buffer 混匀,煮沸10 min。取变性后的蛋白样品80 μg上样电泳,电压100 V;电转移至聚偏二氟乙烯(PVDF)膜(350 mA,2 h),50 g/L牛血清清蛋白(BSA)室温封闭2 h,分别加入NF-κB、TNF-α、ICAM-1、VCAM-1、β-actin 4 ℃孵育过夜;次日用10×封闭-洗涤缓冲液(TBST)充分清洗,加入相应二抗孵育2 h,TBST缓冲液再次清洗,加入显影剂进行显影,在暗室中对曝光底片进行显影、定影、烤干和照相。采用凝胶成像扫描系统进行密度扫描,结果以目的蛋白与内参蛋白β-actin的密度积分比值(p)表示相应的蛋白表达水平。
1.5.3 RT-PCR 检测NF-κB、TNF-α、ICAM-1、VCAM-1 mRNA表达 上述实验干预24 h后收集各组细胞,用Trizol提取细胞总RNA,测定(A260/280)比值。以反转录试剂盒逆转录为cDNA,应用SYBR Green I荧光染料进行RT-PCR 反应,以β-actin为内参照。扩增条件为95 ℃ 30 s变性,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。所用引物序列NF-κB(165 bp):正向引物 5′-AGTGCAGAGGAAACGTCAGAA-3′,反向引物5′-CATTTTACCACTTGGCAGGAA-3′;TNF-α(199 bp):正向引物5′-TGGCGTGTTCATCCGTTC-3′,反向引物5′-CTACTTCAGCGTCTCGTGTG-3′;ICAM-1 (390 bp):正向引物5′-TGAAGGCCACCCCAGAGGACAAC-3′,反向引物5′-CCCATTATGACTGCGGCTGCTGCTACC-3′;VCAM-1(354 bp):正向引物5′-CCAGAATCTAGATATCTTGCTC-3′,反向引物5′-CAGCCTGTCAAATGGGTATAC-3′;β-actin(540 bp):正向引物5′-TCACCAGGGCTGCTTTTA-3′,反向引物5′-GAAGATGGTGATGGGATTT-3′。用2-ΔΔCT法计算基因表达水平。

2 结 果
2.1 各组内皮细胞存活率比较 与正常对照组相比,高脂血清组内皮细胞存活率明显降低,差异有统计学意义(P<0.01);与高脂血清组相比,柴胡陷胸汤各剂量组和辛伐他汀组细胞存活率均明显升高,差异均有统计学意义(P<0.05或P<0.01),且以辛伐他汀组和柴胡陷胸汤高剂量组作用更为明显。详见表1。
表1 各组内皮细胞存活率比较(±s) 单位:%
高脂血清组与正常对照组比较,①P<0.01;与高脂血清组比较,②P<0.05,③P<0.01。
2.2 各组ECV304细胞中NF-κB、TNF-α、ICAM-1、VCAM-1蛋白表达比较 正常对照组VCAM-1未见表达。与正常对照组相比,高脂血清组NF-κB、TNF-α、ICAM-1、VCAM-1 蛋白表达明显升高(P<0.01);与高脂血清组相比,柴胡陷胸汤各剂量组和辛伐他汀组NF-κB、TNF-α、ICAM-1、VCAM-1蛋白表达明显降低(P<0.05或P<0.01),且以辛伐他汀组和柴胡陷胸汤高剂量组作用更为明显。详见表2及图1。
表2 各组ECV304细胞中NF-κB、TNF-α、ICAM-1、VCAM-1蛋白表达比较(±s)
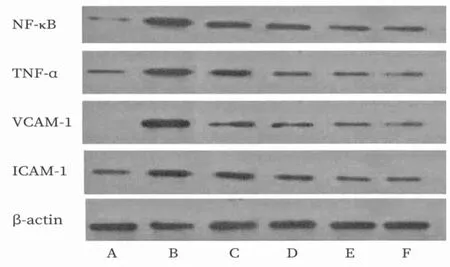
图1 各组ECV304细胞中NF-κB、TNF-α、ICAM-1、VCAM-1蛋白表达的凝胶电泳图(A为正常对照组;B为高脂血清组;C为柴胡陷胸汤低剂量组;D为柴胡陷胸汤中剂量组;E为柴胡陷胸汤高剂量组;F为辛伐他汀组)
2.3 各组ECV304细胞中NF-κB、TNF-α、ICAM-1、VCAM-1 mRNA表达比较 正常对照组VCAM-1mRNA未见表达。与正常对照组相比,高脂血清组NF-κB、TNF-α、ICAM-1、VCAM-1 mRNA表达明显升高(P<0.01);与高脂血清组相比,柴胡陷胸汤各剂量组和辛伐他汀组NF-κB、TNF-α、ICAM-1、VCAM-1 mRNA表达明显低于高脂血清组(P<0.05或P<0.01),且以辛伐他汀组和柴胡陷胸汤高剂量组作用更为明显。详见表3及图2。
表3 各组ECV304细胞中NF-κB、TNF-α、ICAM-1、VCAM-1 mRNA表达比较(±s)
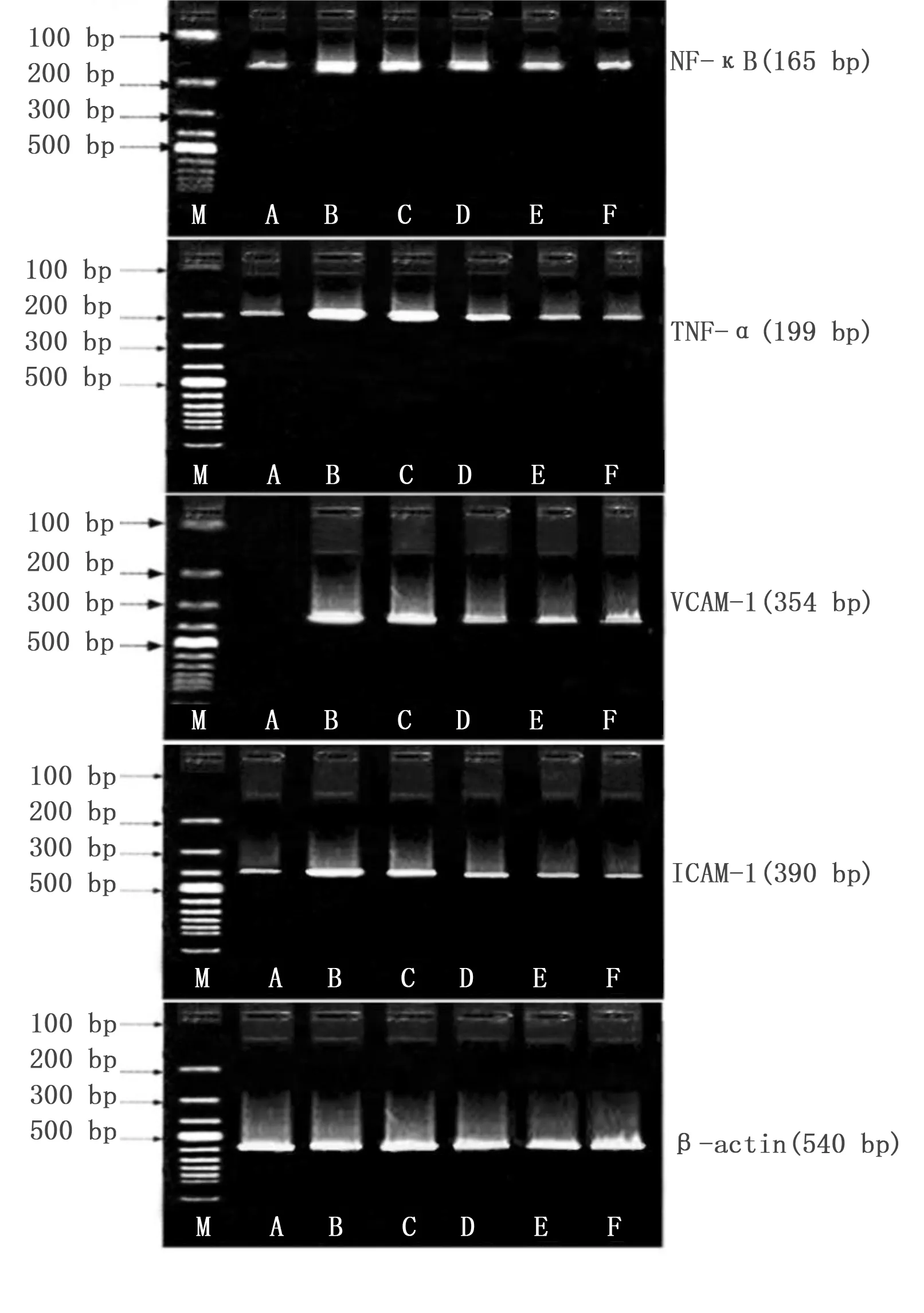
图2 各组ECV304细胞中NF-κB、TNF-α、ICAM-1、VCAM-1 mRNA表达电泳图(M为Marker;A为正常对照组;B为高脂血清组;C为柴胡陷胸汤低剂量组;D为柴胡陷胸汤中剂量组;E为柴胡陷胸汤高剂量组;F为辛伐他汀组)
3 讨 论
动脉粥样硬化病变是起始于血管内皮细胞损伤[1-2],而血管内皮损伤后发生的脂质代谢紊乱是动脉粥样硬化病变的基础,巨噬细胞和血管平滑肌细胞通过摄取大量脂质转化为泡沫细胞,随着泡沫细胞崩解,一方面形成脂肪条纹和引发炎症,另一方面也加剧了斑块的不稳定性。所以,本研究采用体外培养的ECV304细胞,由高脂血清介导损伤,可较准确地反映血管内皮细胞损伤是动脉粥样硬化起始及中心环节的病理基础。而新近研究表明,血管内皮细胞损伤的初始机制是由于NF-κB激活,NF-κB激活会上调黏附分子VCAM-1、ICAM-1的表达,以介导单核细胞黏附内皮细胞并向内皮下迁移,从而造成局部组织损伤和炎症反应,而阻断NF-κB信号通路能下调细胞因子诱导的黏附因子表达[19-20]。
NF-κB的Rel家族蛋白包括RelA(p65)、RelB、c-Rel、NF-κB1(p105-p50)和 NF-κB2 (p100-p52)5个成员,这5种蛋白之间可相互形成同源(如p50/p50)或异源(如p50/p65)二聚体。p50/p65异源二聚体是NF-κB所有形式中最重要的一种,几乎存在于所有细胞中,可以起到促进促炎因子表达的作用;而p50/p50同源二聚体与 DNA 结合后抑制了NF-κB 相关炎症基因的表达。静息状态下,NF-κB与κB抑制剂(I-κB)结合,不具有活性,贮存在细胞浆中。NF-κB 的活化包括经典和非经典两种途径。当NF-κB通过经典途径I-κB激酶(IKK)复合物激活时,肿瘤坏死因子、IL-1β和脂多糖等被细胞膜受体识别后,I-κB激酶复合物被一系列的级联反应激活,使IκB磷酸化和泛素化,并从NF-κB与IκB形成的复合物上解离下来,从而进入细胞核进行基因转录,通过刺激促炎细胞因子、趋化因子、黏附分子、诱导型酶和促血管生成因子的表达在宿主先天免疫反应中起重要作用[21-22]。
中医药防治动脉粥样硬化的作用机制,如调血脂、抗氧化、保护血管内皮细胞功能、抗血小板黏附聚集、抗血栓及抗平滑肌细胞增殖等,认为在本虚标实的基础上,以痰、瘀、毒标实表现者居多,治疗予以活血化瘀、除湿祛痰、清热解毒为主[23]。柴胡陷胸汤出自《重订通俗伤寒论》,具有疏肝理气、清热化痰、活血宽胸之功效,与中医常规的治疗动脉粥样硬化从“痰”“瘀”“毒”入手密切配合,但更强调肝失疏泄、气机郁滞之病机,治疗从疏肝调肝入手。方中以柴胡疏肝解郁、条达肝气,半夏辛开散结、化痰消痞,共为君药;佐以黄芩、黄连清泻肝郁之火,瓜蒌清热化痰、宽胸散结;木香、九香虫均为行气止痛之要药,并能疏解肝气之郁滞;丹参活血祛瘀,甘草补益心气,调和诸药。上药合用,共奏疏肝理气化痰、宽胸活血止痛之功效,使气滞得散,痰瘀自消,心痛得止[14]。现代药理研究也表明,柴胡皂苷可降低高脂血症中三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)水平[24];半夏与黄连配伍具有降血脂、下调NF-κB表达的作用[25];黄连素抑制NF-κB通路,下调血清中TNF-α、IL-1β、IL-6含量,增加一氧化氮(NO)水平,保护冠心病大鼠血管内皮细胞[26],减轻血管内皮炎症反应,达到防治动脉粥样硬化形成的目的[27-28];丹参的有效成分丹参酮ⅡA具有调节血脂和抗动脉粥样硬化的作用,其机制可能与其参与TNF-α/p38丝裂原活化蛋白激酶(p38MAPK)/NF-κB/视黄醇结合蛋白4(RBP4)信号通路调控有关[29]。
本实验研究显示,由高脂血清介导损伤的ECV304细胞存活率明显降低,而NF-κB、TNF-α、ICAM-1、VCAM-1表达明显升高;柴胡陷胸汤可明显提高ECV304细胞存活率,抑制NF-κB活化,降低NF-κB、TNF-α、ICAM-1、VCAM-1表达,提示柴胡陷胸汤通过阻断NF-κB信号通路,从而降低下游靶基因TNF-α、ICAM-1、VCAM-1表达,减轻炎症反应,进而发挥保护血管内皮细胞、抗动脉粥样硬化作用,这可能是其治疗动脉粥样硬化的重要机制之一,NF-κB可以成为炎性疾病新的治疗靶点。
