芍药苷对1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森病小鼠黑质多巴胺能神经元保护作用及机制
2022-09-29荣华孙晓雪李晓明徐天娇李旭郭科东
荣华 孙晓雪 李晓明 徐天娇 李旭 郭科东
帕金森病(Parkinson's disease,PD)作为一种神经退行性疾病,多发生于60 岁以上的老年人群,常伴有静止性震颤、肌肉僵直、运动缓慢以及步态异常等临床症状,中脑黑质致密部多巴胺(DA)能神经元的丢失以及路易小体的形成是该疾病的典型病理特征[1,2]。α-突触核蛋白(α-syn)为路易小体主要成分,与PD 的发生与发展存在密切联系,其含量过度升高会引发神经元死亡,因此,抑制α-syn的表达将成为治疗PD 的研究方向[3,4]。
目前西医尚无根治PD 的有效方法,循证医学推荐的左旋多巴、多巴胺受体激动剂和单胺氧化酶B(Monoamine oxidase B,MAO-B)抑制剂长期使用会诱发严重不良反应且会出现疗效衰退的现象。中药类制剂可明显改善PD 患者运动症状,并缓解其他非运动症状,因此中药及其活性单体成分受到广泛关注。研究证实芍药苷可以透过血脑屏障,具有神经保护的作用,且发现芍药苷的作用机制可能与促进神经生长、抗神经细胞氧化、抑制神经细胞凋亡等有关[5]。因此,本研究采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)作为诱导剂致使模型小鼠黑质神经元发生损伤,观察芍药苷对神经元的保护作用,并对相应机制进行探讨。
1 材料与方法
1.1 实验动物 清洁级C57BL/6 小鼠,雄性3月龄,购于辽宁长生生物技术股份有限公司,动物许可证号:SCXK(辽)2020-0001,体质量20~25g。本实验经过我院实验动物伦理委员会批准,批准号:QMUAECC-2021-127。
1.2 药品与试剂 药品包括芍药苷(瑞芬思生物科技有限公司)、MPTP(美国Sigma 公司),试剂包括α-syn 抗体(英国abcam 公司)、TH 抗体(博士德生物有限公司),TRIzol Reagent(美国Gibcobrl 公司)、SYBR Green I master mix(美国ABI 公司),引物由上海生工生物工程公司合成。
1.3 仪器 Stratagene 实时荧光定量PCR 仪(Agilent公司,型号:Mx2005P),全自动酶标仪(BioTek 公司,型号:S1000),Iamge Analysis System(北京赛智创业科技有限公司,型号:Smart Chemi)。YABO 电脑自动脱水机及YABO0400 组织包埋机[常州雅博电子设备有限公司、RM2233Leica 切片机德国(3B)]、PURELAB PLUS 超纯水机(美国波尔公司)、Thermo超低温冰箱88000(Thermo 公司)。
1.4 实验方法
1.4.1 动物分组 小鼠在25℃,湿度40%环境下自由摄食饮水适应性饲养1 周。随机将受试小鼠分为对照组、模型组、司来吉兰组、芍药苷低剂量组、芍药苷高剂量组,每组10 只小鼠。除对照组外其余各组均给予MPTP(25mg/kg)腹腔注射7d,同时在注射给药1h 后给予药物灌胃治疗,司来吉兰组小鼠采用10mg/kg 司来吉兰灌胃治疗,芍药苷低剂量组小鼠以7.5mg/kg 芍药苷灌胃,芍药苷高剂量组小鼠以30mg/kg 芍药苷灌胃,治疗14d。灌胃给药结束后进行爬杆与转棒试验,对小鼠行为学进行检测后,小鼠取脑,冰上快速剥离黑质备用。
1.4.2 行为学检测
1.4.2.1 爬杆实验 将长度为50cm,直径为1cm 的金属杆顶部固定直径为2.5cm 的圆球,为防止打滑,使用纱布包绕杆部,将小鼠置于球上,以小鼠双前肢接触杆底平台认定为爬完全程,记录小鼠爬杆时间,每30min 进行1 次测量,共3 次,取平均值。
1.4.2.2 转棒实验 在正式测试前先对小鼠进行训练,以转速15r/min,训练时间为120s,连续3d。检测时转棒仪起始转速为4r/min,最大为40r/min,加速度为20r/min,测试时间5min,记录小鼠从转棒开始到掉下转棒的时间(运动潜伏时间)。进行3 次测试,每次间隔30min,取平均值。
1.4.3 流式细胞仪检测 采用AnnexinV-FITC 双染法测定细胞凋亡率。取小鼠黑质区组织,加入4℃预冷的磷酸盐缓冲液PBS 制备细胞悬液,将细胞浓度调至约1×106个/ml。反应管中加400μlPBS,流式细胞仪分析检测细胞凋亡情况。
1.4.4 caspase-3 活性检测 制备脑组织匀浆液,按照试剂盒操作方法检测各组小鼠脑组织裂解液中caspase-3 活性。
1.4.5 透射电子显微镜下观察小鼠神经元的超微结构改变 冰上迅速取小鼠黑质组织约1mm3,置于2.5%的戊二醛溶液中4℃固定过夜,酒精丙酮梯度脱水,环氧丙酮+环氧树脂(1:1)浸透,环氧树脂包埋、固化,制备半薄切片和超薄切片,进行双重染色(醋酸铀-柠檬酸铅),电镜下观察超微结构变化。
1.4.6 免疫组织化学法检测TH 阳性神经元平均光密度 4%多聚甲醛固定脑组织,4℃保存72h 后,脱水浸蜡后进行包埋。中脑黑质区域冠状切片,65℃烘片6h,进行脱蜡、水化处理后,开始TH 免疫组织化学染色。
1.4.7 免疫印迹检测α-syn 蛋白的表达 快速取脑,加入200μl 包含蛋白酶抑制剂与磷酸酶抑制剂的裂解液,10 000r/min,4℃离心10min,微孔板法进行蛋白浓度的测定,酶标仪上562nm 波长处检测吸光度,绘制标准曲线,计算样品的蛋白浓度。SDS 凝胶电泳分离蛋白,电泳,转至PVDF 膜,4℃封闭过夜。加入一抗α-syn(1:1000),加入二抗室温孵育2h,TBST 溶液洗膜3 次,每次10min。暗室进行化学发光反应,显影及定影。AlphaEaseFC 图像分析软件进行分析,以GAPDH 条带作为内参,计算公式:相应蛋白表达量=相应蛋白灰度值/内参蛋白灰度值。
1.4.8 实时定量PCR 检测α-syn mRNA 表达 取60mg 脑组织,加入600μl Trizol 溶液,使用电动组织研磨器将脑组织在冰上进行匀浆处理提取黑质总RNA,反转录合成cDNA。使用FastStart Universal SYBR Green Master(ROX)试剂盒进行扩增PCR。α-syn 引物序列:F 5'-TGGCTTTGTCAAGAAGGACC AGATG-3',R 5'-CCACAGGCATGTCTTCCAGGATTC-3'。扩增实验结束之后,使用2-ΔΔCt法进行结果分析。
1.5 统计学方法 采用SPSS 20.0 软件进行数据统计,计量资料以±s表示,多组间比较采用单因素方差分析,组内比较采用SNK 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 芍药苷对PD 小鼠行为学的影响 与对照组比较,模型组小鼠爬杆时间显著延长,在棒停留时间明显缩短,差异有统计学意义(P<0.05)。与模型组比较,各给药组爬杆时间均缩短(P<0.05),且高剂量组小鼠爬杆时间较低剂量组更短,在棒时间增多,与司来吉兰组比较,芍药苷各剂量组爬杆时间差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠爬杆时间和在棒停留时间的比较(±s,s)

表1 各组小鼠爬杆时间和在棒停留时间的比较(±s,s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别 n 爬杆时间 在棒时间对照组 10 7.11±0.16 234.07±17.54模型组 10 17.17±1.67a 109.80±9.91a司来吉兰组 10 12.30±0.17b 172.41±11.58b芍药苷低剂量组 10 13.52±0.55b 123.64±9.96b芍药苷高剂量组 10 12.85±0.54b 165.00±6.59b
2.2 芍药苷对PD 小鼠黑质神经元凋亡及caspase-3活性的影响 与对照组比较,模型组小鼠黑质神经元凋亡率及caspase-3 活性水平明显升高,差异有统计学意义(P<0.05);与模型组比较,各给药组细胞凋亡率及caspase-3 活性水平均降低,差异有统计学意义(P<0.05),且芍药苷高剂量组的效果最为明显,与司来吉兰组效果相似。见表2。
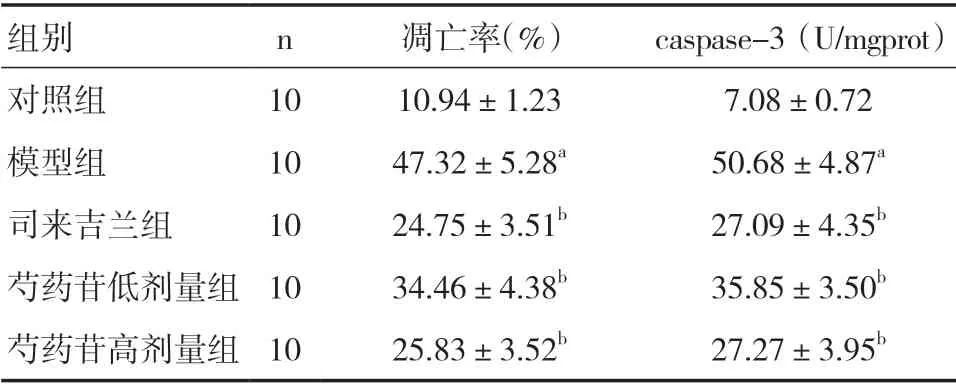
表2 各组小鼠细胞凋亡率及caspase-3 活性表达的比较(x—±s)
2.3 芍药苷对PD 小鼠黑质神经元超微结构改变的影响 对照组小鼠神经元细胞形态完整,细胞器清晰,核膜完整,细胞质丰富,线粒体嵴清晰。与对照组比较,模型组小鼠神经元细胞核固缩,异染色质边集,核周隙增宽,内质网扩张,线粒体变性,有明显脂褐素沉着;与模型组比较,司来吉兰组小鼠神经元细胞形态较规则,细胞器结构较完好,偶见脂褐素沉着;芍药苷低、高剂量组小鼠神经元核固缩减轻,脂褐素减少,且芍药苷高剂量组效果更为明显,细胞器结构逐渐恢复。见图1。
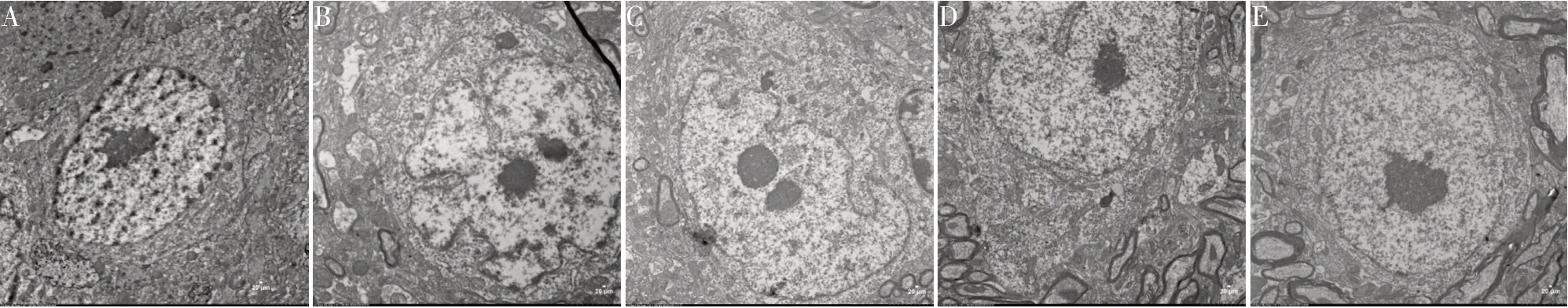
图1 各组小鼠细胞器超微结构(TEM,×13000)
2.4 芍药苷对PD 小鼠TH 免疫组化结果的影响与对照组比较,模型组小鼠黑质区域TH 平均光密度值降低,差异有统计学意义(P<0.05);与模型组比较,各给药组均可不同程度的增加TH 的表达,芍药苷高剂量组效果更为显著,与司来吉兰组比较差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠黑质TH 平均光密度值比较(±s)
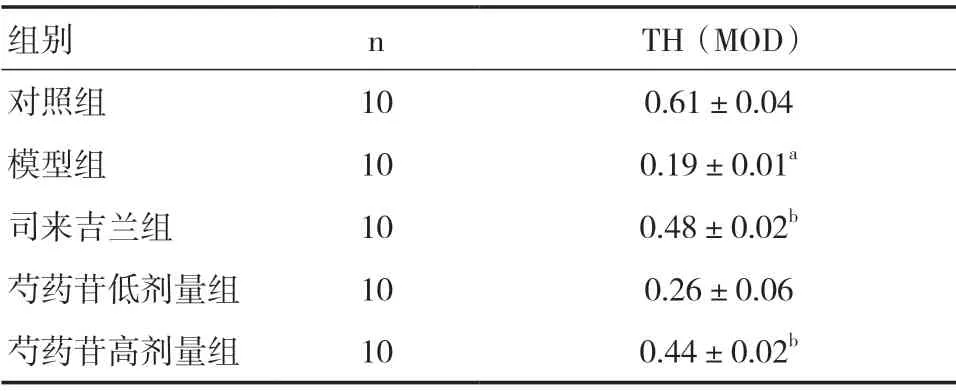
表3 各组小鼠黑质TH 平均光密度值比较(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别 n TH(MOD)对照组 10 0.61±0.04模型组 10 0.19±0.01a司来吉兰组 10 0.48±0.02b芍药苷低剂量组 10 0.26±0.06芍药苷高剂量组 10 0.44±0.02b
2.5 芍药苷对PD 小鼠α-syn 蛋白及mRNA 表达的影响 与对照组比较,模型组小鼠脑组织α-syn 蛋白及mRNA 水平明显升高;与模型组比较,司来吉兰组、芍药苷高剂量组均能下调其表达水平(P<0.05),芍药苷低剂量组作用不明显,芍药苷高剂量组效果较好,与司来吉兰相比无显著差异(P>0.05)。见表4。
表4 各组小鼠α-syn 蛋白及mRNA 水平比较(±s)

表4 各组小鼠α-syn 蛋白及mRNA 水平比较(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别 n α-syn 蛋白(%) α-syn mRNA对照组 10 100.00±0.00 1.01±0.12模型组 10 166.32±15.68a 1.49±0.17a司来吉兰组 10 130.25±13.16b 1.20±0.06b芍药苷低剂量组 10 155.64±20.14 1.38±0.20芍药苷高剂量组 10 128.16±19.27b 1.22±0.11b
3 讨论
据流行病学显示,PD 已成为继阿尔茨海默病后影响老年人群身心健康的第二大神经退行性疾病,且人口老龄化是当今世界发展的必然趋势[6]。DA 能神经元的显著缺失以及细胞中路易小体的形成,是疾病的主要病理特征[7,8]。在临床中DA 类药物的替代治疗是常用的手段,并且从神经保护机制研究PD 的发病原因越来越受到重视[9,10]。MPTP是广泛用于小鼠PD 诱导模型的金标准神经毒素,它通过凋亡通路选择性地引起黑质和纹状体DA 能神经元的死亡[11],能够成功在小鼠身上再现PD 患者的躯体症状,是理想的动物模型[12,13]。
芍药苷是中药白芍中分离得到的一种单萜苷,在神经系统中具有广泛的药理作用,被用于治疗脑缺血[14]及神经退行性疾病,如阿尔茨海默病[15]和帕金森病[16]。芍药苷具有改善学习记忆、镇痛、镇静和抗氧化等作用[17,18]。已有研究表明芍药苷的神经保护作用是通过激活腺苷A1 受体、改善胆碱能神经功能、调节离子通道稳态、延缓神经元氧化应激和凋亡、促进神经生长、提供神经保护等途径实现的[19~22]。但芍药苷对神经保护作用的分子机制尚不十分明确。以往的试验研究是进行预防性给予药物治疗后再进行造模诱导,为了更贴近于临床实际情况,在此次研究中我们采用MPTP 腹腔注射给药受试小鼠,同时进行芍药苷治疗性给药,发现芍药苷低、高剂量组小鼠的黑质神经元凋亡现象有所改善,提示芍药苷通过抑制MPTP 诱导的黑质神经元凋亡发挥治疗作用。
TH 作为检测DA 能神经元的金标准[23],它可以反映出神经元的位置和数量,用来判断MPTP 诱导的PD 模型的严重程度[24]。Caspase-3 是细胞凋亡的执行者和凋亡级联反应的关键要素。有学者提出PD 患者死亡后脑内的caspase-3 阳性神经元数量呈增加的趋势,说明其是人类及动物患PD 时神经元凋亡的易感因子和最终效应器[25]。α-syn作为路易小体的主要成分之一,其表达水平能够反映出PD 病理机制的关键[26]。本次研究结果显示芍药苷可以减轻MPTP 诱导的PD 小鼠的异常行为,提高运动能力,改善脑部细胞器结构,减轻黑质神经元的损伤,抑制caspase-3 的活化水平,降低PD小鼠脑组织α-syn 高表达。由此初步推测芍药苷具有神经保护作用,提示芍药苷可能通过调节控制α-syn 分子水平来发挥效应。
