外源H2O2引发对燕麦种胚线粒体AsA-GSH循环的影响
2022-09-29李红玉王雅聪夏方山李尹琳王聪聪董宽虎
李红玉, 王雅聪, 夏方山, 李尹琳, 王聪聪, 王 勃, 董宽虎
(1.山西农业大学科研管理部, 山西 太谷 030801; 2.山西农业大学草业学院, 山西 太谷 030801; 3.中国农业大学草业科学与技术学院,北京 100193)
草种业是关系国家稳定发展的战略性和基础性产业,是促进草牧业长期高质量发展和保障国家生态安全的根本所在[1-2],而种子是植物种质资源有效保存的重要载体,也是其创新利用的重要原材料[3],其质量好坏是决定我国草种业发展水平高低的关键因素[4]。然而,种子从发育形成至贮藏结束的整个过程一直进行着各种有氧代谢反应,并产生众多对其种胚细胞有害的活性氧(Reactive oxygen species,ROS)自由基[5],从而导致种子活力在生理成熟期最高,其后会在贮藏过程中逐渐下降,乃至完全丧失[5-7]。H2O2被认为是动植物体内调节ROS代谢反应的动态核心位点,其含量升高是导致贮藏植物种子活力降低的直接决定因素[8-9]。同时,H2O2还具有维持植物细胞稳态的作用,是调节植物生长发育的重要小分子信号物质之一,不仅能促进植物种子的萌发及其幼苗生长,还能提高植物苗期的抗逆能力[10]。研究发现,H2O2对植物种子萌发和幼苗生长的影响与其浓度、处理时间及植物种类(品种)均具有密切关系,且低浓度会表现出促进作用,而高浓度则表现出抑制作用[11-13],但其具体的作用机制还不清楚[14],同时种子活力丧失的内在机理也不完全清晰[15]。因此,利用引发技术来探究外源H2O2如何影响植物种子活力具有重要意义。
线粒体不仅是动植物细胞重要的记忆基础,还是其能量合成及物质代谢的中心部位[16-17],也是维持种子活力及萌发等生命活动的动力之源。线粒体被认为是种子细胞内ROS产生的主要来源,也是ROS攻击的首要目标,因而其结构及呼吸功能会不可避免地发生紊乱[18-19]。研究老芒麦(Elymussibiricus)[15-16]、大豆(Glycinemax)[20]、燕麦(Avenasativa)[21-22]、水稻(Oryzasativa)[23]及榆树(Ulmuspumila)[24]等植物种子的活力丧失均发现,线粒体H2O2的大量增加导致了线粒体数量明显减少、内外膜模糊、嵴消失、基质变稀等问题,其细胞色素氧化酶和苹果酸脱氢酶等线粒体功能标志酶活性也降低,使其呼吸供能能力受阻。经修复后的老化种子线粒体结构会变得完整清晰,其细胞色素氧化酶和苹果酸脱氢酶活性也会得到明显改善[9]。种胚线粒体内抗坏血酸-谷胱甘肽(Ascorbic acid-glutathione,AsA-GSH)循环是种子线粒体内清除ROS的主要途径[16,21],其抗氧化能力强弱直接决定了植物种子活力水平的高低,种胚线粒体AsA-GSH循环的抗氧化能力越强,其种子活力水平则越高,种胚线粒体AsA-GSH循环的抗氧化能力越弱,其种子活力水平则越低[9,20]。然而,外源H2O2处理对种子萌发及幼苗生长的研究已在黄瓜(Cucumissativus)[11]、小白菜(Brassicachinensis)[12]、花生(Arachishypogaea)[13]、燕麦[14]等植物中有报道,但种胚线粒体AsA-GSH循环如何变化至今尚未见报道,因而H2O2调控种子萌发及幼苗生长的内在机理仍不清楚。因此,本试验采用引发技术来探讨外源H2O2对燕麦种胚线粒体AsA-GSH循环抗氧化能力的影响规律,以期为H2O2调控植物种子活力变化的内在机制提供参考依据。
1 材料与方法
1.1 供试种子来源
供试燕麦种子品种为‘太阳神’,2018年3月于北京正道农业股份有限公司购买,初始发芽率98%左右,获取后于-20℃条件贮藏至2019年3月开展试验。
1.2 外源H2O2引发处理
将燕麦种子含水量参照文献[25]的方法调整至10%(鲜重基础)左右,将其分为每份约10 g,然后在室温黑暗条件下用200 mL浓度分别为0 mol·L-1,0.96 mol·L-1,1.92 mol·L-1,3.84 mol·L-1和7.68 mol·L-1的H2O2浸泡0 h(CK),6 h,12 h和18 h后,蒸馏水快速洗3次,并用干净滤纸吸掉种皮表面的水分,最后室温、黑暗环境中风干2 d,含水量约10%(鲜重基础)时密封,并保存于4℃下备用。每个处理重复4次。
1.3 线粒体的提取与纯化
线粒体的提取与纯化参照Yin等[26]的方法进行,剥取吸胀4 h的燕麦完整种胚200个,并置于预冷的冰浴研钵内,研磨前加入提前预冷的线粒体提取液20 mL,研磨约5 min后用4层纱布进行过滤,之后经反复离心和洗涤后获得线粒体的悬浮液,将悬浮液再用1∶2的Percoll梯度分离液纯化。所有试验过程均要在1℃~4℃条件下进行,纯化后的线在中间体放置于4℃备用,且每次提取的线粒体最多保存1 d。
1.4 测定指标及方法
超氧化物歧化酶(Superoxide dismutase,SOD)活性参考Rao和Sresty[27]的方法测定,抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)活性均参考Nakano和Asada[28]的方法测定,单脱氢抗坏血酸还原酶(Monodehydroasorbate reductase,MDHAR)活性参考Arrigoni等[29]的方法测定,谷胱甘肽还原酶(Glutathione reductase,GR)活性参考Esterbauer和Grill[30]的方法测定,可溶性蛋白和H2O2含量均使用南京建成生物工程研究所生产的试剂盒进行测定,丙二醛(Malondialdehyde,MDA)含量则参考Bailly等[31]的方法测定。所有指标测定过程中均采用1 mL反应体系加入10 μL纯化线粒体匀浆(含蛋白约20 μg)。
1.5 数据分析
试验数据整理和作图采用软件Excel 2010进行,多重比较则采用Duncan’s法利用SPSS 21.0软件进行,结果以“平均值±标准误”表示。
2 结果与分析
2.1 外源H2O2引发下燕麦种胚线粒体H2O2和MDA含量的变化
由图1可知,引发6 h~18 h时,燕麦种胚线粒体H2O2和MDA含量均随着H2O2引发浓度的增加而上升,并均在7.68 mol·L-1显著高于其他H2O2引发浓度(P<0.05);引发12 h和18 h的燕麦种胚线粒体H2O2和MDA含量在各个浓度之间存在显著变化(P<0.05)。H2O2引发浓度为0 mol·L-1时,燕麦种胚线粒体H2O2含量随引发时间延长无显著变化,而其MDA含量在引发18 h时则显著(P<0.05)高于CK;浓度为0.96 mol·L-1时,燕麦种胚线粒体H2O2和MDA含量均显著高于CK(P<0.05),其H2O2和MDA含量在引发6 h和12 h间均无显著变化,其H2O2在引发12 h和18 h间也无显著变化,而其MDA含量则在引发18 h时显著高于引发12 h(P<0.05);浓度为3.84 mol·L-1和7.68 mol·L-1时,燕麦种胚线粒体H2O2和MDA含量均在各个引发时间之间存在显著差异(P<0.05)。

图1 外源H2O2引发下燕麦种胚线粒体H2O2(A)和MDA(B)含量变化Fig.1 Changes of H2O2 (A) and MDA (B) contents in embryonic mitochondria of oat seeds after exogenous H2O2priming注:不同大写字母代表相同引发时间下各浓度间差异显著(P<0.05);不同小写字母表示相同的浓度下各引发时间之间差异显著(P<0.05)。下图同Note:Different capital letters mean significant differences at the 0.05 level among different concentrations at same priming time;Different small letters mean significant differences at the 0.05 level among different priming time with same concentrations. The same as below
2.2 外源H2O2引发下燕麦种胚线粒体SOD活性的变化
引发6 h~18 h时,燕麦种胚线粒体SOD活性会随H2O2浓度增加呈先升后降的趋势(图2);引发6 h和12 h时,其SOD活性均在1.92 mol·L-1时显著高于其他浓度(P<0.05);引发6 h时,浓度为0.96 mol·L-1~7.68 mol·L-1H2O2引发的燕麦种胚线粒体SOD活性均显著高于浓度为0 mol·L-1时(P<0.05);引发12 h时,浓度为0.96 mol·L-1~3.84 mol·L-1H2O2引发的燕麦种胚线粒体SOD活性显著高于H2O2引发浓度为0 mol·L-1时(P<0.05);引发18 h时,燕麦种胚线粒体SOD活性在H2O2浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),而H2O2引发浓度为7.68 mol·L-1时则显著低于浓度为0 mol·L-1时(P<0.05)。H2O2浓度为0 mol·L-1时,燕麦种胚线粒体SOD活性随引发时间的延长无显著变化;H2O2浓度为0.96 mol·L-1时,燕麦种胚线粒体SOD活性随引发时间的延长呈上升趋势,均显著高于CK(P<0.05),并在引发18 h时显著高于其他引发时间(P<0.05);H2O2浓度为1.92 mol·L-1时,燕麦种胚线粒体SOD活性随引发时间的延长呈先上升后下降的趋势,均显著高于CK(P<0.05),并在引发6 h和12 h时显著高于引发18 h(P<0.05);H2O2浓度为3.84 mol·L-1和7.68 mol·L-1时,燕麦种胚线粒体SOD活性均随引发时间的延长呈下降趋势,但在浓度为3.84 mol·L-1时引发6 h~18 h均显著高于CK(P<0.05),而浓度为7.68 mol·L-1时引发18 h则显著低于CK(P<0.05)。
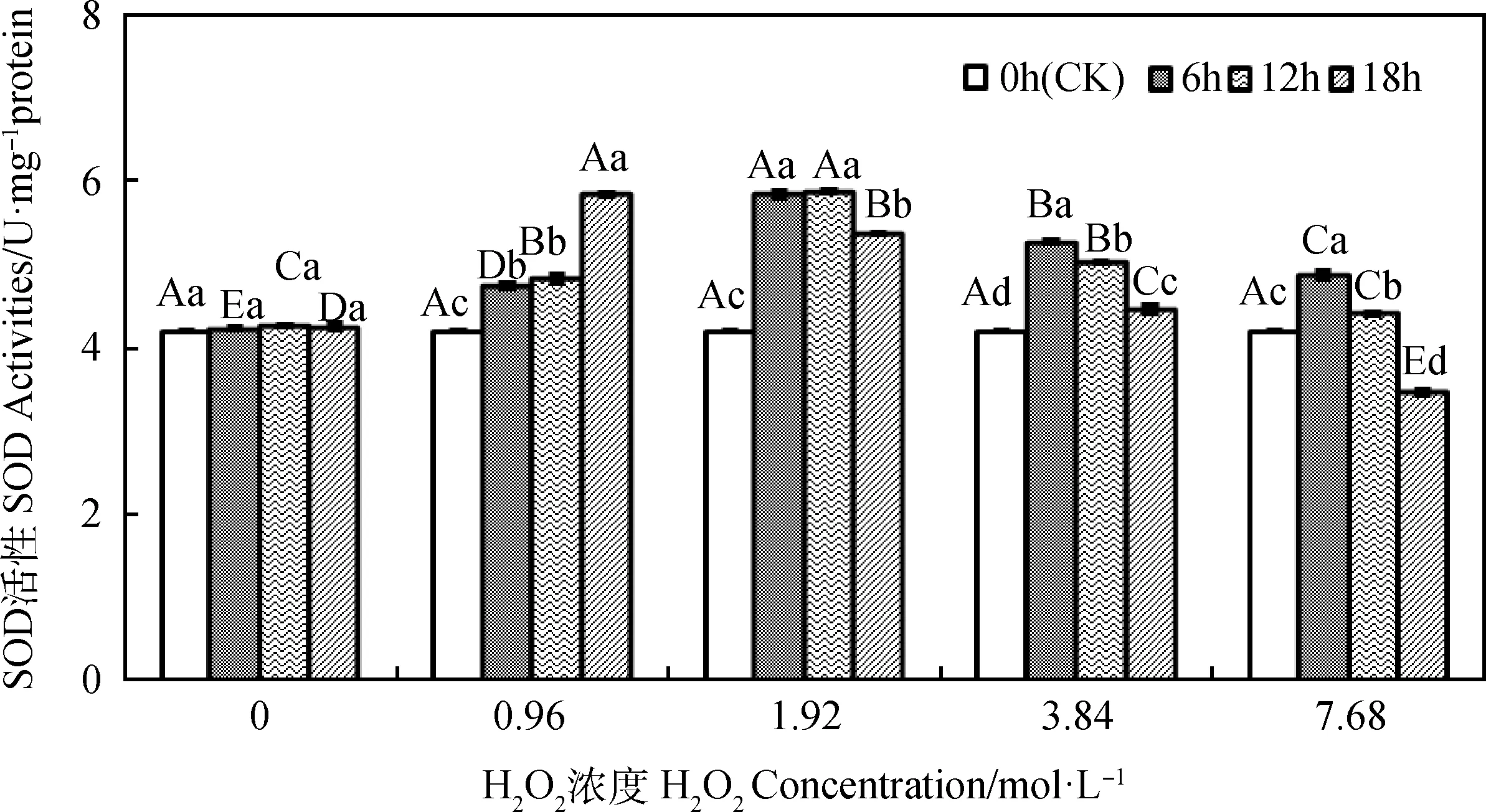
图2 外源H2O2引发下燕麦种胚线粒体SOD活性变化Fig.2 Changes of SOD activities in embryonic mitochondria of oat seeds under exogenous H2O2priming
2.3 外源H2O2引发下燕麦种胚线粒体APX活性的变化
引发6 h~18 h时,燕麦种胚线粒体APX活性会随H2O2浓度增加呈先升后降的趋势(图3);引发6 h时,燕麦种胚线粒体APX活性在H2O2浓度为3.84 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),在浓度为7.68 mol·L-1时显著低于浓度为0 mol·L-1时(P<0.05);引发12 h时,燕麦种胚线粒体APX活性在H2O2引发浓度为0.96 mol·L-1~3.84 mol·L-1时显著高于H2O2引发浓度为0 mol·L-1时(P<0.05),且H2O2引发浓度为1.92 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),H2O2引发浓度为7.68 mol·L-1时则显著低于H2O2引发浓度为0 mol·L-1时(P<0.05);引发18 h时,燕麦种胚线粒体APX活性在H2O2浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),H2O2引发浓度为3.84 mol·L-1和7.68 mol·L-1时则显著低于浓度为0 mol·L-1时(P<0.05)。H2O2浓度为0 mol·L-1时,燕麦种胚线粒体APX活性在引发6 h~18 h后均显著高于CK(P<0.05);H2O2引发浓度为0.96 mol·L-1时,燕麦种胚线粒体APX活性随引发时间的延长而显著上升(P<0.05),在引发18 h时显著高于其他引发时间(P<0.05);H2O2引发浓度为1.92 mol·L-1时,燕麦种胚线粒体APX活性随引发时间的延长呈先上升后下降的趋势,且均显著高于CK(P<0.05),并在引发12 h时显著高于其他引发时间(P<0.05);H2O2引发浓度为3.84 mol·L-1和7.68 mol·L-1时,燕麦种胚线粒体APX活性均随引发时间的延长呈下降趋势,但在浓度为3.84 mol·L-1时引发6 h和12 h均显著高于CK(P<0.05),引发18 h时则显著低于CK(P<0.05),而浓度为7.68 mol·L-1时引发6 h~18 h时均显著低于CK(P<0.05)。

图3 外源H2O2引发下燕麦种胚线粒体APX活性变化Fig.3 Changes of APX activities in embryonic mitochondria of oat seeds under exogenous H2O2priming
2.4 外源H2O2引发下燕麦种胚线粒体MDHAR活性的变化
引发6 h~18 h时,燕麦种胚线粒体MDHAR活性均会随H2O2浓度增加呈先升后降的趋势(图4);引发6 h时,燕麦种胚线粒体MDHAR活性在H2O2浓度为3.84 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),而在浓度为7.68 mol·L-1时显著低于浓度为0 mol·L-1时(P<0.05);引发12 h和18 h时,燕麦种胚线粒体MDHAR活性均在浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),H2O2引发浓度为1.92 mol·L-1~7.68 mol·L-1时显著低于浓度为0 mol·L-1时(P<0.05)。H2O2浓度为0 mol·L-1时,燕麦种胚线粒体MDHAR活性在引发0 h~18 h时无显著变化;H2O2引发浓度为0.96 mol·L-1时,燕麦种胚线粒体MDHAR活性随引发时间的延长呈先上升后下降趋势,在引发12 h时显著高于其他引发时间(P<0.05);H2O2引发浓度为1.92 mol·L-1~7.68 mol·L-1时,燕麦种胚线粒体MDHAR活性随引发时间的延长而显著下降(P<0.05),浓度为1.92 mol·L-1和3.84 mol·L-1时引发6 h的燕麦种胚线粒体MDHAR活性显著高于CK(P<0.05),而引发12 h和18 h的燕麦种胚线粒体MDHAR活性则显著低于CK(P<0.05),浓度为7.68 mol·L-1时引发6 h~18 h的燕麦种胚线粒体MDHAR活性均显著低于CK(P<0.05)。
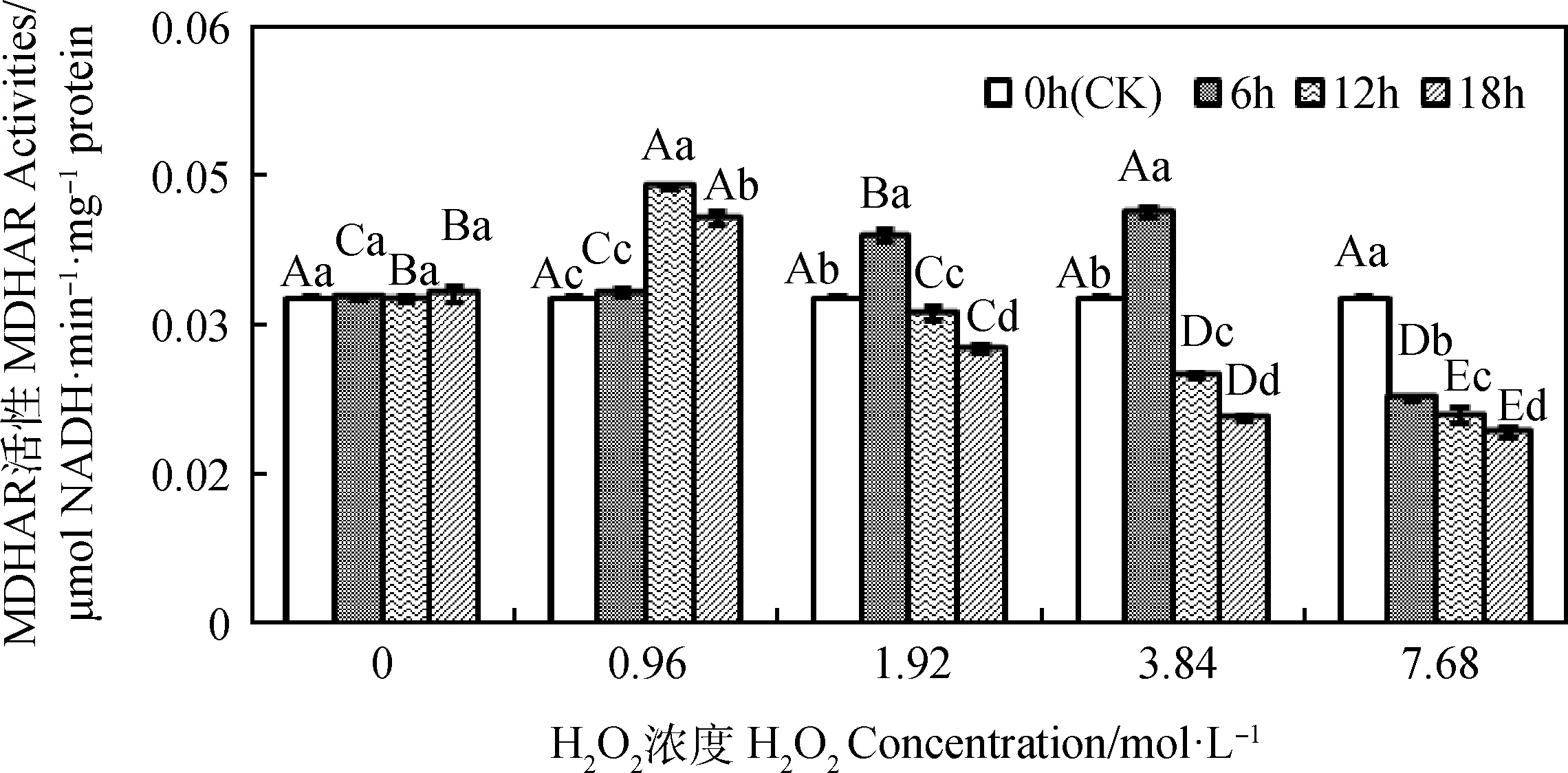
图4 外源H2O2引发下燕麦种胚线粒体MDHAR活性变化Fig.4 Changes of MDHAR activities in embryonic mitochondria of oat seeds under exogenous H2O2priming
2.5 外源H2O2引发下燕麦种胚线粒体DHAR活性的变化
引发6 h~18 h时,燕麦种胚线粒体DHAR活性均会随H2O2浓度增加呈先升后降的趋势(图5);引发6 h时,燕麦种胚线粒体DHAR活性在H2O2浓度为0.96 mol·L-1和1.92 mol·L-1时显著高于其他H2O2引发浓度(P<0.05);引发12 h时,燕麦种胚线粒体DHAR活性在浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),H2O2引发浓度为7.68 mol·L-1时显著低于浓度为0 mol·L-1时(P<0.05);引发18 h时,燕麦种胚线粒体DHAR活性也在浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),浓度为3.84 mol·L-1和7.68 mol·L-1时均显著低于浓度为0 mol·L-1时(P<0.05)。H2O2引发浓度为0 mol·L-1时,燕麦种胚线粒体DHAR活性在引发18 h时显著高于CK(P<0.05);H2O2引发浓度为0.96 mol·L-1时,燕麦种胚线粒体DHAR活性在引发6 h~18 h时均显著高于CK(P<0.05),并在引发6 h和12 h时显著高于引发18 h时(P<0.05);H2O2引发浓度为1.92 mol·L-1~7.68 mol·L-1时,燕麦种胚线粒体DHAR活性随引发时间的延长而显著下降(P<0.05);浓度为1.92 mol·L-1时引发6 h~18 h的燕麦种胚线粒体DHAR活性均显著高于CK(P<0.05),且引发6 h和12 h时显著高于引发18 h(P<0.05);浓度为3.84 mol·L-1时引发6 h和12 h的燕麦种胚线粒体DHAR活性仍显著高于CK(P<0.05);浓度为7.68 mol·L-1时引发6 h的燕麦种胚线粒体DHAR活性显著高于CK(P<0.05),而引发12 h和18 h时均显著低于CK(P<0.05)。

图5 外源H2O2引发下燕麦种胚线粒体DHAR活性变化Fig.5 Changes of DHAR activities in embryonic mitochondria of oat seeds under exogenous H2O2priming
2.6 外源H2O2引发下燕麦种胚线粒体GR活性的变化
引发6 h~18 h时,燕麦种胚线粒体GR活性均会随H2O2浓度增加呈先升后降的趋势(图6);引发6 h时,燕麦种胚线粒体GR活性在H2O2浓度为1.92 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),H2O2引发浓度为7.68 mol·L-1时显著低于浓度为0 mol·L-1时(P<0.05);引发12 h时,燕麦种胚线粒体GR活性在浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),浓度为7.68 mol·L-1时则显著低于浓度为0 mol·L-1时(P<0.05);引发18 h时,燕麦种胚线粒体GR活性也在浓度为0.96 mol·L-1时显著高于其他H2O2引发浓度(P<0.05),而在浓度为7.68 mol·L-1显著低于浓度为0 mol·L-1时(P<0.05)。H2O2引发浓度为0 mol·L-1时,燕麦种胚线粒体GR活性随引发时间延长无显著变化;H2O2引发浓度为0.96 mol·L-1时,燕麦种胚线粒体GR活性随引发时间延长呈先上升后下降的趋势,且均显著高于CK(P<0.05),并在引发12 h时显著高于引发6 h和18 h时(P<0.05);H2O2引发浓度为1.92 mol·L-1~7.68 mol·L-1时,燕麦种胚线粒体GR活性随引发时间的延长而显著下降(P<0.05);浓度为1.92 mol·L-1时引发6 h~18 h的燕麦种胚线粒体GR活性均显著高于CK(P<0.05),且引发6 h时显著高于引发12 h和18 h(P<0.05);浓度为3.84 mol·L-1时引发6 h和12 h的燕麦种胚线粒体GR活性仍显著高于CK(P<0.05);浓度为7.68 mol·L-1时引发6 h~18 h的燕麦种胚线粒体GR活性均显著低于CK(P<0.05)。

图6 外源H2O2引发下燕麦种胚线粒体GR活性变化Fig.6 Changes of GR activities in embryonic mitochondria of oat seeds under exogenous H2O2priming
3 讨论
低浓度H2O2是植物细胞内的小分子信号物质,可促进其抵御各类非生物胁迫,而高浓度H2O2则会诱导其细胞程序性死亡[32]。因此,种子活力的丧失主要是以H2O2为代谢核心的ROS过量积累导致抗氧化能力下降所造成的[33-34],这已在燕麦种子老化[21,35]及其活力修复[3,9,22]研究中得到验证。然而,低浓度H2O2处理促进黄瓜[11]、小白菜[12]和花生[13]等植物种子在非生物胁迫下萌发及幼苗生长则主要依赖其抗氧化能力的提升。本试验发现,燕麦种胚线粒体H2O2含量虽在低浓度(0.96 mol·L-1)的外源H2O2引发下显著(P<0.05)高于CK,但其SOD,APX,MDHAR,DHAR及GR活性也均显著(P<0.05)高于CK,并维持一个相对较高的水平,其MDA含量也维持在相对较对的水平,这说明此时燕麦种胚线粒体AsA-GSH循环的抗氧化能力仍能够缓解H2O2含量增加造成的脂质过氧化损伤,因而其种子活力水平下降幅度不大[14]。相反,燕麦种胚线粒体SOD,APX,MDHAR,DHAR及GR活性均在高浓度(3.84~7.68 mol·L-1)的外源H2O2引发下出现显著(P<0.05)下降,这表明燕麦种胚线粒体AsA-GSH循环已没有能力来维持其H2O2的正常水平,因而其H2O2含量会显著(P<0.05)增加,且其MDA含量也显著(P<0.05)升高,并达到一个相对较高的水平,燕麦种子活力水平也大幅地显著(P<0.05)降低[14]。这说明燕麦种胚线粒体AsA-GSH循环的抗氧化能力是维持其H2O2平衡、降低其脂质过氧化损伤的重要途径,且低浓度H2O2能够提高种胚线粒体AsA-GSH循环的抗氧化能力,而高浓度H2O2则会降低其抗氧化能力,这与老芒麦[15-16]、大豆[20,36]和燕麦[21]等植物种子老化研究的发现类似。
研究发现,外源H2O2浓度高低及其处理时间长短均对植物种子的萌发及幼苗生长具有重要影响[14]。本试验中,同一引发时间下,燕麦种胚线粒体内SOD,APX,MDHAR,DHAR和GR活性均随着引发时间的延长呈先升后降的趋势,而其H2O2和MDA含量则随着引发时间的延长呈上升趋势,这说明外源H2O2对燕麦种胚线粒体AsA-GSH循环抗氧化能力的影响与其引发时间有密切关系。引发6 h的燕麦种胚线粒体内SOD,DHAR和GR活性在浓度为1.92 mol·L-1时保持最高水平,其APX和MDHAR活性在浓度为3.84 mol·L-1仍保持最高水平,而引发18 h的燕麦种胚线粒体SOD,APX,MDHAR,DHAR及GR活性均在浓度为0.96 mol·L-1时才保持最高水平,这说明引发时间越短,造成燕麦种胚线粒体AsA-GSH循环抗氧化能力下降的H2O2浓度就越高,而引发时间越长则相反。因此,外源H2O2引发的时间越长则引起燕麦种子活力显著(P<0.05)下降的H2O2浓度就越低[14]。
4 结论
外源H2O2引发造成了燕麦种胚线粒体H2O2和丙二醛含量的升高,而种胚线粒体AsA-GSH循环对燕麦种子在外源H2O2引发下清除H2O2发挥着重要作用,且其抗氧化能力与外源H2O2的引发浓度和时间具有密切关系,低浓度(<0.96 mol·L-1)外源H2O2引发时间越短,其抗氧化酶活性的提升幅度就越小,引发时间越长,其抗氧化酶活性的提升幅度就越大;高浓度(>3.84 mol·L-1)外源H2O2引发时间越短,其抗氧化酶活性的下降就越慢,而引发时间越长,其抗氧化酶活性的下降则越快。
