紫花苜蓿MsJMT基因的克隆及其与育性的关联分析
2022-09-29徐小博王鑫尧郁伟杰苗一凡
徐小博, 王鑫尧, 郁伟杰, 苗一凡, 徐 博
(吉林农业大学林学与草学学院, 吉林 长春 130118)
茉莉酸类物质(Jasmonates,JAs)包括茉莉酸(Jasmonate,JA)及其甲基化衍生物茉莉酸甲酯(Methyl jasmonate,MeJA)等[1],均参与植物的生长发育促进株体循环代谢,但不同JAs在其功能及用途方面具有差异性。茉莉酸甲基转移酶(Jasmonate methyl transferase,JMT)是促进JA转化为MeJA反应的关键酶[2],2001年始Seo等韩籍科学家开始关注JMT对JAs分泌的促进作用,并通过相关研究表明JMT的过表达能够显著提高马铃薯(SolanumtuberosumL.)[3]、人参(PanaxginsengC. A. Meyer)[4]等高等植物中MeJA含量;Qi等在大花蕙兰(CymbidiumhybridL.)花香物质合成通路中也发现相似结果[5]。JMT作为JA与MeJA的转化酶近年来才渐被关注,且JMT基因已成功在甘蔗(SaccharumofficinarumL.)[6]、茶树(CamelliasinensisL.)[7]和紫苏(PerillafrutescensL.)[8]中表达。
迄今为止,关于JMT基因的研究多从调控植物果实大小、植株形态及抗逆性等方面考虑[6-7,9],与植物育性相关的研究暂未发现,且紫花苜蓿不育机理网络还未构建清晰,JAs在紫花苜蓿配子体发育过程中参与哪些过程还未明晰。实验室前期研究表明[10],MsJMT在BSR育性混池中差异表达,那么验证该基因是否参与紫花苜蓿的不育机制则是本试验的基础思路。
因此,试验通过克隆MsJMT基因全长并进行序列分析预测其功能,使用亚细胞定位、qPCR技术等明确其在细胞学层面和核酸层面的时空表达位置与表达量的变化,意在研究JA通路与MsJMT之间的关系和二者对紫花苜蓿(MedicagosativaL.)不育系的影响,为探究紫花苜蓿的不育机制奠定基础。
1 材料与方法
1.1 试验材料
本试验选取的紫花苜蓿不育系MSJN-1A与保持系MSJN-1B植物材料由吉林农业大学提供,于2019年6月采集自吉林农业大学动物科学技术学院牧草育种实验基地内。
1.2 试验方法
1.2.1紫花苜蓿总RNA及cDNA的获取 使用Plant RNA Mini Kit(OMEGA)进行试验[11],以RNA为模板使用ReverTra Ace qPCR RT Kit(TOYOBO)进行反转录得到cDNA,产物保存于-20℃保存。
1.2.2MsJMT基因的获取 实验室于2019年7月构建紫花苜蓿不育系BSA混池(规模:30+30+2)并委托百迈克生物科技有限公司完成了三代转录组测序工作,结果分析可知c115887.graph_c0基因片段预测功能为调控茉莉酸O-甲基转移酶合成[10,12-13]。通过DNAMAN Version 9软件进行序列拼接并于NCBI Blast同源比对后得到MsJMT基因预测全长序列。以紫花苜蓿cDNA为模板,设计引物MsJMT-25(表1)并扩增MsJMT基因全长[14]。后选用Mighty TA-cloning Reagent Set for PrimeSTAR(TAKARA)连接至pMD20-T vector。使用M13引物进行PCR检测,上样电泳确认条带,将阳性子送至生工生物工程(上海)股份有限公司测序。菌液以1∶1 000浓度振荡培养并抽提质粒。命名为pMD20T-MsJMT。质粒提取使用Plasmid Mini Kit Ⅰ(OMEGA)[15]。
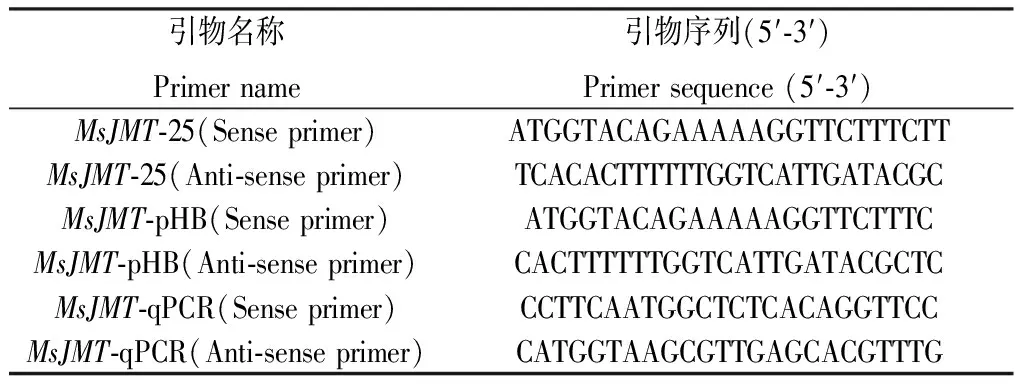
表1 引物列表Table 1 Primer list
1.2.3MsJMT基因序列分析 采用表2中分析工具对MsJMT基因序列进行分析

表2 基因序列分析工具Table 2 Gene sequence analysis tools
1.2.4亚细胞定位 以克隆载体为模板,5′端3′端分别添加BamHI,PstI酶切位点设计引物MsJMT-pHB(表1),配制反应体系。PCR胶回收后37℃双酶切30 min,确认酶切充分后将胶回收产物连接至亚细胞定位载体(pHB-YFP)进行大肠杆菌转化。电泳后根据片段位置挑选阳性子送测,确认序列一致后扩大培养并抽提质粒。命名为Phb-YFP-MsJMT。将转化入质粒pHB-YFP空载、pHB-YFP-MsJMT的农杆菌扩繁并重悬菌体,调菌液OD600到0.6~0.8室温静置1 h;选取6~8周大的本室烟草,将菌液注射进烟草叶片中黑暗培养过夜,后正常培养3天,进行激光共聚焦观察荧光。
1.2.5qPCR 以纵长为参数,提取不育系、保持系Ⅰ~Ⅳ时期花苞总RNA(Ⅰ:≤0.2 cm;Ⅱ:0.2~0.4 cm;Ⅲ:0.4~0.6;Ⅳ:0.6~0.8 cm),每时期3个重复,根茎叶同时进行取样。定量后反转录;设计扩增片段为101 bp的MsJMT-qPCR引物(表1),以紫花苜蓿Actin2为内参[16],配置qPCR反应体系,每组均设复孔、空白孔,短暂离心后上机;所得结果采用2-△△CT法[17]计算基因相对表达量。
1.2.6茉莉酸含量测定 采用Plant Jasmonic acid(JA)ELISA Kit(上海酶联生物)进行测定[18]。
1.2.7外源MeJA喷施方案 初花期紫花苜蓿不育系若干株,选取其中具有顶端开放1~5朵花花序的枝条,在离花序约15 cm处剪断,插入瓶中带回室内水培。MeJA+0.2%DMSO+0.1%TWEEN-20用蒸馏水稀释至0.5 mmol·L-1,1 mmol·L-1,2 mmol·L-1。将以MeJA处理的实验组命名为A(0.5 mmol·L-1)、B(1 mmol·L-1)和C(2 mmol·L-1),对照组命名为CK,CK组除不加MeJA外与其余试剂配比相同,每组两枝,含花序8~10个,9∶00,16∶00各1次进行喷施处理,喷施程度以花托完全湿润为基准,5 d后取Ⅲ时期花蕾进行切片观察[19]。
1.2.8切片方法 采用HE染色法进行染色并切片[20]。
1.2.9数据处理 数据的分析和计算采用Excel 2016和SPSS 25.0软件进行处理。
2.1 扩增目的基因全长
以cDNA为模板扩增MsJMT基因全长,高保真酶产物如图1所示。MsJMT基因全长为1 047 bp,电泳图条带清晰,位置正确,可以纯化后用于后续试验。
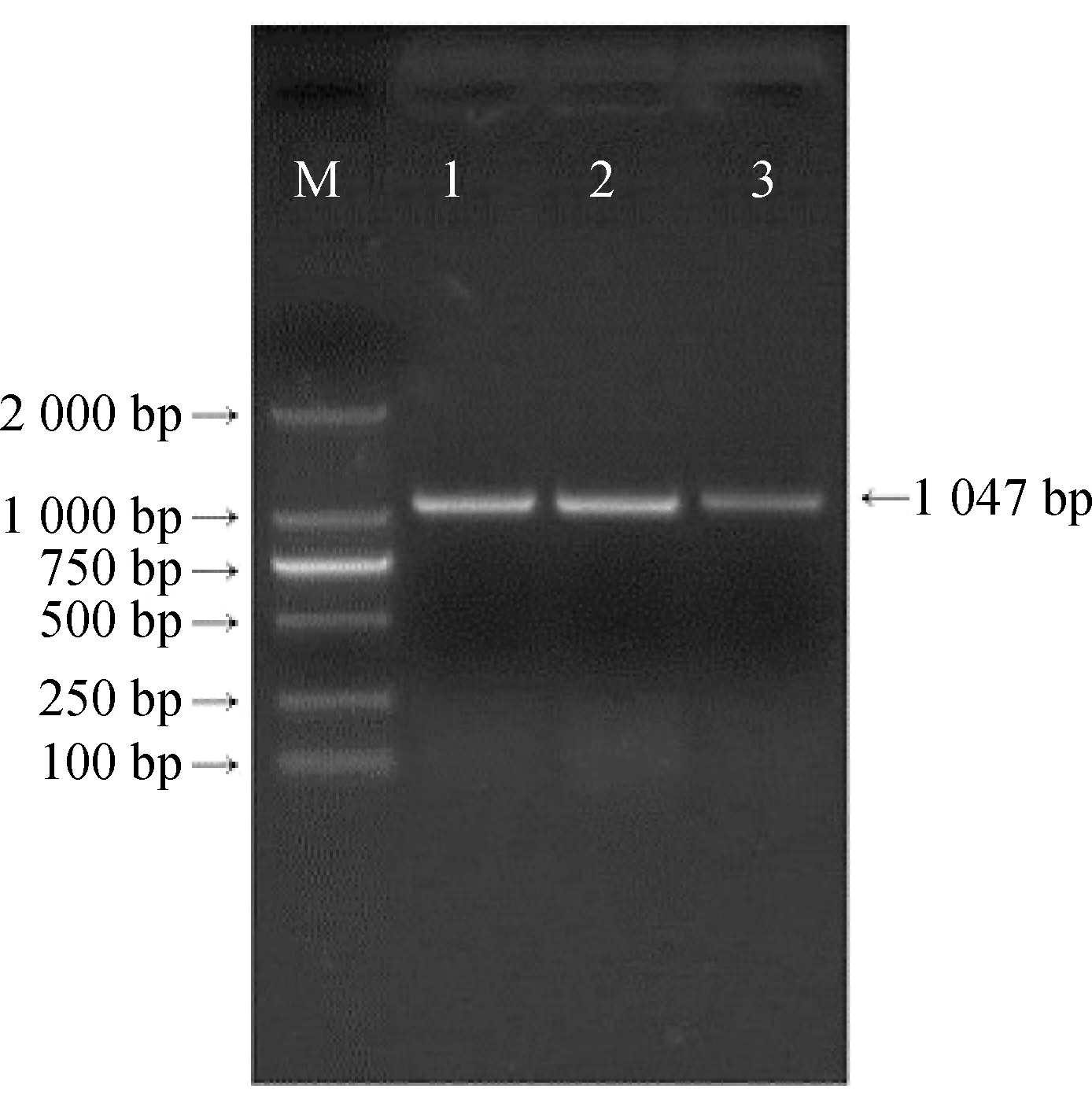
图1 MsJMT基因全长扩增电泳图Fig.1 Electrophoretic map of full-length MsJMT amplification注:M为D2000 DNA Marker,1~3为MsJMT全长片段Note:M is D2000 DNA Marker,1~3 are full-length fragments of MsJMT
2.2 MsJMT基因全长序列
测序结果经分析后得到MsJMT基因全长序列1 047 bp(图2)。
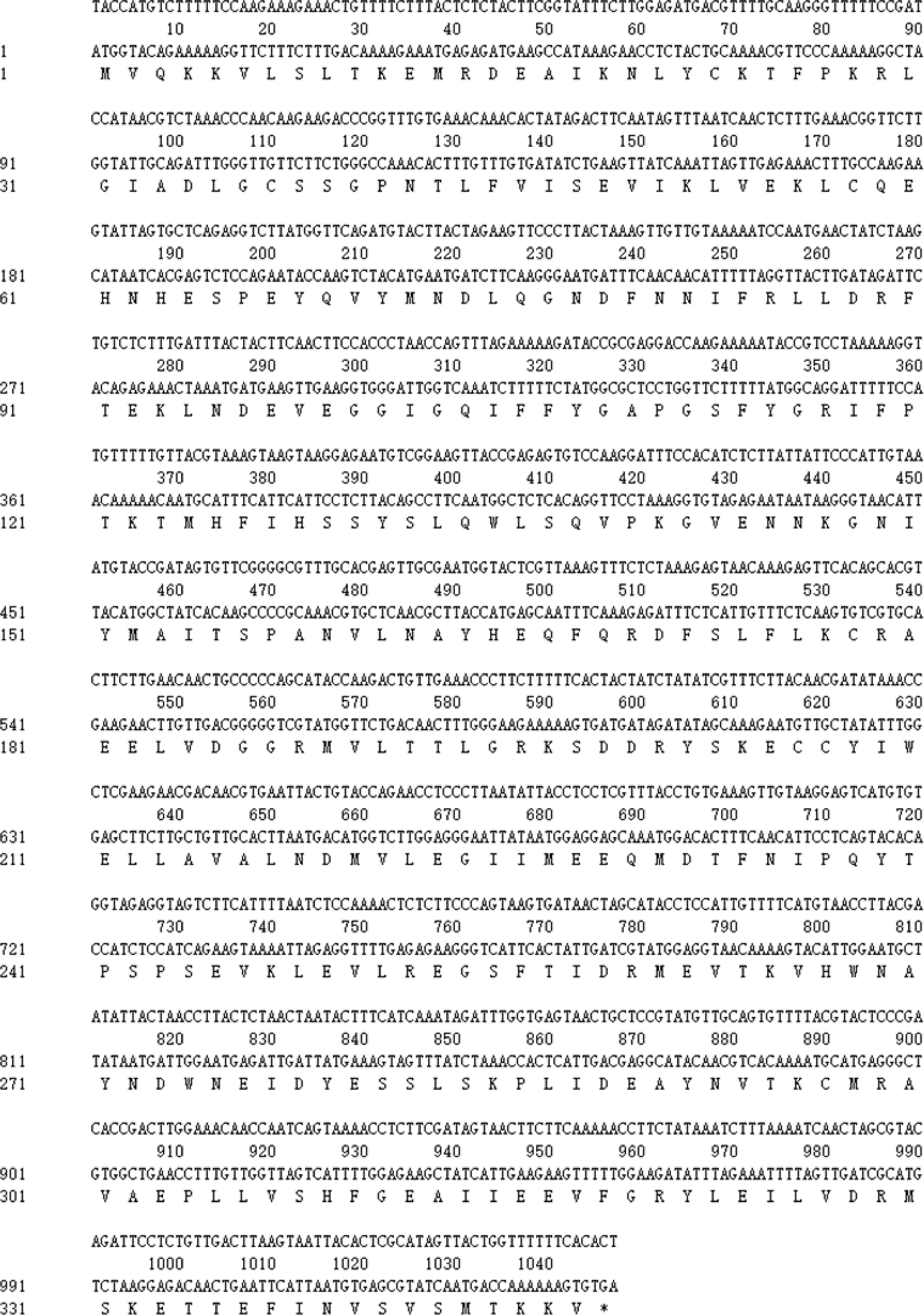
图2 MsJMT基因全长序列Fig.2 Full length sequence of MsJMT
2.3 理化性质分析
利用NCBI中的ORF Finder程序进行分析,如图3A所示,MsJMT潜在的编码框为10个,MsJMT完整开放阅读框位于核苷酸序列的1到1 047 bp之间,全长为1 047 bp,共编码348个氨基酸。使用ProtParam工具对MsJMT基因编码蛋白的物理和化学参数进行计算,MsJMT蛋白包括348个氨基酸,其中含量最高的氨基酸是谷氨酸Glu(33个,9.5%)、亮氨酸Leu(32个,9.2%)、缬氨酸Val(26个,7.5%),根据Guruprasad等[21]提供的权重值计算出MsJMT蛋白不稳定系数为41.63,为不稳定蛋白。采用Prabi在线软件对蛋白二级结构进行预测,分析结果如图3B所示。可知蛋白质的二级结构都由α-螺旋(Alpha helix)、延伸链(Extended strand)和无规则卷曲(Random coil)组成,MsJMT所占比例分别是37.93%,24.14%,37.93%。利用Expasy软件的SMART程序预测MsJMT编码的蛋白质结构保守结构域为图3C,发现位于16~346之间含有一个Methyltransf_7结构域,表明该蛋白GO功能为甲基转移酶活性。参考二级结构预测于Swiss-model服务器得出蛋白三级结构预测模型(图3D)。
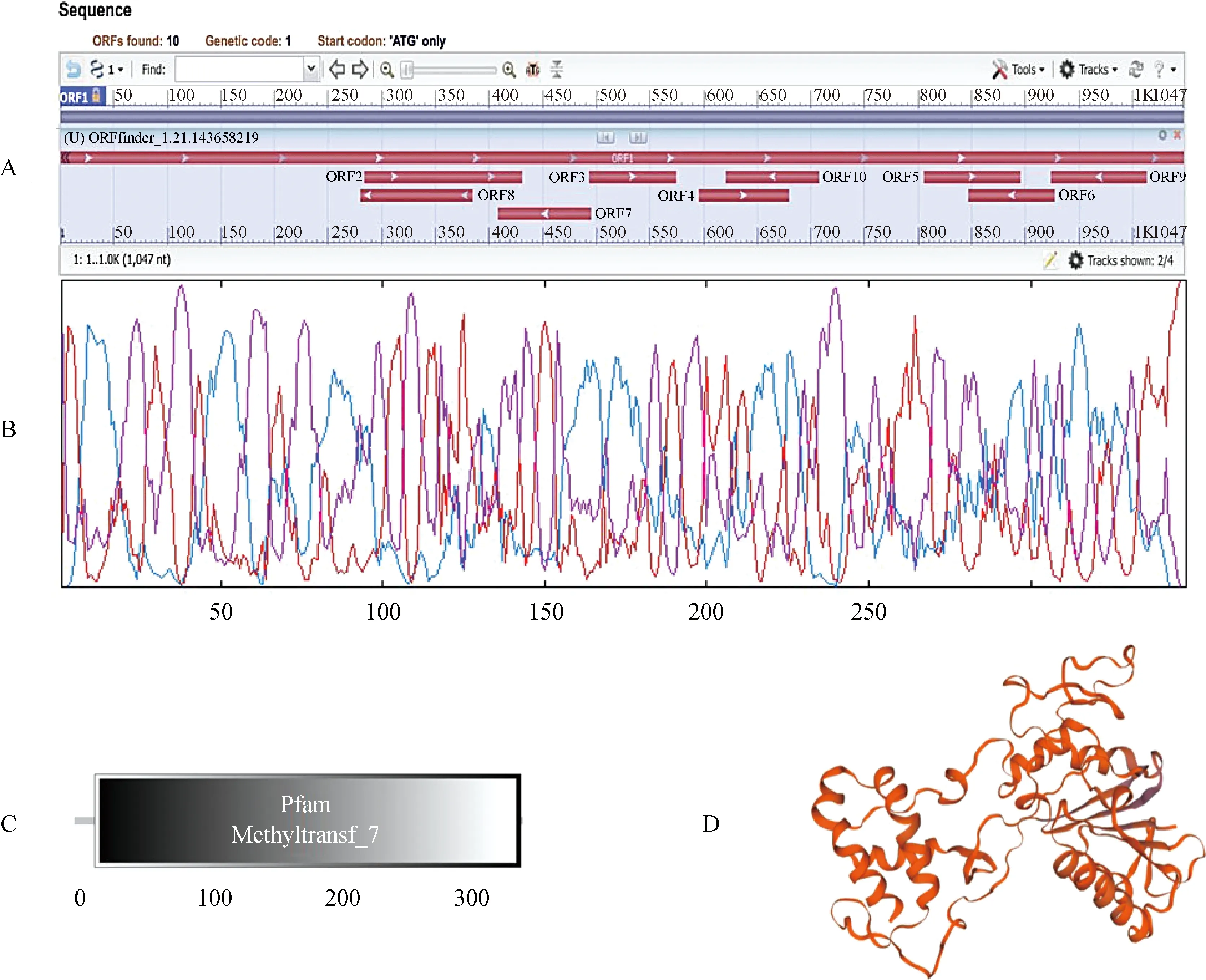
图3 MsJMT基因ORF(A)、蛋白二级结构(B)、蛋白结构域(C)和蛋白三维结构(D)预测图Fig.3 ORF finder(A),secondary protein structure(B),protein domain(C) and protein three-dimensional structural model(D) of MsJMT gene
2.4 亚细胞定位预测
运用TargetP 2.0服务器预测MsJMT编码蛋白的亚细胞位置,返回的结果如图4A所示。MsJMT基因编码的蛋白Ctp值与Tltp值均为0,仅Mtp值为0.000 8,排除了在细胞外分泌的可能。预测该蛋白主要是存在于细胞质的非分泌型蛋白,主要在细胞内发挥生物学作用。运用Cell-PLoc 2.0服务器预测,结果表明该蛋白为核质分泌蛋白(图4B)。
2.5 BLAST比对、同源性分析和系统进化树构建
在NCBI数据库的非冗余蛋白数据库(Nr)中下载与MsJMT高度同源的6条蛋白序列进行同源比对。所选取的序列和相似度结果为:蒺藜苜蓿(Medicagotruncatula,XP_003612068.1)相似度达100%;相思豆(Abrusprecatorius,XP_027362137.1)相似度100%;野大豆(Glycinesoja,XP_028197088.1)相似度100%;密花豆(Spatholobussuberectus,TKY55844.1)相似度100%;大豆(Glycinemax,NP_001237122.1)相似度100%;野大豆(Glycinesoja,RZC23540.1)相似度99%(图4C)。利用Clustal Omega软件分析MsJMT与其他物种同源蛋白的进化关系,构建系统进化树,如图4D。MsJMT与蒺藜苜蓿分子距离最近,其次与相思豆、野大豆、密花豆、大豆等植物的分子距离相对较近,证实MsJMT基因编码蛋白序列与这6条蛋白序列具有极高的序列相似度。

图4 TargetP 2.0(A),Cell-PLoc 2.0(B)服务器对MsJMT基因编码蛋白亚细胞定位预测及其编码氨基酸序列同源比对 (C)和系统发育树分析图(D)Fig.4 The subcellular localization prediction from TargetP 2.0(A) and Cell-PLoc 2.0(B) server,the homology comparison of coding amino acid sequence(C)and the phylogenetic tree(D)of MsJMT gene
2.6 亚细胞定位结果
如图5所示,激光共聚焦显微镜下发光部位于细胞核和细胞质。说明MsJMT在烟草叶片细胞中的瞬时表达位于细胞核和细胞质,和亚细胞定位预测结果一致。
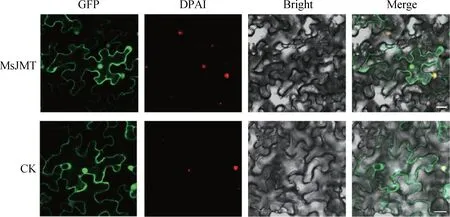
图5 MsJMT亚细胞定位结果Fig.5 MsJMT subcellular localization
2.7 qPCR相对定量结果
将紫花苜蓿Actin2基因作为内参基因,保持系作为参照因子(Calibrator),计算出2-△△CT值。经T检验分析后得到,对比保持系,不育系花苞的MsJMT表达量在4个时期均显著上升(P<0.05),且在Ⅲ时期表现为极显著(P<0.05);在植株根茎叶部分不育系与保持系表达量差异不显著。
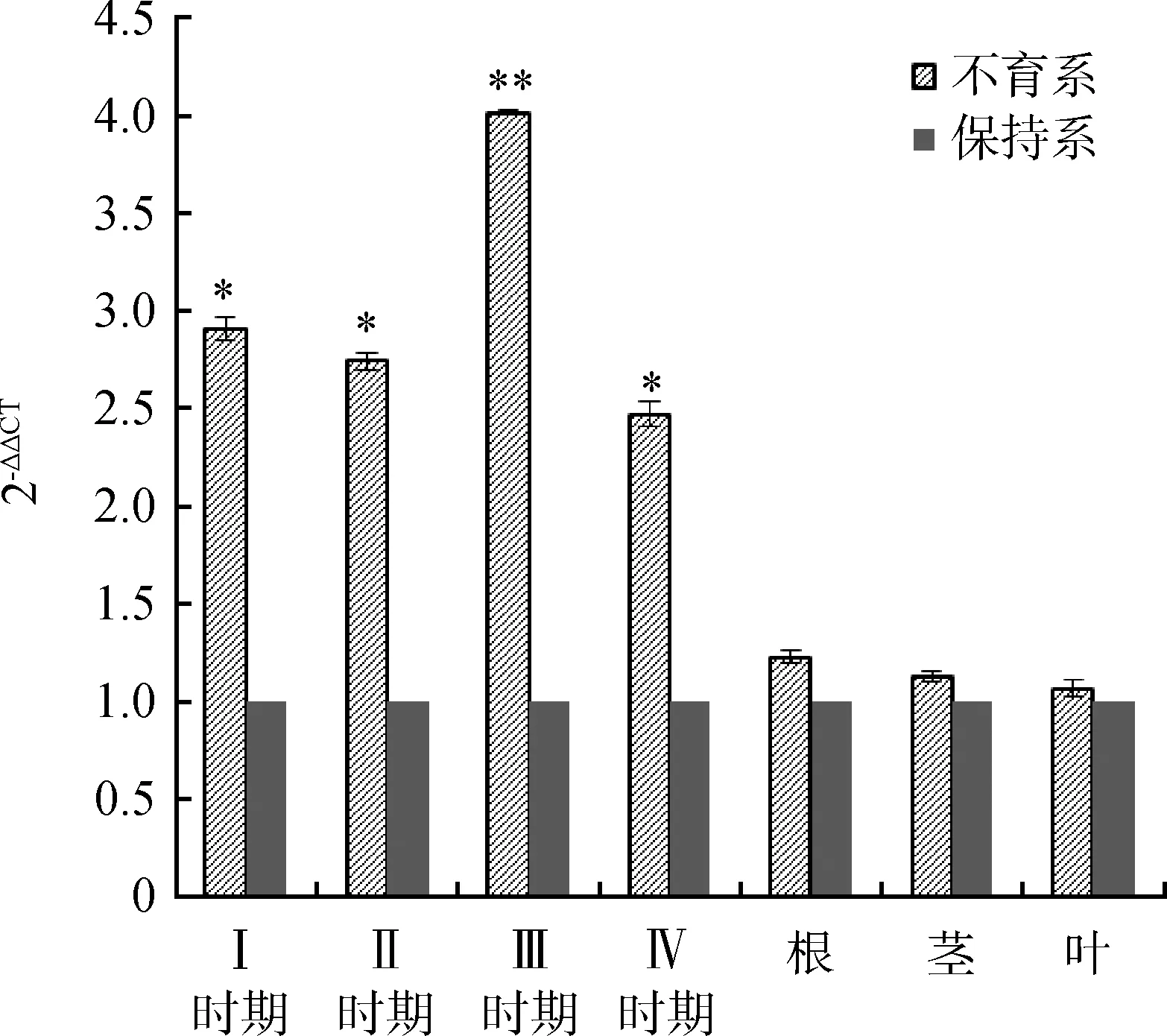
图6 MsJMT在不育系各时期的相对表达量Fig.6 The relative expression of MsJMT in male sterile lines at different stages注:不同字母表示在不同处理下差异显著(P<0.05),“*”表示在不同处理下差异显著(0.01≤P<0.05),“* *”表示在不同处理下差异极显著(0.001≤P<0.01),下同Note:Different letters indicate significant difference under different treatments at the 0.05 level,“*” indicates significant difference under different treatments (0.01≤P<0.05),“* *” indicates a very significant difference under different treatments (0.001≤P<0.01), the same as below
2.8 不同发育时期花苞内茉莉酸含量变化
以标准物浓度为横坐标,吸光度为纵坐标建立标准曲线得到:y≈0.000 5x+0.112 6,且R2>0.95具有可参照性。
由标准曲线得到Ⅰ~Ⅳ时期不育系保持系的花苞JA含量,结果可得,不育系JA含量在全时期内无显著波动且低于保持系,保持系的JA含量在Ⅱ,Ⅲ时期均显著升高,且在Ⅲ时期时达到最高,为同时期不育系的1.54倍。
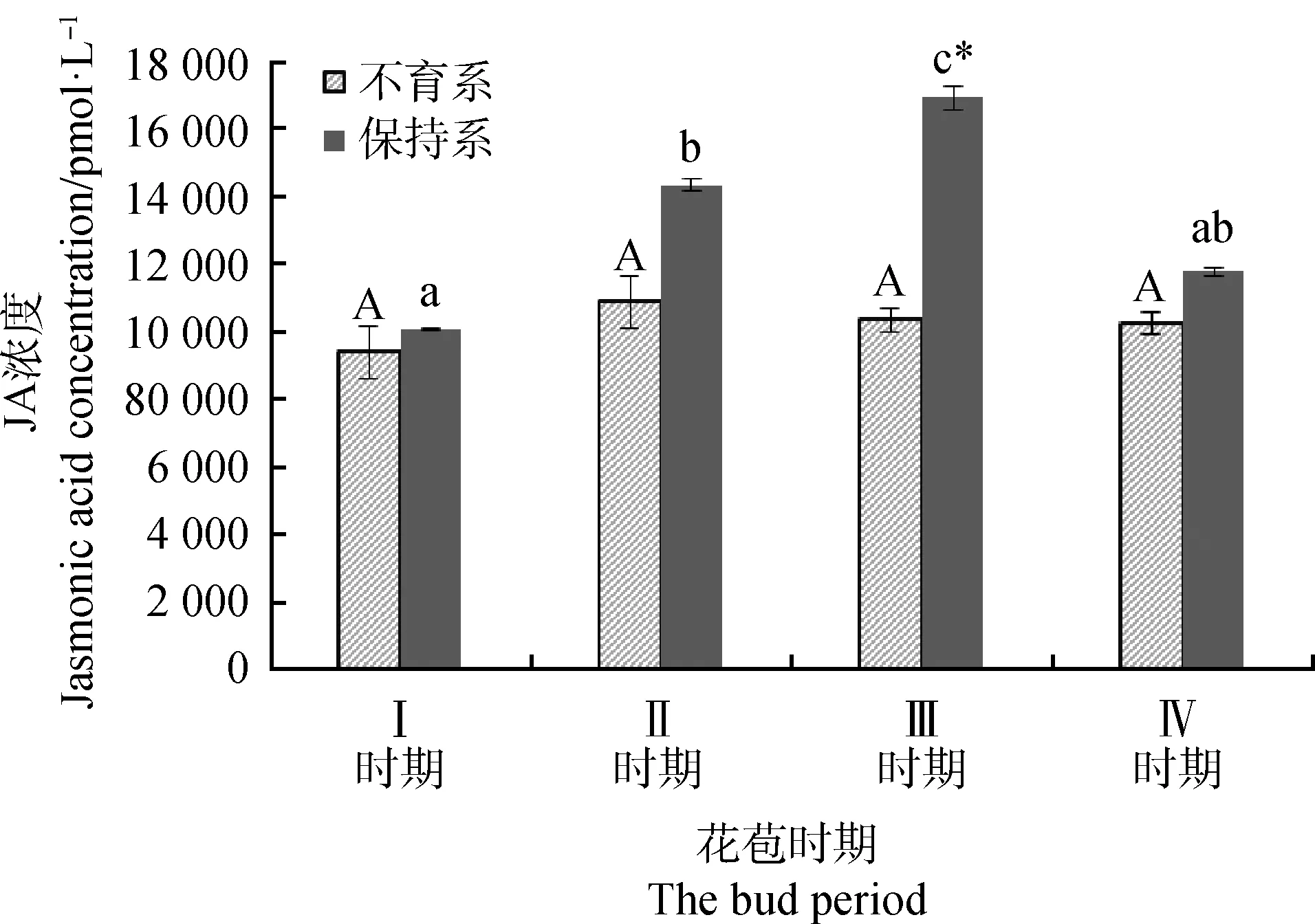
图7 紫花苜蓿不育系保持系各时期花苞内JA含量Fig.7 The content of jasmonic acid in the flower buds of the sterile lines of alfalfa was maintained
2.9 外源MeJA喷施后不育系花药形态特征
如图8所示,处理后,CK组花药无开裂现象;A组花药虽开裂但其形态不自然,可见花药壁回缩;B组花药裂口较大,药室形态饱满,开裂完全;C组喷施后出现花苞掉落现象,观察顶部Ⅰ时期花药形态可见4药室与药隔均萎缩。
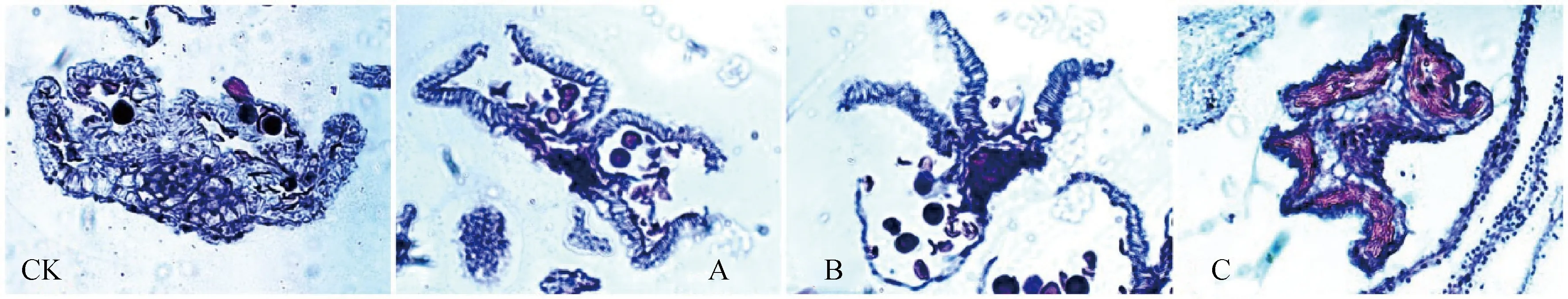
图8 不同浓度MeJA溶液喷施不育系药切片Fig.8 Sterile line Ⅲ period sections spray on different concentrations of MeJA solution注:CK,A,B组为Ⅲ时期,C组因喷施后具花苞脱落现象故取Ⅰ时期(×80)Note:Group CK,A and B were stage Ⅲ,and group C was stage Ⅰ because of the phenomenon of flower bud shedding after spraying(×80)
3 讨论
由基因序列分析可知,MsJMT基因全长1 047 bp,具有Methyltransf_7保守结构域。陈丽兰等[6]认为包含此保守结构域的ScJMT基因属于SABATH甲基转移酶家族,且在进化树分析下发现JMT基因在植物界基因序列差异性较大,尤其在单双子叶间亲缘关系较远,但功能性相对保守,因此具有家族共性,适合于模式植物研究。由本试验结果可知,不育系苜蓿在花苞Ⅲ时期MsJMT表达量最高,且在Ⅰ~Ⅳ时期内,不育系花苞的表达量均高于保持系,此结果与棉花(Gossypiumspp.)细胞质雄性不育系得到的结论相同[22],可以推断由MsJMT调控的JMT蛋白在花苞处作用,在特定时期通过调控JA与MeJA的转化效率从而控制育性器官内的激素水平,达到影响植株育性的目的。JMT作用于亚麻酸通路下的茉莉酸内外源转化,催化JA甲基化形成MeJA,因此JMT主要作用于细胞内部,与亚细胞定位结果相吻合。在水稻(OryzasativaL.)中,过表达JMT基因会降低穗长、种子质量和结实率[23-24];相同情况在拟南芥(ArabidopsisthalianaL.)中也有所表现[25],这暗示了JMT或具有影响植物育性的功能,根据qPCR结果可得,MsJMT在不育系花苞相对表达量较高,与此推论契合。
对于MeJA来说,作为JMT催化的反应产物,其为一种外源植物间介导激素,可作为植物生长调节剂使用,适量的喷施可促进花药开裂[26]。本试验表明,CK组不育系药室裂口闭合;A,B组经MeJA处理使本应闭合的花药裂口张开(图8)。可见适量浓度的MeJA虽无法促进小孢子的正常发育,但可诱导花药开裂。而紫花苜蓿不育系的表型特征即为花药不开裂、花粉育性差,因此MeJA在一定程度上具有改善育性功能的作用。
本试验中,MsJMT在紫花苜蓿不育系内表达对比保持系各时期呈下调趋势,且花苞内MsJMT的表达量与JA含量呈负相关关系,此结果与实验室之前对紫花苜蓿进行BSR筛选在转录组层面得到的结果一致,因此可推断MsJMT的过表达应当为导致紫花苜蓿雄性不育原因的其中之一。
4 结论
本试验成功克隆了MsJMT基因全长。结果表明MsJMT的表达在不育组与可育组间具有差异。利用外源MeJA喷施证实该激素对花药开裂具促进作用,且最适浓度为1 mmol·L-1。以上表明MsJMT可能通过影响JA通路参与植株育性表达,后续转化验证工作有待进行,下一步可针对该通路进行育性候选基因挖掘。
