乳腺癌患者血清中B7-同源物2和B7-同源物3的表达及临床意义
2022-09-29王璐,刘敏
王 璐,刘 敏
(1.南京中医药大学,江苏 南京 210023;2.南京中医药大学附属苏州市中医医院肿瘤科,江苏 苏州 215000)
乳腺癌作为女性发病率最高的恶性肿瘤,其发病率和病死率仍逐年攀升,严重影响患者的生活质量和生命健康。2018年世界卫生组织公布的流行病学调查数据显示,中国女性乳腺癌发病及死亡的人数居世界前列,分别占全世界女性乳腺癌发病和死亡人数的17.6%和15.6%[1]。随着对乳腺癌发病机制研究的深入,乳腺癌的诊疗取得了一定的进展,但仍有3%~10%的患者在首诊时即发现肺、骨、脑等远处转移,30%的早期患者仍会发展为晚期乳腺癌[2]。转移或复发的晚期乳腺癌的治疗难度大,患者的预后和生活质量较差。随着乳腺癌免疫学特征研究的深入,免疫治疗已成为乳腺癌治疗的新热点。目前,乳腺癌免疫治疗研究主要集中在肿瘤疫苗、过继性免疫细胞疗法、免疫检查点抑制剂,其中,免疫检查点抑制剂是一个重要的研究方向。尽管针对细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA4)和程序性死亡受体-1(programmed cell death protein-1,PD-1)/程序性死亡配体1(programmed cell death-ligand 1,PD-L1)的免疫检查点抑制剂取得重大进展,但是单药治疗乳腺癌的疗效有限。因此,提高早期诊断率、寻找肿瘤免疫治疗的新靶点的需求越来越迫切。
机体针对肿瘤的免疫应答主要通过活化的T淋巴细胞发挥作用,而T淋巴细胞的活化需要双重信号的诱导。第一信号是T细胞受体识别由抗原递呈细胞(antigen presenting cell,APC) 递呈的主要组织相容性复合体;第二信号即共刺激信号,由APC表面表达的共刺激分子与T细胞上的相应受体作用产生[3]。B7家族是最主要的共刺激分子,B7-同源物2(B7 homolog 2,B7-H2)和B7-同源物3(B7 homolog 3,B7-H3)是新近发现的共刺激分子。研究发现,B7-H2和B7-H3在胃癌、结直肠癌、肝细胞癌、乳腺癌、非小细胞肺癌等多种恶性肿瘤组织中异常表达,与患者的临床病理特征及预后相关,认为B7-H2和B7-H3信号通路在肿瘤免疫应答中发挥重要作用[4-8]。本研究旨在通过检测乳腺癌患者血清中B7-H2、B7-H3的表达,分析其与乳腺癌患者临床病理特征的关系,为寻找有效的乳腺癌诊断指标及免疫治疗靶点提供理论依据。
1 资料与方法
1.1 一般资料选择2018年1月至2019年6月南京中医药大学附属苏州市中医医院收治的45例乳腺癌患者为研究对象。病例纳入标准:(1)符合乳腺癌相关诊断标准[2],患者均经手术或穿刺活检后病理组织学确诊;(2)入院前未接受过免疫治疗且同意在本院接受治疗;(3)临床资料完整。排除标准:(1)合并其他恶性肿瘤;(2)患有严重心肺疾病;(3)合并其他免疫性疾病。本研究中45例患者均为女性;年龄24~83(53.60±15.76)岁,≤60岁20例,>60岁25例;肿瘤直径:≤2 cm者15例,>2 cm者30例;TNM分期:Ⅰ、Ⅱ期患者18例,Ⅲ、Ⅳ期患者共27例;浸润性导管癌34例,其他类型11例;有远处转移者13例,无远处转移者32例;有淋巴结转移者24例,无淋巴结转移者21例;雌激素受体(estrogen receptor,ER)阴性者21例,ER阳性者24例;孕激素受体(progesterone receptor,PR)阴性者28例,PR阳性者17例;人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)阴性者19例,HER-2阳性者26例。另选择同期在本院体检中心体检的25例健康女性作为对照组,年龄21~78(58.84±13.46)岁。2组受试者的年龄比较差异无统计学意义(P>0.05),具有可比性。研究对象均知情同意并签署知情同意书,本研究经南京中医药大学附属苏州市中医医院伦理委员会审查批准。
1.2 血清B7-H2、B7-H3水平检测抽取2组受试者清晨空腹静脉血5 mL,置于乙二胺四乙酸处理过的抗凝管中,室温静置超过30 min,3 000 r·min-1离心10 min,收集上清液,置于-70 ℃冰箱保存。采用酶联免疫吸附法测定血清中B7-H2、B7-H3水平,试剂盒购自苏州旭光科星生物技术有限公司,严格按照试剂盒说明书进行操作。
1.3 乳腺癌患者临床资料收集通过查阅病历收集乳腺癌患者的临床资料,包括年龄、肿瘤直径、TNM分期、病理类型、是否有远处转移、是否有淋巴结转移及ER、PR、HER-2表达情况。

2 结果
2.1 2组受试者血清B7-H2、B7-H3 水平比较结果见表1。乳腺癌组患者血清中B7-H2、B7-H3水平显著高于对照组,差异有统计学意义(P<0.05)。

表1 2组受试者血清B7-H2、B7-H3 水平比较
2.2 乳腺癌患者血清中B7-H2、B7-H3水平与患者临床病理特征的关系结果见表2。乳腺癌患者血清B7-H2水平与患者的年龄、肿瘤直径、TNM分期、病理类型、远处转移、淋巴结转移、ER、PR、HER-2无关(P>0.05);血清B7-H3水平与患者的TNM分期、远处转移、淋巴结转移有关(P<0.05),与患者的年龄、肿瘤直径、病理类型、ER、PR、HER-2无关(P>0.05)。

表2 B7-H2、B7-H3水平与乳腺癌患者临床病理特征的关系
2.3 乳腺癌患者血清中B7-H2与B7-H3水平的相关性乳腺癌患者血清中B7-H2与B7-H3表达呈正相关(r=0.307,P<0.05)。
2.4 血清B7-H2、B7-H3水平对乳腺癌的诊断价值结果见图1。B7-H2诊断乳腺癌的AUC为0.866(95%置信区间:0.763~0.935),最佳截断值为317.81 μg·L-1,灵敏度为75.6%,特异度为96.0%。 B7-H3诊断乳腺癌的AUC为0.895(95%置信区间:0.799~0.956),最佳截断值为49.83 μg·L-1,灵敏度为91.1%,特异度为 84.0%。 B7-H2联合B7-H3诊断乳腺癌的AUC为0.959(95%置信区间: 0.883~0.952),灵敏度为93.3%,特异度为88.0%。B7-H2联合B7-H3诊断乳腺癌的AUC显著高于B7-H2,差异有统计学意义(Z=2.348,P<0.05);B7-H2联合B7-H3与B7-H3单独检测诊断乳腺癌的AUC比较差异无统计学意义(Z=1.938,P>0.05),B7-H2与B7-H3单独检测诊断乳腺癌的AUC比较差异无统计学意义(Z=0.466,P>0.05)。
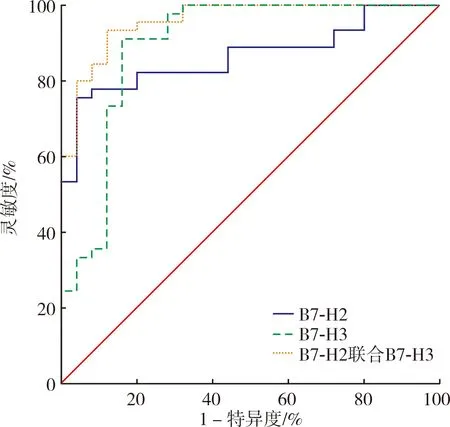
图1 血清B7-H2与B7-H3水平单独及联合诊断乳腺癌的ROC曲线
3 讨论
乳腺癌已经成为世界范围内发病率最高的女性恶性肿瘤,是女性恶性肿瘤死亡的首要原因,对女性健康造成极大威胁[1]。2018年美国的一项研究显示,晚期乳腺癌患者5 a生存率仅为27%[9]。既往乳腺癌被认为是低免疫原性的恶性肿瘤,随着乳腺癌免疫学研究的不断深入,有研究指出,乳腺癌具有较高的肿瘤突变负荷(tumor mutation burden,TMB),TMB越高产生的肿瘤相关抗原越多,作为免疫治疗的识别位点就越多[10]。有研究证实,部分乳腺癌高表达PD-L1,PD-L1在三阴性乳腺癌(triple-negative breast cancer,TNBC)中的阳性表达率约为20%,且与TNBC细胞恶性程度呈正相关[11]。亦有研究表明,TNBC和HER-2阳性乳腺癌肿瘤微环境中存在较多的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs),而PD-L1表达与TILs密度呈正相关[12]。随着越来越多的研究证实乳腺癌与免疫系统之间的关系,乳腺癌治疗也进入了免疫治疗阶段,其中免疫检查点抑制剂是研究较为广泛的一类药物,包括PD-1/PD-L1抑制剂和CTLA4抑制剂等。就目前临床试验结果而言,在乳腺癌患者中应用免疫检查点抑制剂治疗已取得了一定进展,表明利用免疫系统治疗乳腺癌的潜力。EMENS等[13]研究显示,与单药化学治疗组相比,阿特珠单抗联合白蛋白结合型紫杉醇可显著延长PD-L1阳性转移性TNBC患者的无进展生存期及中位生存期,但阿特珠单抗联合白蛋白结合紫杉醇治疗晚期TNBC患者的益处仅见于PD-L1阳性患者。CORTES等[14]研究结果显示,在PD-L1表达且联合阳性评分(combined positive score,CPS)≥10的TNBC患者中,帕博利珠单抗联合化学治疗组患者的中位无进展生存期和中位生存期均显著长于安慰剂联合化学治疗组。基于CORTES 等[14]的研究结果,欧洲药品管理局批准帕博利珠单抗与化学治疗联合用于表达PD-L1且CPS≥10的转移性或复发且不可切除的TNBC的一线治疗[15]。一项针对激素受体阳性、HER-2阴性的转移性乳腺癌的多中心Ⅱ期临床研究中,与艾瑞布林单独用药相比,帕博利珠单抗和艾瑞布林联合用药组的患者的无进展生存期、总生存期以及客观反映率并未得到改善[16]。因此,需要寻找新的免疫治疗靶点以改善疗效不佳、预后较差乳腺癌患者的治疗结局。
B7-H2是B7家族第4个成员,又称为可诱导共刺激分子配体,主要表达于B淋巴细胞、树突状细胞和巨噬细胞等抗原递呈细胞上,B7-H2的受体是诱导性共刺激分子(inducible costimulatory,ICOS),仅在活化的T淋巴细胞和记忆T细胞上表达[17]。既往研究表明,B7-H2/ICOS结合可促进CD8+T淋巴细胞增殖和γ-干扰素(interferon-γ,IFN-γ)的分泌,从而刺激T淋巴细胞介导的免疫反应,发挥抗肿瘤的作用[18]。但亦有报道证实,B7-H2和ICOS结合参与辅助型T细胞(help T cell,Th)的分化,对Th2增殖及相关细胞因子尤其是白细胞介素(interleukin,IL)-10的释放有显著促进作用[19]。对于高表达B7-H2的肿瘤细胞而言,其周围高浓度的Th2类细胞因子可能对肿瘤细胞的生长起到促进作用,这可能是肿瘤免疫逃逸的机制之一[20]。研究报道,B淋巴细胞上表达的B7-H2与ICOS结合后,既能诱导滤泡Th分泌IL-21,又能促进B细胞分化成浆细胞,进而产生免疫球蛋白,增强体液免疫[21]。有研究报道,B7-H2/ICOS途径可促进调节性T细胞增殖和IL-10的释放,进而发挥肿瘤免疫抑制作用[22]。因此,B7-H2通过与ICOS结合在肿瘤的发生和发展中发挥双重作用。目前,B7-H2在实体瘤中的研究有不少报道,但其对实体瘤的预后评估价值存在一定争议。KANG等[23]研究显示,B7-H2通过Janus激酶2/信号转导和转录激活因子3/锌指转录因子Slug信号通路诱导细胞上皮间质转化(epithelial mesenchymal transition,EMT)参与肝细胞癌的侵袭和转移。何桦波等[24]研究显示,血清中B7-H2在胆囊癌患者中异常高表达,并与胆囊癌患者的临床病理因素和生存密切相关,B7-H2高表达的患者生存率明显低于低表达的患者。WANG等[25]研究证实,B7-H2是乳腺癌不良预后的独立影响因素,但其表达水平与患者年龄、绝经状态、浸润深度、淋巴结转移等临床病理特征无显著相关性。但ZHANG等[26]研究显示, B7-H2高表达的鼻咽癌患者的总生存期和无病生存期显著延长;多因素分析结果显示,B7-H2高表达是鼻咽癌的一项独立预后因素。这种差异性可能与肿瘤类型、研究开始时间及研究方法不同有关。目前已有关于B7-H2在乳腺癌细胞中表达的研究,但关于乳腺癌患者血清中B7-H2的表达研究较少。本研究结果显示,乳腺癌患者血清中B7-H2表达水平显著高于对照组,提示其可能参与乳腺癌的发生发展。另外,本研究结果显示,乳腺癌患者血清中B7-H2表达水平与患者的年龄、肿瘤直径、TNM分期、病理类型、远处转移、淋巴结转移、ER、PR、HER-2无关,推测可能与乳腺癌高度异质性有关,也有可能与本研究入组患者例数较少有关,有待以后扩大样本量做进一步分析。
B7-H3又称为CD276,是一种Ⅰ型跨膜蛋白,主要在活化的T淋巴细胞、B淋巴细胞、单核细胞、树突状细胞上表达[27]。因为B7-H3的受体及下游信号传导通路尚未明确,所以,其在T淋巴细胞介导的肿瘤免疫应答中的作用机制一直存在争议。早期研究认为,B7-H3是一种共刺激分子,具有促进细胞毒性T淋巴细胞生成和选择性增强IFN-γ产生的能力[28]。随后研究发现,B7-H3可通过抑制T细胞增殖和减少IFN-γ、肿瘤坏死因子-α等细胞因子的分泌,导致肿瘤细胞发生免疫逃逸。有研究发现,B7-H3 在原发性乳腺癌中的表达与淋巴管侵袭有显著相关性,其机制可能是B7-H3通过调控EMT进程,参与细胞的增殖、迁移和侵袭[29]。B7-H3在乳腺癌的发生、发展及转移方面发挥重要作用,但目前的研究主要集中在B7-H3在乳腺癌组织中的表达,而关于其在血清中表达的相关研究甚少。有研究发现,乳腺癌患者血清中B7-H3表达量与TNM分期、淋巴结转移以及TILs水平有关[30]。本研究结果显示,乳腺癌患者血清中B7-H3表达水平高于对照组,与杜贞华等[31]的研究结果一致,提示血清中B7-H3 可能对机体免疫应答起抑制作用,通过促进肿瘤免疫逃逸导致乳腺癌的发生、发展。另外,本研究结果显示,乳腺癌患者血清中B7-H3水平与患者的TNM分期、远处转移、淋巴结转移有关;B7-H3在TNM分期Ⅰ、Ⅱ期患者血清中的表达水平低于Ⅲ、Ⅳ期患者,提示血清中高表达B7-H3患者往往预后不良;发生淋巴结转移的乳腺癌患者血清中B7-H3表达水平高于无淋巴结转移患者,发生远处转移的患者血清中B7-H3表达水平高于无远处转移的患者,说明随着癌症病情逐渐加重,B7-H3表达水平不断提高,提示B7-H3在血清中的表达水平可反映乳腺癌患者的恶性程度,可作为判断乳腺癌预后的一个指标。同时,本研究结果显示,乳腺癌患者血清中B7-H2与B7-H3表达水平呈正相关,提示B7-H2和B7-H3在肿瘤免疫应答中可能存在协同作用,但二者的相互作用有待于进一步研究。
本研究结果显示,B7-H2诊断乳腺癌的AUC为0.866,灵敏度为75.6%,特异度为96.0%;B7-H3诊断乳腺癌的AUC为0.895,灵敏度为 91.1%,特异度为84.0%;这一结果说明,血清中B7-H2、B7-H3诊断乳腺癌的AUC以及灵敏度和特异度均较高,二者均可协助诊断乳腺癌。本研究结果还显示,B7-H2 联合B7-H3诊断乳腺癌的AUC为 0.959,灵敏度为93.3%,特异度为88.0%;说明 B7-H2联合B7-H3检测能提高对乳腺癌的诊断效能,这对早期发现乳腺癌有较好的预警作用。
综上所述,乳腺癌患者血清中B7-H2、B7-H3表达水平与乳腺癌的发生、发展有关,其对肿瘤的免疫应答可能至关重要,有望成为免疫治疗的新靶点;且B7-H2、B7-H3对乳腺癌的诊断及预后判断有潜在的临床价值。但本研究的样本量相对较小,未对乳腺癌患者进行生存期随访,今后将继续收集病例并进行生存随访,以进一步阐明B7-H2、B7-H3在乳腺癌发生及进展中的作用。
