假木豆提取物对四氯化碳致大鼠肝纤维化的保护作用
2022-09-29周李煜林国彪
姚 平,周李煜,夏 星,林国彪
(1.广西中医药大学附属瑞康医院病理科,广西 南宁 530001;2.广西中医药大学药理学教研室,广西 南宁 530001)
肝纤维化是指在各种慢性肝病中,肝细胞发生持续、反复的坏死,导致机体发生修复反应,大量纤维增生,同时伴有纤维降解相对或绝对不足,细胞外基质(extracellular matrix,ECM)在肝内大量沉积,超过肝脏自身降解能力所发生的病变。多种因素导致的慢性肝病在发展过程中往往伴随肝纤维化的发生,活动性肝纤维化如不能得到有效控制,将最终发展为肝硬化,甚至肝癌[1-2]。大部分肝纤维化患者治疗后肝纤维化可逆转至正常[3]。因此,阻断肝纤维化的发生、发展将成为慢性肝病治疗的关键环节。目前,临床上用于治疗肝纤维化药物的疗效不十分理想,且药物价格昂贵、不良反应多。近几十年来,中医学对肝纤维化的研究累积了丰富的经验,应用中药防治肝纤维化具有费用低、不良反应少、疗效好等优势,具有广阔的应用前景。
假木豆又名假绿豆、白毛千斤拔、野蚂蝗,其味辛、甘,性寒,具有清热凉血、舒经活络、健脾利湿之功效,主治咽喉肿痛、内伤吐血、跌打损伤、骨折、风湿骨痛、瘫痪、泄泻、小儿疳积。假术豆主要分布于福建、广东、广西、海南、贵州、云南等地[4]。本课题组前期研究发现,假木豆对肝损伤有保护作用[5],但假木豆治疗肝纤维化的机制尚未见相关报道。水飞蓟素是从菊科植物水飞蓟中分离提取的一种黄酮类化合物,其在保肝抗炎方面的作用突出,基于此,本研究采用皮下注射四氯化碳(carbon tetrachloride,CC14)的方法制备大鼠肝纤维化模型,以水飞蓟素作为阳性对照观察假木豆水提物对大鼠肝纤维化的保护作用及相关机制。
1 材料与方法
1.1 实验动物清洁级Sprague Dawley(SD)大鼠60只,雌雄各半,体质量(200±20)g,购自广西医科大学实验动物中心,许可证号:SCXK桂2014-0002。
1.2 试剂与仪器水飞蓟素胶囊购自德国马博士大药厂(进口药品注册证号 H20181067)。CC14、无水乙醇购自天津市富宇精细化工有限公司,水合氯醛购自成都市科龙化工试剂厂,白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和转化生长因子-β1(transforming growth factor-β1,TGF-β1) 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自深圳欣博盛生物科技有限公司;电子天平购自赛多利斯科学仪器(北京)有限公司,离心机购自上海安亭科学仪器厂,Infinite M200酶标仪购自瑞士Tecan公司。
1.3 药物提取取假木豆叶(采集自广西南宁市高峰林场)以水提方式处理(分3次先后用8倍量水、5倍量水、3倍量水提取),合并提取液,浓缩成浸膏,每毫升相当于生药材6.22 g。低温储存,用时用纯水稀释。
1.4 实验方法
1.4.1 实验分组及干预措施取SD大鼠60只,雌雄各半,适应性饲养3 d后,按性别随机分为空白组、模型组、水飞蓟素组、低剂量假木豆组、中剂量假木豆组和高剂量假木豆组,每组10只。水飞蓟素组、低剂量假木豆组、中剂量假木豆组、高剂量假木豆组和模型组大鼠参照文献[6]制备肝纤维化模型,具体方法为:第1周背部皮下注射含体积分数40%CC14的花生油溶液5 mL·kg-1,第2~8周背部皮下注射含体积分数40%CC14的花生油3 mL·kg-1,每隔2 d注射1次。空白组大鼠背部皮下注射花生油,方法同上述各组。第1~8周,以体积分数5%乙醇作为大鼠唯一饮水。从第3周起,水飞蓟素组大鼠每日灌服水飞蓟素胶囊水溶液(50 mg·kg-1)1次;低、中、高剂量假木豆组大鼠每日灌服12.5、25.0、50.0 g·L-1的假木豆水提液(20 mL·kg-1);空白组和模型组大鼠灌服等体积的蒸馏水;各组大鼠均连续给药6周。
1.4.2 各组大鼠一般状况观察实验期间观察并记录各组大鼠饮食活动情况、体质量、毛色光亮程度、精神状况等一般情况。
1.4.3 ELISA法检测各组大鼠血清中IL-1β、IL-6、TNF-α、TGF-β1水平末次给药1 h后,各组大鼠腹腔注射100 g·L-1水合氯醛溶液(3 mL·kg-1)进行麻醉,采集大鼠腹主动脉血5 mL,室温下静置 2 h,3 000 r·min-1离心10 min,收集血清,采用ELISA法检测各组大鼠血清中IL-1β、IL-6、TNF-α和TGF-β1水平,严格按照试剂盒说明书进行操作。
1.4.4 各组大鼠肝脏大体形态及病理组织学形态观察采血后处死大鼠,取肝脏观察大体形态;然后取大鼠肝脏左叶,于体积分数10%甲醛溶液中固定24 h 以上,然后制备肝组织切片,苏木精-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察并拍照,观察大鼠肝脏病理形态学变化。

2 结果
2.1 6组大鼠一般情况比较空白组大鼠饮食正常,活动频繁,毛色洁白有光泽,精神状况正常。模型组大鼠饮食减少,活动量明显减少,毛色暗淡、不清洁,精神状况萎靡;水飞蓟素组大鼠饮食正常,活动正常,毛色欠缺光泽但较清洁,精神状况较好;各剂量假木豆组大鼠饮食略有减少,活动量一般,皮毛较暗淡,略发黄,精神状况尚可,总体情况较模型组佳而比空白组差。 模型组、水飞蓟素组、低剂量假木豆组、中剂量假木豆组、高剂量假木豆组大鼠体质量增长量少于空白组,差异有统计学意义(P<0.05);低剂量假木豆组大鼠体质量增长少于模型组,差异有统计学意义(P<0.05)(表1)。

表1 6组大鼠体质量增长量比较
2.2 6组大鼠血清中IL-1β、IL-6、TNF-α、TGF-β1水平比较结果见表2。模型组、水飞蓟素组、低剂量假木豆组、中剂量假木豆组、高剂量假木豆组大鼠血清中IL-1β、IL-6、TNF-α水平均高于空白组,差异有统计学意义(P<0.05);水飞蓟素组与空白组大鼠血清中TGF-β1水平比较差异无统计学意义(P>0.05);模型组、低剂量假木豆组、中剂量假木豆组、高剂量假木豆组大鼠血清中TGF-β1水平均高于空白组,差异有统计学意义(P<0.05)。水飞蓟素组、低剂量假木豆组、中剂量假木豆组、高剂量假木豆组大鼠血清中IL-1β、IL-6、TNF-α、TGF-β1水平均低于模型组,差异有统计学意义(P<0.05)。低剂量假木豆组大鼠血清中IL-1β、IL-6、TNF-α、TGF-β1水平显著高于水飞蓟素组,差异有统计学意义(P<0.05)。 中剂量假木豆组与水飞蓟素组大鼠血清中IL-1β、IL-6水平比较差异无统计学意义(P>0.05),中剂量假木豆组大鼠血清中TNF-α、TGF-β1水平显著高于水飞蓟素组,差异有统计学意义(P<0.05);高剂量假木豆组与水飞蓟素组大鼠血清中IL-1β、IL-6、TNF-α、TGF-β1水平比较差异无统计学意义(P>0.05)。低、中、高剂量假木豆组大鼠血清中IL-1β水平比较差异均无统计学意义(P>0.05)。高剂量假木豆组大鼠血清中IL-6、TGF-β1水平显著低于低剂量假木豆组,差异有统计学意义(P<0.05);中剂量假木豆组与低剂量假木豆组、高剂量假木豆组与中剂量假木豆组大鼠血清中IL-6、TGF-β1水平比较差异均无统计学意义(P>0.05)。低、中、高剂量假木豆组大鼠血清中TNF-α水平两两比较差异均有统计学意义(P<0.05)。

表2 6组大鼠血清中IL-1β、IL-6、TNF-α、TGF-β1水平比较
2.3 各组大鼠肝脏大体形态空白组大鼠肝脏颜色鲜红,形状楔形,肝脏边缘整齐,表面光滑平整。模型组大鼠肝脏颜色晦暗,肝脏表面布有密集的小孔,凹凸不平,有较为严重的肿大或萎缩。水飞蓟素组及各剂量假木豆组大鼠肝脏颜色较为暗淡,表面稍粗糙、布有较多小孔,肝脏变形情况较模型组轻。
2.4 各组大鼠肝组织病理学形态结果见图1。空白组大鼠肝组织结构完整,肝小叶结构正常,未见有肝细胞水肿及脂肪变。模型组大鼠肝组织肝纤维化明显,可见严重的肝细胞水肿、脂肪变性以及明显的假小叶形成。水飞蓟素组大鼠肝组织可见较为严重的肝细胞水肿、脂肪变性,未见纤维化,也未见假小叶形成。低剂量假木豆组大鼠肝组织可见严重肝细胞水肿和脂肪变性,肝组织中可见较薄的纤维结缔组织增生,部分分隔肝小叶,有少量假小叶形成。中剂量假木豆组大鼠肝组织中可见严重肝细胞水肿、脂肪变性,有少量肝纤维形成,未见假小叶形成。高剂量假木豆组大鼠肝组织中可见较为严重的肝细胞水肿及脂肪变性,肝纤维化情况轻微,未见有假小叶形成。水飞蓟素组和假木豆中、高剂量组大鼠肝组织病理学形态较模型组有较大的改善,肝纤维形成减轻或消失,没有假小叶形成;低剂量假木豆组大鼠肝组织病理学形态较模型组有轻微改善但不明显。各组大鼠肝细胞水肿、脂肪变性均未得到明显改善。
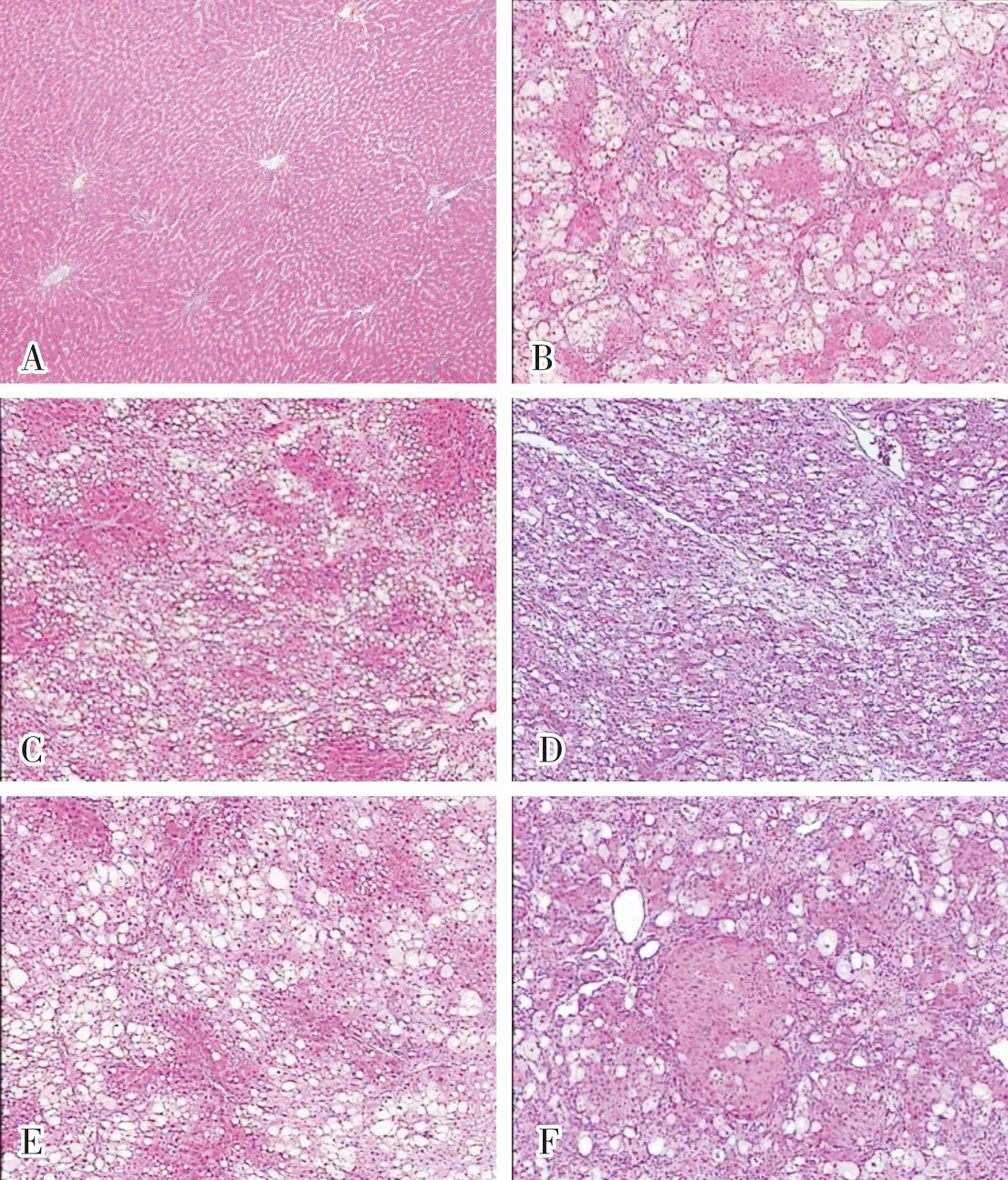
A:空白组;B:模型组;C:水飞蓟素组;D:高剂量假木豆组;E:中剂量假木豆组;F:低剂量假木豆组。
3 讨论
肝纤维化是由多种原因引起的慢性肝损害所致的病理改变,是多种慢性肝病共有的病理变化。肝纤维化是一个动态发展过程,随着纤维化程度的加深,可发展为肝硬化,甚至肝癌。肝纤维化是一种损伤愈合反应,其发生是肝脏中ECM增生和降解失衡,造成肝脏内纤维结缔组织异常沉积、肝脏结构和功能改变的结果[7-8]。有研究认为,肝纤维化是一个可逆的过程,阻断肝纤维化是一个有前景的针对肝脏相关疾病的治疗手段[9]。目前临床上尚无有效治疗肝纤维化的药物,故开发治疗肝纤维化的药物仍是新药研发的热点[1],而中药因其低毒性及全局性效果受到广泛关注[10-12]。
IL属于细胞因子家族,是重要的炎症介质和免疫调节因子,可以调节肝脏炎症及免疫功能,从而影响肝纤维化的发生、发展。IL-1β、IL-6、IL-8具有明确的促肝纤维化作用,IL-2、IL-10具有抗肝纤维化作用。肝纤维化发生时,肝脏细胞中IL-1β的表达增加,IL-1β可刺激肝脏发生炎症反应,进一步促进肝纤维化的发展[13-14]。IL-6参与肝纤维化的多种病理过程,被认为是肝星状细胞(hepatic stellate cell,HSC)活化的标志[15-16]。TNF是一种与内毒素无关的、可引起肿瘤出血坏死的活性分子[17]。正常情况下,肝组织中不表达或微量表达TNF-α,当受到损伤因素刺激时,大量的TNF-α被释放出来,参与肝损伤过程,促进肝纤维化的发生、发展[18-19]。有研究显示,血清中TNF-α水平随患者肝纤维化程度的加重而升高,且与血清中的某些肝纤维化因子水平呈正相关[20],说明TNF-α不仅介导炎症反应,还参与了肝纤维化的形成过程,与肝纤维化密切相关。TGF-β1是细胞因子TGF-β超家族的成员,对细胞的生长、分化和多种生理、病理过程起重要调节作用,在肝纤维化的发生、发展过程中起着关键作用[21]。其通过活化HSC、促进ECM的合成与沉积而致肝纤维化,是肝纤维化重要的始动因子之一。 本研究结果显示,与空白组相比,模型组大鼠血清中IL-1β、IL-6、TNF-α和TGF-β1水平显著升高,且病理组织学显示模型组大鼠肝脏损伤严重,有明显的纤维化特征,说明 CCl4诱导的肝纤维化模型制备成功。本研究发现,与模型组比较,假木豆高、中剂量组大鼠血清中IL-1β、IL-6、TNF-α和TGF-β1水平显著降低;低剂量假木豆组大鼠血清中IL-6、TNF-α和TGF-β1水平显著降低,IL-1β水平无明显变化。该结果提示假木豆提取物对大鼠肝纤维化有保护作用,其作用机制可能与降低血清中IL-1β、IL-6、TNF-α及TGF-β1水平有关。高剂量假木豆组与水飞蓟素组大鼠血清中IL-1β、IL-6、TNF-α和TGF-β1比较差异无统计学意义,说明高剂量假木豆对肝纤维化大鼠血清中IL-1β、IL-6、TNF-α和TGF-β1的作用与水飞蓟素相当。不同剂量假木豆组大鼠血清中IL-1β、IL-6、TNF-α及TGF-β1水平随假木豆水提物剂量的升高呈下降趋势,但只有血清中TNF-α水平在3个剂量组之间比较差异有统计学意义,而血清中IL-1β水平在3个剂量组之间比较差异无统计学意义。因此,假木豆提取物与上述各指标的量效关系需进一步研究来验证。
综上所述,假木豆提取物具有抗肝纤维化作用,其作用机制可能与降低血清中IL-1β、IL-6、TNF-α及TGF-β1水平有关。
