明赶饮对急性酒精中毒模型大鼠解酒保肝作用及其机制研究
2022-09-28黄项鸣樊欣钰张梦秋
黄项鸣 陆 敏 樊欣钰 张梦秋
(1.南京中医药大学附属中西医结合医院,江苏南京210028;2.南京市栖霞区西岗社区医院,江苏南京210033)
急性酒精中毒(acute alcohol intoxication,AAI)是因机体短时间内摄入大量酒精导致酒精代谢中的有害物质如乙醛堆积而发生[1],表现为行为意识异常、上腹部不适、恶心呕吐、心率增高等症状乃至危象。酒精导致的疾病、死亡是全球性重大公共卫生健康问题之一,而中国是因酒精问题致死人数最多的国家[2],防治酒精致病值得全社会高度关注。自古以来,中药在解酒、治酒病方面有明确的疗效记载[3]。现代药理学研究表明,部分中药单味药、复方、制剂不仅可缓解酒后症状,亦可调理长期过量饮酒导致的慢性肝脏疾病[4-6],具有预防、改善症状等作用,且简便廉验、副作用小。明赶饮由全国名老中医王德明教授验方“决明方”化裁而来[7-8],由陈皮、决明子、牡蛎等“药食同源”之品配伍而成。临床发现,饮酒前服用明赶饮对酒后不适症状有明显缓解作用。本研究制作AAI模型大鼠,观察明赶饮对AAI模型大鼠的解酒、保肝作用,并探索其作用机制,为明赶饮解酒保肝制剂的开发提供实验依据。
1 实验材料
1.1 实验动物 健康SPF级雄性Sprague-Dawley(SD)大鼠60只,体重180~200 g,由常州卡文斯实验动物有限公司提供,动物使用许可证号:SCXK(苏)2016-0010。动物饲养于(22±2)℃的环境中,相对湿度为50%~60%,昼夜各12 h循环,每笼3只饲养,自由摄食饮水。本实验经南京中医药大学附属中西医结合医院伦理委员会审查批准。
1.2 药物与试剂 明赶饮为中国中医科学院江苏分院南院协定方,处方由决明子15 g、牡蛎30 g、陈皮9 g、荷叶10 g、生甘草6 g等药物组成,煎煮3次,合并滤液浓缩至中药浓度为0.76 g/mL。牡蛎大豆肽肉碱口服液(含多肽900 mg、牛磺酸50 mg、左旋肉碱60 mg等成分,国食健注G20110347,批号:20220111284,以下简称牡蛎大豆肽肉碱),浓缩至浓度为0.0101 g/mL,购自深圳市海王健康科技发展有限公司。浓度为95%的食用酒精(使用时稀释至50%)、0.9%氯化钠注射液(批号:H33021037)购自浙江莎普爱思药业股份有限公司;95%乙醇(批号:10009164)、叔丁醇(批号:40084062)购自国药集团化学试剂上海有限公司;异氟烷(批号:R510-22)购自深圳市瑞沃德生命科技有限公司;苏木精-伊红(HE)染色液(批号:KGA224)购自江苏凯基生物技术股份有限公司;谷草转氨酶(AST)试剂盒(批号:C010-2-1)、谷丙转氨酶(ALT)试剂盒(批号:C009-2-1)、总胆红素(TBil)试剂盒(批号:C019-1-1)、直接胆红素(DBil)试剂盒(批号:C019-2-1)、乙醇脱氢酶(ADH)试剂盒(批号:A083-2-1)购自南京建成生物工程研究所。
1.3 主要仪器 Millipore公司Direct-Q with pump型超纯水仪;苏州净化设备有限公司SW-CJ-2FD型超净化工作台;BeckMan公司Allegra X-15R、Microfuge 20R离心机;北京塞多利斯仪器系统有限公司BS224型电子天平;上海博迅实业医疗设备厂YXQ-LS-50SⅡ型立式压力蒸汽灭菌器;北京众实迪创科技发展有限责任公司ZS-MV-Ⅳ型小动物麻醉机;BeckMan公司DU730紫外分光光度计;Berthold公司LB941微孔板式多功能酶标仪;岛津中国有限公司GC2010 pro气相色谱仪。
2 实验方法
2.1 分组、造模与给药 将60只SD大鼠适应性饲养1周后随机分为空白组、模型组、阳性对照组和明赶饮高、低剂量组,每组12只。适应性饲养结束后,禁食12 h。空白组、模型组予等量生理盐水灌胃,阳性对照组、明赶饮高剂量组、明赶饮低剂量组分别灌胃给予牡蛎大豆肽肉碱浓缩液0.101 g/kg或明赶饮水煎剂浓缩液7.6 g/kg、3.8 g/kg。第1次灌胃结束30 min后,空白组予生理盐水灌胃,其余各组采用一次灌胃过量酒精的方式建立大鼠AAI模型[9-11],予50%食用酒精溶液15 mL/kg灌胃。
2.2 观察指标
2.2.1 一般情况 观察各组大鼠药物灌胃前后有无死亡,外观、行为活动、粪便、食量等有无明显异常;观察酒精灌胃后各组大鼠有无出现死亡、兴奋狂躁、共济失调、活动减少、嗜睡等表现。
2.2.2 翻正反射试验 第2次灌胃后,除空白组外,其余各组大鼠各取6只进行试验。以背部朝下姿势置于笼内,每5 s纠正其姿势使背部朝下,直到大鼠不能立刻自行纠正为止[12]。当大鼠保持30 s无法自主翻转,即可认为翻正反射消失(醉酒);当大鼠又可自行翻转,则认为翻正反射恢复(醒酒),超过12 h未醒者按12 h记录。逐一统计大鼠灌酒后的醉酒潜伏期(自灌酒至翻正反射消失的时间)、睡眠时间(自翻正反射消失至恢复的时间)、醒酒时间(自灌酒至翻正反射恢复的时间)。
2.2.3 血乙醇浓度及动力学参数 取各组另6只大鼠(空白组随机取6只大鼠)进行血乙醇浓度检测。大鼠于第2次灌胃后0.5、1.0、1.5、2.0、3.0、5.0 h在浅麻醉状态下经尾静脉取血,采用顶真空气相色谱法测定大鼠不同时间点的血乙醇浓度,并获得血乙醇动力学参数:达峰时间、达峰浓度和血乙醇浓度-时间曲线下面积。
2.2.4 血清AST、ALT、TBil、DBil含量 所有大鼠第2次灌胃后12 h,即完成上述试验或检测后,用4%水合氯醛按10 mL/kg腹腔注射,麻醉后腹主动脉取血5 mL,常温下静置血样15 min,4 ℃、400×g离心10 min,取血清,检测AST、ALT、TBil、DBil含量。
2.2.5 肝组织ADH活性 麻醉后取大鼠肝脏组织,置于10%甲醛、戊二醛溶液于-80 ℃冰箱中保存备用。检测时剪碎组织,加入9倍体积生理盐水,冰水浴制备匀浆,4 ℃、12 000×g离心15 min,取上清,根据试剂盒说明书检测样本中ADH活性。
2.2.6 肝脏组织病理形态观察及病理学评分 取大鼠肝组织制备石蜡切片,置于电热恒温干燥箱中,60 ℃烘烤2 h;对干燥的石蜡切片进行二甲苯脱蜡,下行梯度乙醇水化,蒸馏水洗;使用苏木素染色2 min,盐酸酒精分化数秒,水洗返蓝;使用伊红染液染片1 min,水洗冲掉残留染液;切片经梯度酒精脱水干燥、二甲苯透明、中性树胶封片;使用相差显微镜于400倍视野下随机选择一个视野观察并拍照。结合朔伊尔分级评分系统[13],使用以下标准对肝组织进行病理学评分:0分,无炎症或轻微门静脉炎症;1分,门静脉炎症无坏死/小叶炎症无坏死;2分,轻度局限性板状坏死/轻度局灶性小叶坏死;3分,中度局限性板状坏死/中度局灶性小叶坏死;4分,重度局限性板状坏死/桥接坏死。
2.3 统计学方法 用graphpad Prism 9对数据进行分析。符合正态分布的计量资料数据以(±s)表示,2组间数值比较采用 t 检验,多组间比较采用单因素方差分析(one-way ANOVA)。P<0.05表示差异具有统计学意义。
3 实验结果
3.1 各组大鼠一般情况比较 第1次灌胃前后,各组大鼠无死亡,外观、行为活动、粪便、食量等均未见明显异常。第2次灌胃后,除空白组外,其余各组大鼠均出现明显醉酒表现,多表现为兴奋狂躁、共济失调,随后出现活动减少、昏睡等。所有大鼠观察期间内均未出现死亡。各给药组大鼠酒后精神状态、活动能力均较模型组明显改善,明赶饮高剂量组大鼠嗜睡状态明显轻于阳性对照组。
3.2 各组大鼠翻正反射试验结果比较 与模型组比较,阳性对照组和明赶饮高剂量组大鼠醉酒潜伏期明显延长(P<0.05,P<0.01),各给药组睡眠时间、醒酒时间显著缩短(P<0.01);与阳性对照组比较,明赶饮高剂量组大鼠睡眠时间、醒酒时间显著缩短(P<0.05);明赶饮高剂量对AAI模型大鼠翻正反射试验各指标的改善均显著优于低剂量(P<0.01)。详见表1。
表1 各组大鼠翻正反射试验结果比较(±s)
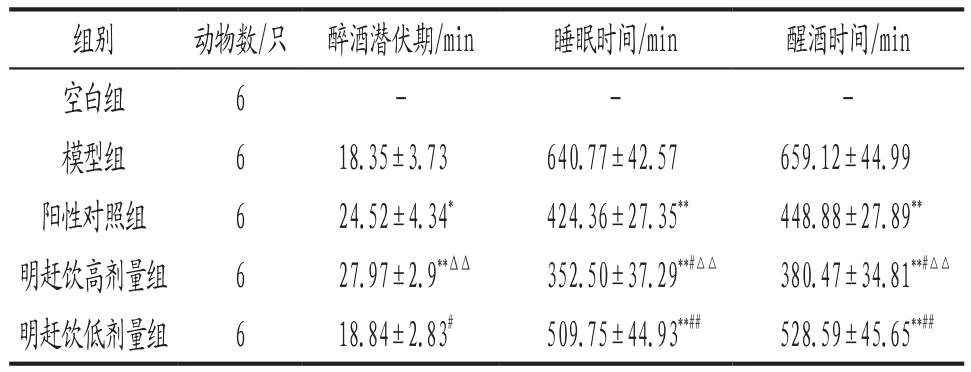
表1 各组大鼠翻正反射试验结果比较(±s)
注: 与模型组比较,*P<0.05,**P<0.01;与阳性对照组比较,#P<0.05,##P<0.01;与明赶饮低剂量组比较,△△P<0.01。
组别 动物数/只 醉酒潜伏期/min 睡眠时间/min 醒酒时间/min空白组 6 - - -模型组 6 18.35±3.73 640.77±42.57 659.12±44.99阳性对照组 6 24.52±4.34* 424.36±27.35** 448.88±27.89**明赶饮高剂量组 6 27.97±2.9**ΔΔ 352.50±37.29**#△△ 380.47±34.81**#△△明赶饮低剂量组 6 18.84±2.83# 509.75±44.93**## 528.59±45.65**##
3.3 各组大鼠血乙醇浓度及动力学参数比较 灌胃50%食用酒精后0.5 h,明赶饮高剂量组大鼠血乙醇浓度明显低于模型组(P<0.05);灌胃50%食用酒精后1.0、1.5、2.0、3.0、5.0 h,各给药组大鼠血乙醇浓度明显低于模型组(P<0.01)。与阳性对照组比较,灌胃50%食用酒精后5.0 h,明赶饮高剂量组大鼠血乙醇浓度明显降低(P<0.01)。灌胃50%食用酒精后1.5、2.0、3.0、5.0 h,明赶饮高剂量组大鼠血乙醇浓度明显低于低剂量组(P<0.01)。详见表2。与模型组比较,各给药组大鼠的血乙醇浓度达峰时间均有所缩短,而达峰浓度、血乙醇浓度-时间曲线下面积均显著降低(P<0.01);其中明赶饮高剂量组达峰浓度显著低于低剂量组(P<0.01),血乙醇浓度-时间曲线下面积明显低于阳性对照组和明赶饮低剂量组(P<0.01)。详见图1、表3。
表2 各组大鼠灌胃50%食用酒精后不同时间血乙醇浓度比较(±s) 单位:mg/dL

表2 各组大鼠灌胃50%食用酒精后不同时间血乙醇浓度比较(±s) 单位:mg/dL
注:与模型组比较,*P<0.05,**P<0.01;与阳性对照组比较,##P<0.01;与明赶饮低剂量组比较,△△P<0.01。
组别 动物数/只灌胃50%食用酒精后0.5 h 1.0 h 1.5 h 2.0 h 3.0 h 5.0 h空白组 6 - - - - - -模型组 6 233.87±30.42 313.54±20.93 327.37±21.67 318.21±22.76 251.42±20.51 184.08±22.75阳性对照组 6 206.59±25.69 234.45±27.17** 223.48±28.25** 194.82±19.69** 155.26±19.46** 88.07±14.77**明赶饮高剂量组 6 190.73±19.77* 216.08±21.52** 200.41±29.26**△△ 164.54±17.07**△△ 136.48±10.87**△△ 55.02±7.13**##△△明赶饮低剂量组 6 225.64±29.73 253.39±32.94** 277.45±17.21**## 256.67±20.61**## 192.65±18.90**## 107.89±9.46**
表3 各组大鼠血乙醇动力学参数比较(±s)
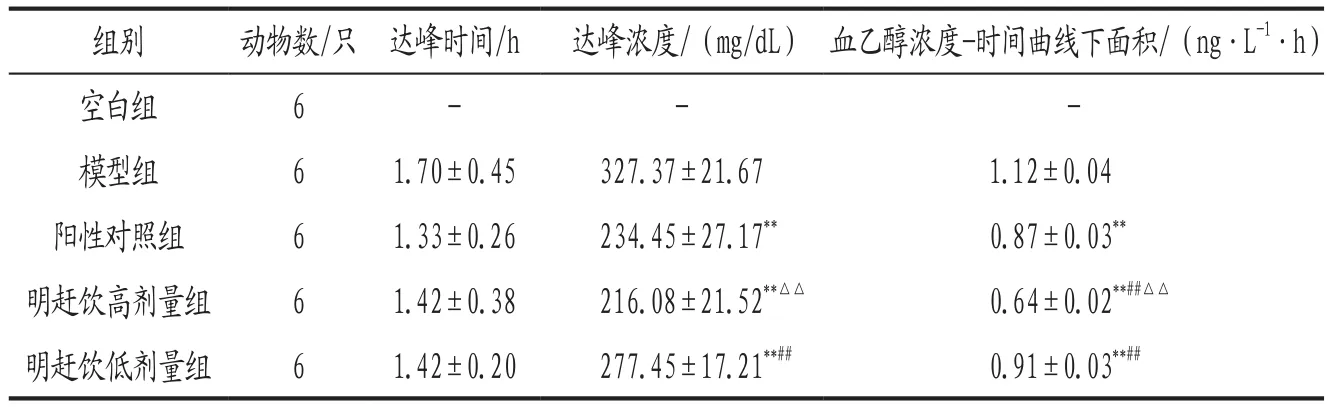
表3 各组大鼠血乙醇动力学参数比较(±s)
注: 与模型组比较,**P<0.01;与阳性对照组比较,##P<0.01;与明赶饮低剂量组比较,△△P<0.01。
组别 动物数/只 达峰时间/h 达峰浓度/(mg/dL) 血乙醇浓度-时间曲线下面积/(ng·L-1·h)空白组 6 - - -模型组 6 1.70±0.45 327.37±21.67 1.12±0.04阳性对照组 6 1.33±0.26 234.45±27.17** 0.87±0.03**明赶饮高剂量组 6 1.42±0.38 216.08±21.52**△△ 0.64±0.02**##△△明赶饮低剂量组 6 1.42±0.20 277.45±17.21**## 0.91±0.03**##

图1 各组大鼠血乙醇浓度与时间曲线(n=6)
3.4 各组大鼠肝功能指标及肝脏ADH活性比较 与空白组比较,模型组大鼠血清AST、ALT、TBil、DBil等肝功能指标含量及肝脏ADH活性均显著升高(P<0.01,P<0.05)。与模型组比较,各给药组大鼠上述指标均显著降低(P<0.01,P<0.05),ADH活性均显著升高(P<0.01);其中明赶饮高剂量组大鼠肝功能指标显著低于阳性对照组和明赶饮低剂量组(P<0.05,P<0.01),ADH活性明显高于阳性对照组和明赶饮低剂量组(P<0.01)。详见表4。
表4 各组大鼠肝功能指标含量及肝脏ADH活性比较(±s)
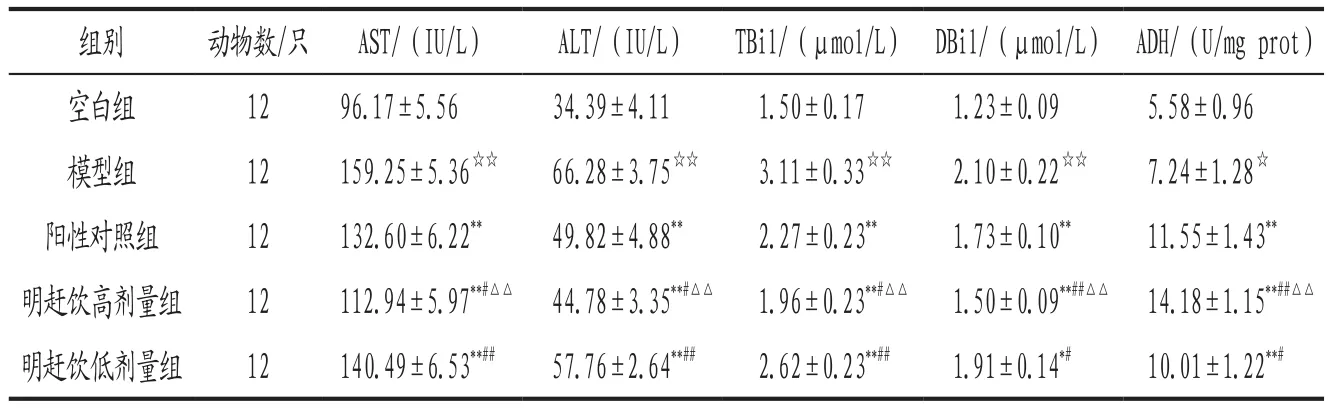
表4 各组大鼠肝功能指标含量及肝脏ADH活性比较(±s)
注: 与空白组比较,☆P<0.05,☆☆P<0.01;与模型组比较,*P<0.05,**P<0.01;与阳性对照组比较,#P<0.05,##P<0.01;与明赶饮低剂量组比较,△△P<0.01。
组别 动物数/只 AST/(IU/L) ALT/(IU/L) TBil/(μmol/L) DBil/(μmol/L) ADH/(U/mg prot)空白组 12 96.17±5.56 34.39±4.11 1.50±0.17 1.23±0.09 5.58±0.96模型组 12 159.25±5.36☆☆ 66.28±3.75☆☆ 3.11±0.33☆☆ 2.10±0.22☆☆ 7.24±1.28☆阳性对照组 12 132.60±6.22** 49.82±4.88** 2.27±0.23** 1.73±0.10** 11.55±1.43**明赶饮高剂量组 12 112.94±5.97**#△△ 44.78±3.35**#△△ 1.96±0.23**#△△ 1.50±0.09**##△△ 14.18±1.15**##△△明赶饮低剂量组 12 140.49±6.53**## 57.76±2.64**## 2.62±0.23**## 1.91±0.14*# 10.01±1.22**#
3.5 各组大鼠肝组织形态及病理学评分比较 病理图片显示,空白组大鼠肝脏组织形态正常(图2-a);模型组大鼠肝脏组织出现明显炎性浸润、细胞水肿和脂肪浸润(图2-b);与模型组比较,阳性对照组(图2-c)、明赶饮高剂量组(图2-d)、明赶饮低剂量组(图2-e)大鼠肝组织病理情况明显改善。各组大鼠肝组织病理学评分比较见表5。
表5 各组大鼠肝组织病理学评分比较(±s)

表5 各组大鼠肝组织病理学评分比较(±s)
注: 与空白组比较,☆☆P<0.01;与模型组比较,**P<0.01;与阳性对照组比较,##P<0.01;与明赶饮低剂量组比较,△△P<0.01。
组别 动物数/只 肝组织病理学评分/分空白组 12 0模型组 12 3.58±0.51☆☆阳性对照组 12 1.75±0.62**明赶饮高剂量组 12 1.17±0.72**△△明赶饮低剂量组 12 2.58±0.51**##

图2 各组大鼠肝组织病理形态比较(HE,×400)
4 讨论
肝脏是酒精代谢的重要器官,90%~98%的酒精通过肝脏氧化完成,其中最重要的途径为ADH将酒精氧化为乙醛,乙醛再通过乙醛脱氢酶氧化为乙酸[14]。西医治疗AAI患者常使用促酒精代谢药物加速乙醛、酮体排泄,以及使用促醒药物、镇静剂、胃黏膜保护剂、血液净化疗法、(误吸后)抗生素抗感染、维持水电解质平衡、纠正血糖、(脑水肿)予脱水剂等对症支持治疗[1],但对AAI的预防没有良好措施。中药葛根、葛花、甘草等单味药,葛花解酲汤等经方,对预防醉酒有明确疗效记载[3],其解酒作用已被现代药理学实验证实[4-6,10-11]。本研究所使用的明赶饮方中陈皮为君,理气健脾和胃;臣以决明子平抑肝阳、清肝明目,牡蛎软坚散结,化胸胁痞积;佐以荷叶升清化湿和胃,赶黄草利尿醒酒;生甘草为使调和诸药。
本实验根据BRANDONWARNER E[9]对啮齿动物模型的研究,选取大鼠(无呕吐反射)制作AAI模型。参考对AAI大鼠动物模型、中药治疗AAI模型大鼠的研究[10-11],本研究亦采用一次性灌胃过量酒精的方式建立大鼠AAI模型。在阳性对照药的选择上,选用同类研究较多的海王金樽(牡蛎大豆肽肉碱口服液)[15-16],其主要成分为多肽、牛磺酸、左旋肉碱[17-18],其中多肽成分可有效抗氧化提高肝组织ADH活性并降低丙二醛水平,对化学性肝损伤有一定保护作用[19]。提前30 min药物干预、50%食用酒精的实验设计,意在模拟人类饮酒规律、用药习惯,使得实验更具参考价值。在本研究检测指标方面,行为学实验(翻正反射)可直接反映药物干预对酒后不适症状的缓解程度;不同时间段的血乙醇浓度检测可动态观察乙醇在血液中的浓度变化,ADH活性可直接反映乙醇代谢效率,对监测乙醇在生物体内代谢情况均有重要意义;肝细胞凋亡是过度饮酒后酒精性肝损伤的主要病理特征[4-6],AST、ALT、TBil、DBil等肝功能指标可评价肝脏的损害程度,有效证明药物对酒后肝损害的保护作用。
本研究结果表明,饮酒前使用明赶饮可使大鼠延迟进入醉酒状态,更快从醉酒状态清醒,从而显著缩短醉酒时间;可于醉酒后显著降低血乙醇浓度,其中高剂量明赶饮在饮酒初期即可发挥良好的降低血乙醇浓度的功效;可显著改善酒精对大鼠肝细胞的损害,对急性酒精中毒大鼠肝功能有显著保护作用;可显著提高AAI模型大鼠ADH活性,以高效降低血乙醇浓度,从而改善醉酒状态,加快醒酒,保护肝功能。高剂量明赶饮对本研究指标的改善普遍优于阳性药物和明赶饮低剂量,明赶饮高剂量为临床常规剂量,佐证了临床用药的有效性。
综上,明赶饮对预防、缓解急性酒精中毒有明确疗效,具有解酒、保肝作用,其可能的机制为提高ADH活性。后续动物实验可以从酒精性脂肪肝、酒精性肝炎方面继续研究明赶饮对酒精致病类模型动物客观指标的改善作用,可利用质谱组学技术研究明赶饮的主要成分和物质基础,深入探讨其对模型动物治疗作用的潜在分子机制,进而为明赶饮的临床使用提供客观的科学依据。“药食同源”明赶饮制剂的开发符合当前公共卫生问题需求,是“治未病”理论创新成果转化的成功实践,值得进一步研究及推广。
