梅毒螺旋体TP17 蛋白B 细胞表位研究
2022-09-28刘晶晶陈玉梅潘卫东
刘晶晶,陈玉梅,潘卫东
(1.郑州大学基础医学院,郑州 450001;2.西华县人民医院检验科,周口 466000;3.郑州大学生命科学学院,郑州 450001)
TP 基因组全长1 138 006 bp,含1 041 个开放阅读框,毒力因子包括12 个膜蛋白家族和一些溶血素[6]。膜蛋白是TP 的主要抗原蛋白,对TP 的免疫学诊断和疫苗研究具有重要意义,主要包括TP47(TP0574)、TP15(TP0171)、TP17(TP0435)、TP34(TP0971)及GlpQ(TP0257)等[7]。TP47(TP0574)是第一个被证明是脂质修饰的TP 膜蛋白,是一种青霉素结合蛋白[8]。TP17 蛋白位于TP 细胞外膜,是一种分子量为16.5 kD 的膜脂蛋白,约占TP 可溶性蛋白的2%,具有较强的免疫原性[9-10]。有研究显示,以TP17蛋白为抗原的免疫学诊断试剂敏感性可以达到98%,特异性达到99%,在梅毒感染的血清学诊断中具有重要的价值[11-12]。TP17 蛋白是梅毒的主要抗原蛋白,关于TP17 蛋白抗原表位的研究报道较少,确定TP17 蛋白B 细胞表位,对TP 的免疫学诊断和疫苗设计具有重要意义。本研究提出通过生物信息学技术对TP17 蛋白的结构、免疫学特征和B 细胞表位等进行预测,建立TP17 多肽的酶联免疫吸附实验(ELISA)检测法,评价多肽与临床TP 阳性血清的反应性,验证TP17 蛋白抗原B 细胞表位预测的准确性及表位多肽用于梅毒临床检验的可行性。
1 材料和方法
1.1 实验材料 梅毒阳性病例血清样品10 份(西华县人民医院),梅毒螺旋体抗体诊断试剂盒-酶联免疫法(厦门英科新创公司),重组TP17 蛋白(中国近岸生物公司),TP17 多肽(委托上海生工公司合成),HRP 标记的羊抗人IgG(英国Abcam 公司),BCA 蛋白浓度测定试剂盒(美国Thermo 公司)。
1.2 实验方法
1.2.1 TP17 蛋白生物学特征分析 从美国国家生物信息中心(National Center for Biotechnology Information,NCBI)蛋白质数据库中获得TP17 蛋白的氨基酸序列(Genebank No.ADR64315.1),以SignalP-5.0 及TMHMM Server v.2.0 软件预测蛋白信号肽及跨膜区氨基酸序列;利用NetNGlyc-1.0、NetOGlyc 4.0 预测TP17 蛋白N 型和O 型糖基化位点;利用ExPASy 数据库预测蛋白分子量和等电点,见表1。
1.2.2 TP17 蛋白线性 B 细胞表位预测用DNASTAR 的Protean 软件及在线预测软件SOPMA 预测TP17 蛋白的二级结构(Secondary structure),分析α螺旋、β 折叠、转角及无规卷曲等二级结构元件的分布情况[13-14]。综合利用IEDB 数据库B 细胞表位相关分析软件(BepiPred-2.0、BepiPred 等)、SOPMA 以及DNASTAR 等软件对TP17 蛋白进行系统性分析,预测其抗原性(antigenicity)、表面可及性(accessibility)、可塑性(flexibility)、亲水性(hydrophilicity)等特征,预测线性B 细胞表位[15-16]。采用SWISS-MODEL同源建模分析TP17 蛋白的三维结构及B 细胞表位在三维结构中的定位,结合IEDB 数据库Disco-Tope:Structure-based Antibody Prediction 软件分析TP17 蛋白的构象型B 细胞表位[17],见表1。

表1 生物信息学数据库及分析工具Tab 1 Bioinformatics database and analysis tools
1.2.3 TP17 重叠多肽的分段合成 将TP17 蛋白分成6 段(Tp17-1~Tp17-6),临近两条多肽之间设置10 个氨基酸的重复(表2)。委托上海生工公司合成多肽小分子并进行HPLC-MS 鉴定。

表2 T17 蛋白重叠多肽氨基酸序列Tab 2 Amino acid sequence of overlapping polypeptide of T17 protein
1.2.4 TP17 重叠多肽的耦联 参考文献[19]方法,采用碳二亚胺法(EDC)分别将6 段多肽与BSA 耦联,制备包被抗原,采用SDS-PAGE 鉴定多肽耦联效果。
1.2.5 TP17 蛋白抗原性检测 采用ELSIA 测定TP17 蛋白的抗原性。以碳酸盐缓冲液(CBS,PH 9.0)稀释TP17 蛋白至2 μg/mL,加入96孔ELISA板,50 μL/孔,4℃静置16 h;以含0.05%吐温-20 的磷酸盐缓冲液(phosphate buffered solution-twain,PBST)洗涤3 次,加入5%的脱脂奶300 μL/孔,37℃静置2 h;再以PBST 洗涤6 次,随后向检测孔中加入1∶200 稀释的梅毒螺旋体阳性患者血清样本,对照孔分别加入1∶500 稀释的阳性或阴性标准血清。37℃温箱孵育30 min,以PBST洗涤6 次,再加入1∶2 000 稀释的HRP 标记的羊抗人IgG,孵育30 min。PBST 洗涤6 次后加入显色液,以2 mol/L H2SO4反应终止反应,读取OD450值。结果判定:S/N>2.1 判为阳性,其中++++为OD450>0.59,+++为OD450>0.4,++为OD450>0.3;+为S/N>2.1 但OD450≤0.3
1.2.6 TP17 重叠多肽抗原性检测 采用ELSIA 方法检测6 条BSA 耦联的TP17 多肽与10 份梅毒阳性患者血清的反应性。以CBS 缓冲液稀释耦联多肽抗原至终浓度为2 μg/mL 进行抗原包被,以1∶500稀释的血清样品为一抗,1∶2 000 稀释的HRP 标记的羊抗人IgG 为二抗,进行ELSIA 检测,检测及结果判定方法同1.2.4。
1.1 一般资料 选择2010年1月至2015年12月因ACS在复旦大学附属上海市第五人民医院行冠脉介入治疗的患者。入选标准:就诊时年龄≥75岁,能配合手术治疗;估算肾小球滤过率(eGFR)>30 mL·min-1·1.73 m-2;无出血。排除标准:合并肿瘤等终末期疾病;无法配合术后规则用药。共入选181例患者,其中男性110例、女性71例,年龄75~89岁。其中,ST段抬高型急性心肌梗死(STEMI )60例,肌钙蛋白I(TNI)阳性116例,急诊冠脉介入治疗44例。患者入院时均进行BI评分。
1.3 统计学处理 采用SPSS19.0 统计软件对本实验相关数据进行统计分析,组间两两比较采用t 检验,以P<0.05 为差异显著具有统计学意义。
2 结果
2.1 TP17 蛋白的生物学特征与二级结构预测 TP17蛋白全长156 个氨基酸残基,分子量约16.5 kD,理论等电点(pI)8.62;经SignalP-5.0 分析TP17 蛋白N 端22 个aa 为信号肽,信号肽切割位点在Cys22~Val23 之间;TMHMM 2.0 预测TP17 蛋白存在2 个潜在的N-糖基化位点Asn68 和Asn128 和4个O-糖基化位点Thr13、Thr17、Thr19 及Thr21。同源进化分析结果显示,TP17 蛋白与大肠杆菌的铜抗性脂蛋白NlpE 具有20%的序列同源性,属于同一进化分支(图1)。

图1 TP17 蛋白同源进化分析Fig 1 Homologous evolution analysis of TP17 protein
SOMPA 分析结果显示TP17 蛋白二级结构无规卷曲(Random coil,c)约占42.31%、α 螺旋(Alpha helix,h)占25.64%、延伸链(Extended strand,e)24.36%、β转角(Beta turn,t)7.69%(图2);DNASTAR 中Garnier-Robson 方法和Chou-Fasman 方法预测的TP17 蛋白二级结构中α 螺旋、β 折叠、转角及无规卷曲区域略有差异(图2),其中SOMPA 预测的无规卷曲部分与DNASTAR 软件中的转向(Turn,Regions)和卷曲(Coil,Regions)部分有重复的区域主要位于:Cys29~Ala35、Gly51~Cys58、Lys82~Thr94、Ser109~Lys119、Gly134~Ala146。
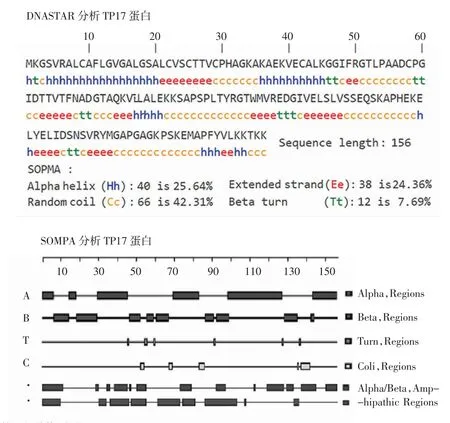
图2 TP17 蛋白的二级结构预测Fig 2 Prediction of secondary structure of TP17 protein
2.2 TP17 蛋白的线性 B 细胞表位预测DNASTAR 和IEDB 综合分析预测TP17 蛋白的抗原性、柔韧性、亲水性、表面易接近性等(图3)与B 细胞表位密切相关的结构信息,采用Bepipred 预测TP17蛋白的线性B 细胞表位,Bepipred Linear Epitope PredictionResults2.0(阈值=0.50),获得4 条线性B 细胞表位:Thr27~Gly47、Gln74~Pro88、Ile102~Ile125、Ala135~Lys152,Bepipred Linear Epitope Prediction Results(阈值=0.35)共获得7 条线性B细胞表位:Pro30~Glu38、Leu53~Asp62、Thr64、Thr66~Glu74、Lys82~Tyr91、Ser110~Lys119、Tyr132~Met145。
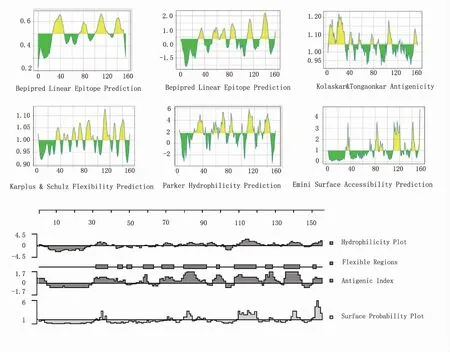
图3 TP17 蛋白的B 细胞表位预测Fig 3 Prediction of B cell epitopes of TP17 protein
2.3 TP17 蛋白三级结构同源建模及B 细胞表位定位 采用SWISS-MODEL,基于参考模型(PDB:4u3q)生成完整TP17 蛋白三维结构(图4)。结果显示,TP17 蛋白富含8 个β-折叠和2 个β-螺旋结构,其β-转角与二级结构预测结果有一定符合度,最终预测表位区Thr27~Glu38、Leu53~Asp62、Thr66~Gln74、Lys75~Pro88、Leu107~Lys119以及Tyr132~Met145 展示在TP17 蛋白分子表面(图4),主要位于无规卷曲区和β-折叠片的转折区域。
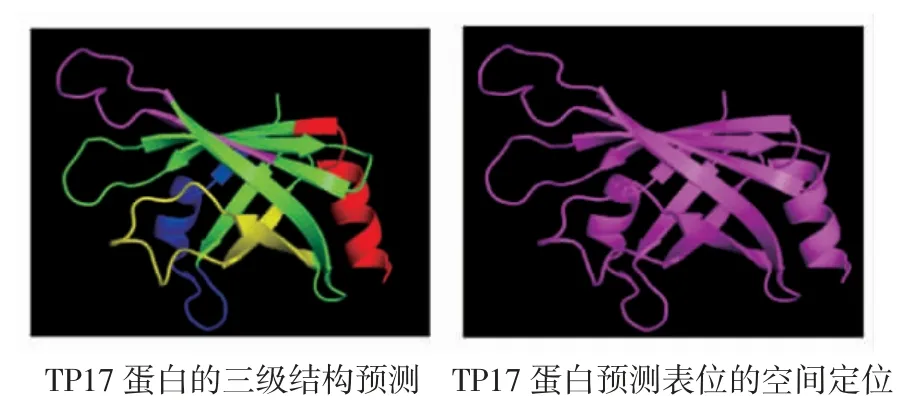
图4 TP17 蛋白的三级结构预测Fig 4 Prediction of three dimensional structure of TP17 protein
2.4 TP17 蛋白构象B 细胞表位预测分析结果如图5所示,TP17蛋白的氨基酸区域为:Lys34~Ala35、Ala55、Pro88、Glu99、Pro136~Pro147、Thr154,分布于三维结构外侧以黄色区域标注。
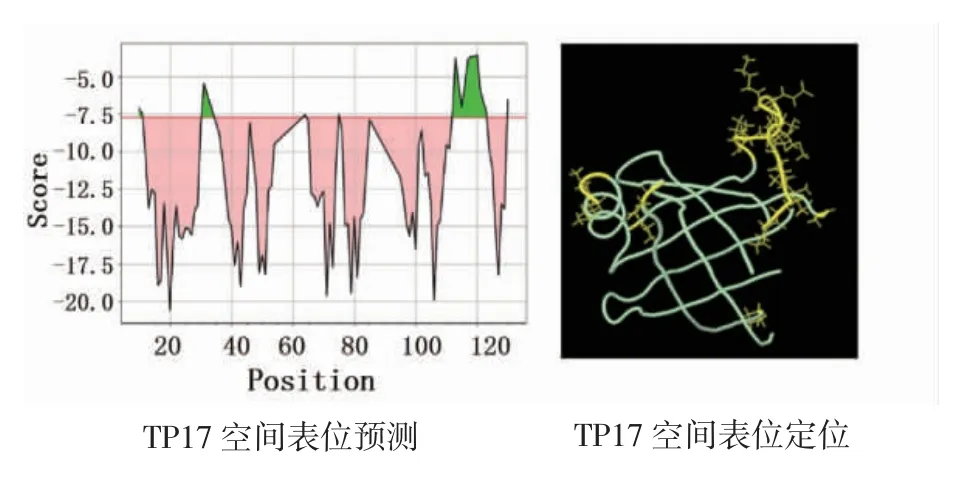
图5 TP17 蛋白的构象型B 细胞表位预测Fig 5 Prediction of conformational B cell epitopes of TP17 protein
2.5 TP17 蛋白及其分段多肽的合成及鉴定 SDSPAGE 鉴定结果表明,TP17 蛋白的纯度约为95%,浓度为2 g/L,HPLC-MS 检测结果显示成功合成的多肽Tp17-1 分子量为3.12 kD、Tp17-2 为3.05 kD、Tp17-3 为3.25 kD、Tp17-4 为3.44 kD、Tp17-5 为3.41 kD、Tp17-6 为3.68 kD。6 段多肽与BSA 耦联后进行鉴定,SDS-PAGE(图6)结果显示6 段多肽均耦联成功。
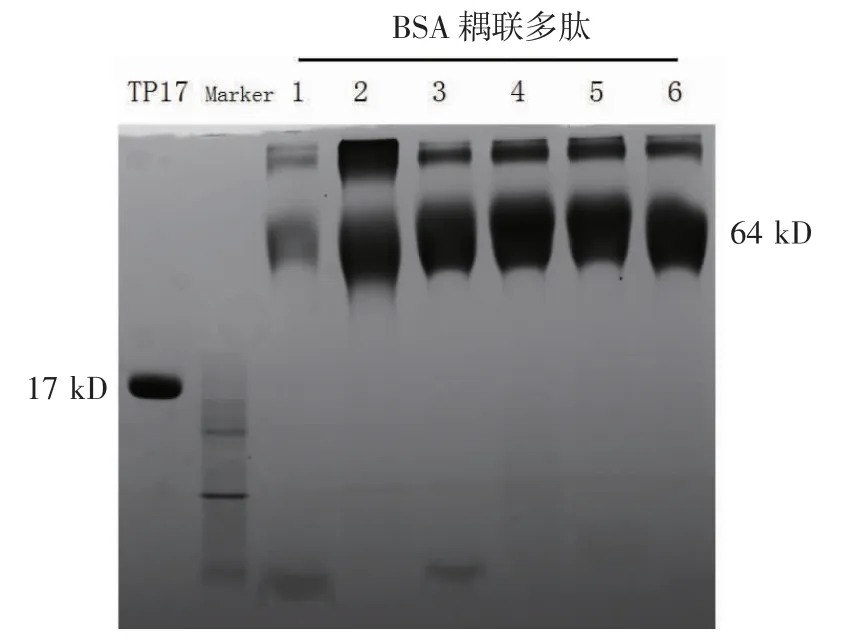
图6 重组表达蛋白TP17 及重叠多肽耦联物的SDS-PAGE 鉴定Fig 6 Identification of recombinant protein TP17 and overlapping polypeptide conjugates by SDS-PAGE
2.6 临床阳性血清样品与TP17 蛋白及多肽的反应 ELISA 检测结果10 份梅毒阳性的临床血清均与TP17 蛋白具有良好反应性,OD450值在0.59~1.45;而不同阳性血清与TP17 蛋白的重叠多肽的反应情况存在一定差异,其中10 份临床阳性血清样品与Tp17-1、Tp17-2、Tp17-3、Tp17-4 及Tp17-6均可发生特异性反应,且与阴性对照相比差异显著(P<0.05);有9 份临床阳性血清样品与Tp17-5均可发生特异性反应,且与阴性对照相比差异显著(P<0.05),仅第5 份阳性血清与Tp17-5 多肽反应性较差,与阴性对照相比差异不显著(P=0.058)。以检测品OD 值(S)/阴性血清OD 值(N)大于2.1 为判断标准,所有多肽与临床阳性血清检测结果均可判断为阳性(S/N>2.1)。见图7、表3。
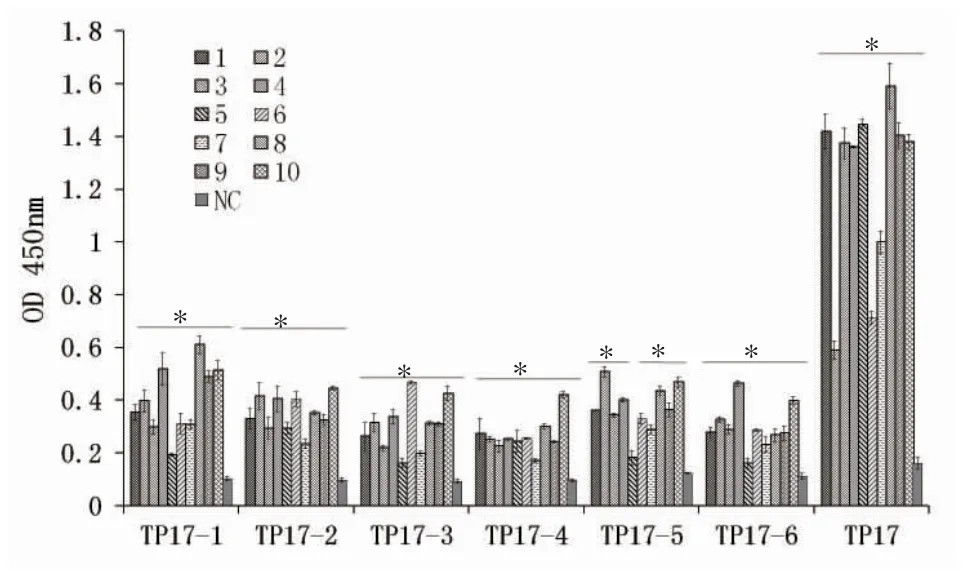
图7 临床阳性血清样品与TP17 蛋白及重叠多肽的反应性分析Fig 7 Reactivity analysis of clinical positive serum samples with TP17 protein and overlapping polypeptides

表3 多肽对应的B 细胞表位及阳性血清ELISA 反应结果Tab 3 Peptide corresponding B cell epitope and positive serum ELISA results
3 讨论
TP17 是一种附着于梅毒螺旋体外膜内小叶的脂蛋白,约占TP 可溶性蛋白的2%,具有良好的抗原性和免疫原性。B 细胞表位是抗体在抗原表面的识别位点,在临床诊断和疫苗设计中起着重要作用,关于TP17 蛋白B 细胞表位的研究较少。随着蛋白质结构和抗原表位研究的发展,生物信息学预测B 细胞表位的准确性也逐步提升。通常情况下,β 转角为凸出结构,多出现在蛋白质抗原表面,含有5个以上的氨基酸残基的转角又常称为环(loop),而loop 区利于抗体的结合,因此表位多含有环状结构,而螺旋和折叠结构比较少见,很多蛋白质的C 端具有较好的亲水性、表面可及性和柔性,所以是很好的抗原决定簇区域[19]。本研究通过DNASTAR Protean 及SOPMA 预测分析TP17 蛋白的二级结构,分析其α 螺旋、β 折叠、转角及无规卷曲等二级结构元件的分布情况,结果显示无规卷曲(42.31%)和β转角(7.69%)在TP17 蛋白的二级结构中占比较高,结合IEDB 数据库软件BepiPred、SOPMA 以及DNASTAR 等对TP17 蛋白进行B 细胞表位分析,采用Hopp-Woods 和Kyte-Doolittle方案、Karplus-Schultz 和Emini 方案、Jameson-Wolf 方案等预测TP17 蛋白亲水性、柔韧性、表面可及性、可塑性特征,综合预测TP17 蛋白的7 个B 细胞线性表位Pro30~Glu38、Leu53~Asp62、Thr64、Thr66~Gln74、Lys82~Tyr91、Ser110~Lys119、Tyr132~Met145。为了增加表位预测的准确性,本研究基于SWISS-MODEL 同源建模构建TP17 蛋白的三维结构,结合IEDB 数据库预测分析TP17 蛋白的构象表位区域:Lys34~Ala35、Ala55、Pro88、Glu99、Pro136~Pro147、Thr154。结合已解析的TP17 蛋白三维结构数据(4u3q)和同源建模结果,将前述7 个线性B 细胞表位进行定位分析,修正后获得6 个TP17 蛋白的线性B 细胞表位:Thr27~Glu38、Leu53~Asp62、Thr66~Gln74、Lys75~Pro88、Leu107~Lys119 以及Tyr132~Met145。
为了验证表位预测的准确性,本研究分段合成了TP17 蛋白多肽(表3),覆盖蛋白所有氨基酸序列并进行了交叉重叠。选择10 份梅毒螺旋体抗体及TRUST 双阳性的临床血清样本与TP17 蛋白及Tp17-1~Tp17-6 这6 段多肽进行ELISA 检测,结果发现,TP17 蛋白与临床阳性血清样本具有良好反应性,而不同阳性血清与6 段多肽均能发生特异性反应,但反应情况存在一定差异,与阴性血清均不反应,表明这6 段多肽均含有B 细胞表位,也验证了本研究预测的抗原表位信息具有较高准确性。本研究分析了TP17 蛋白的B 细胞抗原表位,揭示了TP17 蛋白良好抗原性的分子基础,为梅毒螺旋体的抗体检测和疫苗设计提供了理论依据。
