ARID1A 表达与肝内胆管癌免疫细胞浸润及预后的相互关系研究
2022-09-28张泽武张伟
张泽武,张伟
(天津医科大学肿瘤医院肝胆肿瘤科,国家肿瘤临床医学研究中心,天津市“肿瘤防治重点”实验室,天津市恶性肿瘤临床医学研究中心,天津 300060)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是第二常见的原发性肝癌,约占所有胃肠道肿瘤的3%[1-2]。ICC 是一种高度侵袭性恶性肿瘤,目前肝内胆管癌发病率仍呈上升趋势[3],总体预后较差,根治性手术目前仍是主要的治疗手段,对于晚期或不可切除的患者,局部和全身化疗是主要的治疗选择。即使接受手术治疗,术后5 年生存率仍低于20%[4]。
近年来免疫治疗的快速发展,为ICC 的治疗提供了新的选择[5]。随着二代测序技术的应用,在ICC 中发现了许多常见的基因突变,例如IDH1/2、KRAS、BAP1、ARID1A、PBRM1 和FGFR2 等[6]。这些肿瘤驱动基因的突变是否直接影响肿瘤免疫表型,以及能否作为生物指标为临床治疗提供指导,仍需进一步研究。
AT 富含结构域1A 基因(AT-rich interaction domain 1A,ARID1A)是恶性肿瘤中最常见的突变基因之一,大多数ARID1A 突变是失活突变,导致其表达缺失[7]。在多种肿瘤中已发现其表达的降低与肿瘤进展相关[8-9],且已有研究发现ARID1A 表达缺失与肿瘤浸润淋巴细胞的改变以及免疫检查点阻断的治疗反应有关[10-11]。最新的研究发现,在肝细胞肝癌中ARID1A 可以通过增加CYP450 介导的氧化应激促进启动,而肿瘤内ARID1A 的缺失降低了染色质可及性,并降低了与迁移、侵袭和转移相关的基因的转录[12]。ARID1A 的表达可用于预测肝癌的预后,即ARID1A 表达水平高的患者的预后较差,在体外实验发现降低ARID1A 表达显著减慢细胞周期并抑制HCC 细胞增殖、迁移和侵袭[13]。本研究旨在进一步探讨在ICC 中ARID1A 表达与肿瘤免疫环境之间关系,分析预后价值以及临床病理特征。
1 对象与方法
1.1 研究对象 本研究共纳入了2011 年1 月—2017 年12 月在天津医科大学肿瘤医院接受手术治疗的ICC 患者136 例,男性74 例,女性62 例,年龄28~77 岁。纳入标准:(1)病理最终诊断为ICC 的患者。(2)患者具有完整的临床病理资料。(3)有组织蜡块,确保肿瘤和癌旁的石蜡切片完整。排除标准:(1)由典型的肝细胞癌(HCC)和典型的ICC 组成的混合HCC-ICC 病例。(2)术前接受射频消融、辅助化疗或放疗等治疗的患者。根据2017 年第8 版AJCC 分期系统对所有患者进行分期。研究实施前医院伦理通过,所有患者或其法定监护人均签署书面知情同意。
1.2 标本制备与染色 收集来自天津医科大学肿瘤医院病理科136 例手术标本,组织经福尔马林固定石蜡包埋,并进行苏木精-伊红染色。通过从每个病例中选择有代表性的肿瘤区域和典型的瘤周区域,构建由福尔马林固定、石蜡包埋肿瘤组织的2 mm核心组成的组织微阵列(tissue microarrays,TMAs),用于各种免疫组化染色。免疫组织化学染色:TMAs芯片在65℃干烤箱中过夜,第2 天在二甲苯和梯度乙醇中逐步脱蜡。在抗原修复后,用3%过氧化氢处理10 min,抑制内源性过氧化物活性。然后在室温下使用抗体孵育样品30 min,在4°C 下过夜。洗涤后,组织微阵列与二抗在室温下孵育1 h。用3,3-二氨基联苯胺溶液(ZSGB-Bio)处理并用苏木精复染。使用的一抗如下:ARID1A(clone EPR13501-73;稀释倍数:1∶500;Abcam),CD4(ab 133616;稀释倍数:1∶500;Abcam),CD8(ab17147;稀释倍数:1∶50;Abcam),CD163(ab74604;稀释倍数:1 ∶25;Abcam),CD66b(ab 197678;稀释倍数:1∶1 000;Abcam)。免疫组化检测结果判定:ARID1A 表达只有核染色阳性被定义为表达,阳性肿瘤细胞比例采用半定量评分系统:<1%评分0(无表达);1%至90%评分1(局灶性或区域性阳性);91%至100%评分2(弥漫阳性),评分为0、1 定义为ARID1A 表达缺失(阴性),评分为2 定义为ARID1A 表达(阳性)。CD4+、CD8+T 淋巴细胞、CD163+巨噬细胞和CD66b+中性粒细胞均计数4 个20 倍镜视野的阳性细胞数,取其平均值。然后以中位数为截断值,分为高浸润组和低浸润组。所有实验由专业的病理医师进行染色评分。
1.3 随访 随访开始于手术日,截止于2019 年4 月,通过电话随访以及定期复诊获取相应的数据,随访内容包括:生存状态、体力状态、肝功能、肿瘤标志物和强化CT 或MRI。中位随访时间为22.68 个月(2.87~100 个月)。其中无病生存期(disease free survival,DFS)定义为从手术日期至肿瘤复发或者最后一次随访的间隔时间。总生存期(overall survival,OS)定义为从手术日期至患者因肿瘤死亡或者最后一次随访的间隔时间。
1.4 数据库分析 使用TIMER 在线数据库(肿瘤免疫评估资源,https://cistrome.shinyapps.io/timer/)来系统地分析ARID1A 拷贝数改变的肿瘤组织中6种常见免疫细胞(B 细胞、CD4+T 细胞、CD8+T 细胞、巨噬细胞、中性粒细胞和树突状细胞)浸润水平,从而进行泛癌种分析。肿瘤细胞ARID1A 拷贝数水平由GISTIC2.0 定义,包括深度缺失、臂水平缺失、二倍体/正常和臂水平增益。
1.5 统计学处理 采用了SPSS 22.0 进行统计学分析。符合正态分布连续变量采用t 检验,针对分类变量采用卡方检验或Fisher's 精确检验等分析基本临床指标和ARID1A 相关性。通过Kaplan-Meier 法计算DFS 和OS。采用双边Wilcoxon 秩和检验分析肿瘤组织中ARID1A 基因拷贝数水平与肿瘤免疫浸润的关系。P<0.05 视为有统计学意义。
2 结果
2.1 ARID1A 的表达 136 例肝内胆管癌组织中ARID1A 在108 例(79.4%)中呈现弥漫性阳性,而在24 例(17.6%)和4 例(2.9%)中分别显示表达完全缺失和局灶性缺失。ARID1A 代表性免疫组织化学染色结果如图1 所示。
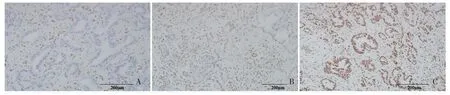
图1 免疫组化法检测ARID1A 蛋白表达(200×)Fig 1 The expression of ARID1A protein detected by immunohistochemical method(200×)
2.2 免疫细胞在肿瘤和癌旁组织中表达以及浸润水平 在不同的ICC 组织样本中,CD4+、CD8+的T淋巴细胞,CD163+巨噬细胞和CD66b+中性粒细胞的数量差异显著,见图2。与癌旁组织相比,CD4+、CD8+T 淋巴细胞,CD163+巨噬细胞在肿瘤组织中浸润明显减少(t=6.962、7.364、7.905,均P<0.000 1),而CD66b+中性粒细胞在肿瘤组织浸润明显增加(t=4.093,P<0.000 1),见图3。
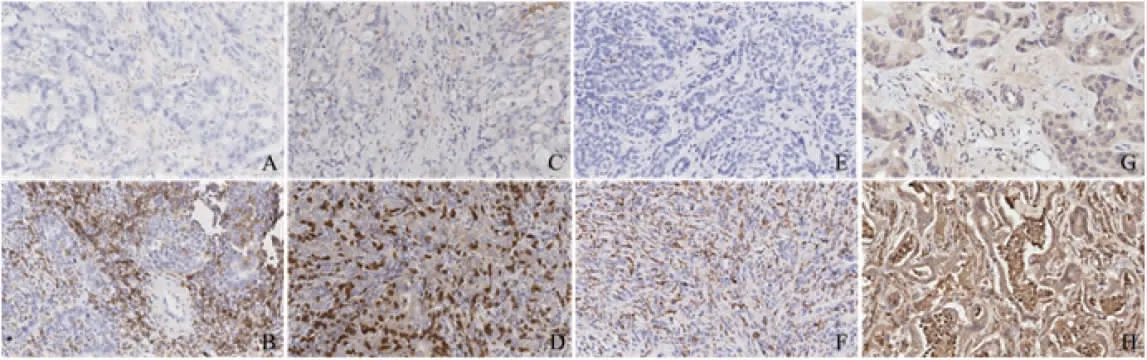
图2 不同指标免疫组化染色结果(200×)Fig 2 Immunohistochemical staining results of different indexes(200×)
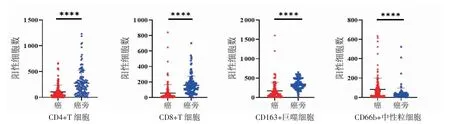
图3 癌和癌旁组织中免疫细胞中浸润比较Fig 3 Comparison of immune cell infiltration in tumor and para-tumor
2.3 ARID1A 和免疫细胞的表达与预后的相关性 136 例患者成功随访120 例,失访15 例,1 例死于与肿瘤无关的原因。中位随访时间22.68 个月。120 例中复发82 例,死亡54 例。ARID1A 缺失组预后较好,但不具有统计学意义(P>0.05)。根据免疫细胞浸润水平的高低,在ARID1A 表达组和缺失组中进行生存分析,发现在ARID1A 表达缺失组和ARID1A 表达组中CD163+巨噬细胞的浸润水平与生存呈负相关(log-rank χ2=5.399、6.376,P=0.02、0.012)。而ARID1A 表达与CD4、CD8 和CD66b的浸润水平、生存预后之间均无统计学意义(均P>0.05),见图4。
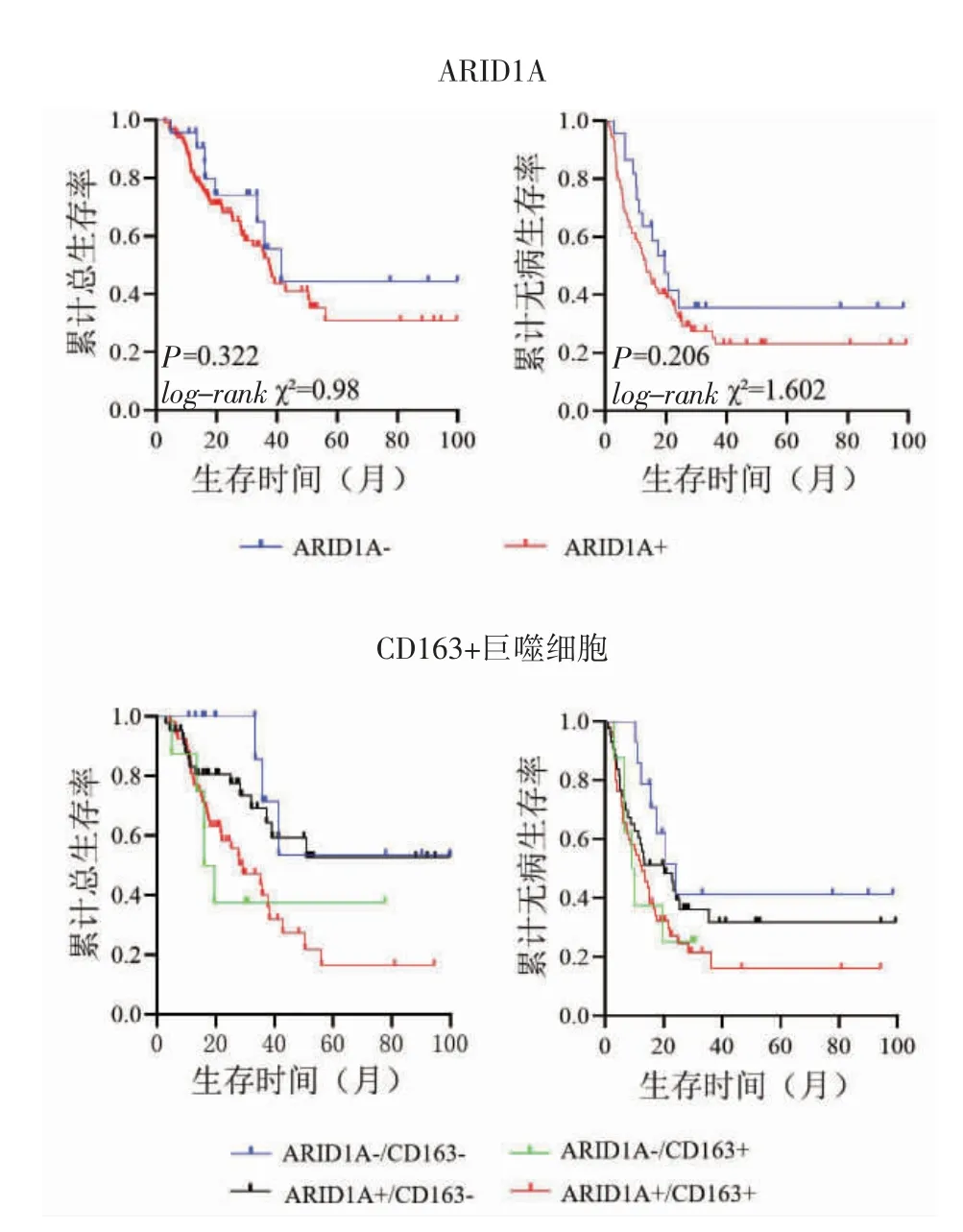
图4 ARIDA 和免疫细胞的表达与预后的关系Fig 4 The relationship between the expression of ARIDA and multiple immune cells and prognosis
2.4 ARID1A 与临床病理特征的相关性 ARID1A的表达与肝硬化呈正相关(χ2=7.126,P<0.01),而性别、年龄、肝功能分级等与ARID1A 的表达不具有统计学意义(P>0.05),见表1。
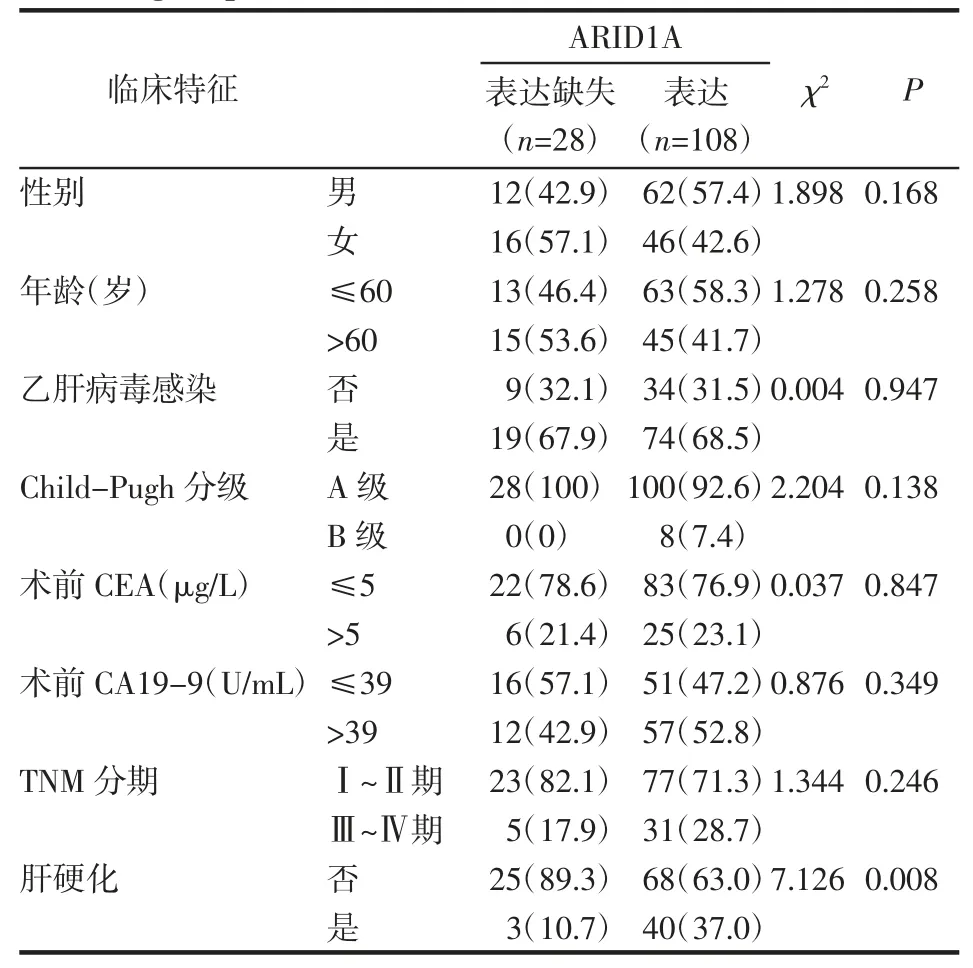
表1 ARID1A 的表达与各病理参数之间的相关性[n(%)]Tab 1 Correlation between the expression of ARID1A and pathological parameters[n(%)]
2.5 ARID1A 与免疫细胞浸润之间的关系 与表达ARID1A 相比,CD4+T 淋巴细胞、CD8+T 淋巴细胞和CD163+巨噬细胞在ARID1A 表达缺失的ICC中的浸润明显降低(t=2.174、1.998、2.162,均P<0.05),CD66b+中性粒细胞免疫浸润水平与ARID1A 的表达无统计学意义(图5)。

图5 ICC 中ARID1A 的表达与免疫细胞浸润之间的关系Fig 5 Relationship between expression of ARID1A and immune cell infiltration in ICC
2.6 数据库分析ARID1A 拷贝数水平与免疫细胞浸润的关系 通过TIMER 在线数据库分析不同癌种中ARID1A 基因拷贝数水平的改变与6 种常见免疫细胞(B 细胞、CD4+T 细胞、CD8+T 细胞、巨噬细胞、中性粒细胞和树突状细胞)之间关系。发现相比于二倍体/正常状态,在乳腺癌basal-like 型和低级胶质瘤中,ARID1A 臂水平缺失状态与多数免疫细胞浸润降低相关(P<0.05),见图6。
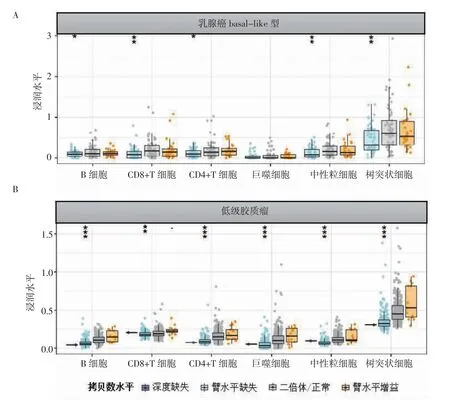
图6 TIMER 数据库分析ARID1A 基因拷贝数水平与肿瘤免疫浸润的关系Fig 6 Relationship between the change of ARID1A gene copy number level and tumor immune invasion analyzed by TIMER database
3 讨论
ARID1A(BAF250A)是染色体重构复合物SWI/SNF 的一个亚基,有助于蛋白质与DNA 的相互作用[14]。ARID1A 也是癌症中最常见的突变基因之一,大多数ARID1A 突变是失活突变并导致ARID1A表达缺失[7]。
ARID1A 在乳腺癌[15]、肝细胞癌[16]和胃癌[9]中通常被认为是一种抑癌基因,已有相关报道发现在ICC 中较低的ARID1A 表达与较低的生存率和无病生存率相关[8]。但也有研究发现ARID1A 高表达与肝内胆管癌的低生存率和高复发率相关,这种差异可能与ARID1A 在肝脏肿瘤抑制和致癌性中的双重作用相关[17]。本研究同样发现,ARID1A 表达缺失组有较好的生存和预后倾向,但是并不具有统计学意义,这可能与ARID1A 表达缺失的患者数过少有关。
最新的研究发现,ARID1A 突变导致干扰素(IFN)基因表达受损,肿瘤浸润T 细胞匮乏,肿瘤免疫力低下,宿主存活时间缩短。而IFN 信号受损与免疫治疗反应差有关[10]。ARID1A 缺乏导致肿瘤Th1型趋化因子表达和T 细胞肿瘤浸润不良,并阻碍体内自发的肿瘤免疫[10]。通过TIMER 在线数据库分析,在部分癌中例如乳腺癌basal-like 型和低级胶质瘤,其ARID1A 拷贝数的缺失与多数免疫细胞浸润降低相关。在本研究中也发现,ARID1A 表达缺失与CD4+、CD8+T 细胞和CD163+巨噬细胞浸润减少有关。
本研究还发现,不管在ARID1A 表达缺失组和ARID1A 表达保留组中CD163+巨噬细胞的浸润水平与生存呈负相关(P<0.05)。肿瘤相关巨噬细胞(tumour-associated macrophages,TAMs)可分为两种表型M1 和M2 亚型[18],M1 型TAMs(经典活化的巨噬细胞)表现为促炎和抗肿瘤特性,而M2 型TAMs(选择活化的巨噬细胞)是促进肿瘤生长、血管生成和抑制适应性免疫[19]。CD68、CD163 是常用于检测肿瘤标本TAMs 的生物标志物,CD68 可以识别整个TAMs 群体,而CD163 在M2 型TAMs 表达[20]。多项研究也发现,M2 型TAMs 浸润水平与胃癌[21]、淋巴瘤[22]、肾细胞癌[23]和肝内胆管癌[24]患者的不良预后相关。
临床上ARID1A 的突变往往伴随着较高的肿瘤突变负荷(tumor mutational burden,TMB),多数研究发现ARID1A 缺陷损害错配修复(mismatch repair,MMR),并与微卫星高度不稳定性(microsatellite instability-high,MSI-H)、高TMB、程序性细胞死亡蛋白-1(programmed death-1,PD-1)表达升高相关联[11],而这些都是免疫治疗有效的标志物[25]。
总之,本研究发现在胆管癌以及其他多个肿瘤中,ARID1A 的表达缺失会抑制包括CD4+T 细胞、CD8+T 细胞、CD163+巨噬细胞等多种免疫细胞的浸润。而在本研究中CD163+巨噬细胞的浸润与生存呈负相关,推测ARID1A 的表达缺失可能通过抑制CD163+巨噬细胞的浸润,从而使该组患者有着较好生存和预后的倾向。要想进一步阐明ARID1A的表达与ICC 患者生存预后的关系以及ARID1A的缺失是否可以作为胆管癌免疫治疗的潜在标志物,仍需进一步扩大样本量研究。
