薯蓣皂苷对人结肠癌细胞凋亡的作用及机制研究
2022-09-28管君荀敬王波涛张琦王西墨
管君,荀敬,王波涛,张琦,王西墨
(1.天津医科大学研究生院,天津 300070;2.天津市南开医院,天津市急腹症器官损伤与中西医修复重点实验室,天津 300100)
结肠癌是消化道系统常见的恶性肿瘤,研究表明在中国结肠癌的发病率位于癌症第2 位,死亡率位于肿瘤疾病前5 位[1],且发病率呈现上升趋势[2]。相较于手术、放化疗等治疗结肠癌的传统手段[3],草药类化合物具有减低创伤、降低不良反应等优势,有望成为安全有效治疗结肠癌的新方法[4]。
薯蓣为薯蓣科植物薯蓣或参薯的根,性平微涩[5],在中医学上归脾、肺、肾经,具有祛痰、消食利水、舒筋活血、截疟等功效[6]。薯蓣皂苷(Dioscin)来源于薯蓣[7],是一种天然甾体皂苷类化合物,也是现临床常用的六味地黄丸、地奥心血康胶囊等中药的有效成分[8]。现代药理学研究显示,Dioscin 对多种疾病有预防及治疗作用,如抗肿瘤、抗真菌病毒、抗炎等[9]。近年来的研究显示,Dioscin 可对结肠癌[10]、前列腺癌[11]及肝癌[12]等多种肿瘤细胞发挥抑制细胞增殖并诱导其凋亡的作用。在结肠癌中,已有蛋白组学研究发现Disocin 可能通过氧化应激途径导致结肠癌细胞的凋亡[13],但未进一步探讨其氧化应激机制及其相关的信号通路。本文以HCT-116 细胞及RKO 细胞为研究对象,探讨Dioscin 激活氧化应激机制的信号通路,为其应用于结肠癌临床治疗进一步提供了理论和实验依据。
1 材料与方法
1.1 药品与试剂 Dioscin 购自美国Selleck Chemicals 公司(质量分数≥99%,批号S2379);DMEM 培养基、胰蛋白酶、灭活胎牛血清(FBS)、磷酸盐缓冲液(PBS)、RIPA 裂解液、PVDF 膜和化学发光试剂盒(美国Thermo Fisher Scientific 公司);抗体β-actin、Bcl-2、Nrf2、Caspase-9 以及cleaved Caspase-9(英国Abcam 公司);抗体Akt 和p-Akt(美国Cell Signaling Technology 公司);二甲基亚砜(DMSO)、青霉素/链霉素双抗、BCA 蛋白浓度测定试剂盒、乳酸脱氢酶(LDH)活性检测试剂盒、Annexin V-FITC/PI 凋亡检测试剂盒、DNA 含量检测试剂盒、ROS 检测试剂盒、DAPI 染色剂及超氧化物歧化酶(SOD)试剂盒(北京索莱宝生物科技有限公司);CCK-8 检测试剂盒(上海翊圣生物科技有限公司);荧光探针MitoSOX Red(上海懋康生物科技有限公司)。
1.2 仪器 超低温冰箱(美国Thermo Fisher Scientific 公司);二级生物安全柜(苏州市金净净化科技有限公司);CO2恒温细胞培养箱(立康生物医疗科技控股有限公司);酶标仪(上海科华实验系统有限公司);全自动多功能化学发光成像仪(上海天能科技有限公司);流式细胞仪(美国ACEA 公司);倒置荧光相差显微镜(德国Leica 公司);高压蒸汽灭菌锅(日本Hirayama 公司)。
1.3 方法
1.3.1 细胞培养 人结肠癌细胞系HCT-116 细胞、RKO 细胞(购自中国科学院细胞研究所)在含有10% FBS 和1%青霉素/链霉素双抗的DMEM 培养液中培养,放置在37℃、饱和湿度、5%CO2的培养箱中,每2~3 d 换液,用胰蛋白酶消化传代,取对数生长期的细胞进行实验。
1.3.2 CCK-8 实验 将生长状态良好,处于对数生长期的HCT-116 细胞、RKO 细胞以5×104/mL 的细胞密度、100 μL/孔接种于96 孔板中,置于37℃、5%CO2的培养箱中培养。将HCT-116 细胞培养12 h待贴壁后开始加药处理,分别设置空白组、对照组(DMSO 溶剂)和Dioscin 组(2、4、6、8、10 μmol/L),每组设置3 个复孔,分别培养24、48 h。将RKO 细胞培养12 h 待贴壁后开始加药处理,分别设置空白组、对照组(DMSO 溶剂)和Dioscin 组(5、10、15、20、25 μmol/L),每组设置3 个复孔,分别培养24、48 h。测量前,每孔加入10 μL CCK-8 工作液,震荡混匀后继续正常培养2 h,用酶标仪在450 nm 波长处测定吸光度(A)值,计算细胞存活率及半数抑制浓度(IC50)值。
细胞存活率=(药物组A 值-空白组A 值)/(对照组A 值-空白组A 值)
1.3.3 试剂盒检测 细胞LDH 释放量和SOD 活性严格按照试剂盒说明书操作步骤执行,分别检测LDH 和SOD 的表达水平。
1.3.4 流式细胞术(Annexin V-FITC/PI 双染法)检测细胞凋亡 取对数生长期的HCT-116 细胞、RKO细胞,用完全培养液重悬后,以5×105个/孔的细胞数目接种于6 孔板中培养。待细胞贴壁后,HCT-116药物组加入Dioscin(4、6 μmol/L)处理,RKO 药物组加入Dioscin(5、10 μmol/L)处理,并各自设置对照组。继续培养24 h 后,用0.25%胰蛋白酶消化细胞,离心收集细胞后用预冷的PBS 清洗。实验过程按照Annexin V-FITC/PI 细胞凋亡检测试剂盒操作,各组加入5 μL Annexin V-FITC 轻摇混匀,之后加入10 μL PI 染色液混匀,室温避光孵育20 min后,用流式细胞仪进行检测分析。细胞凋亡率=早期细胞凋亡率+晚期细胞凋亡率
1.3.5 流式细胞术检测细胞DNA 含量 细胞培养及处理方法同“1.3.4”项,离心后收集的细胞用预冷的PBS 冲洗2 次,制备成单细胞悬液后去除上清,在细胞中加入70%预冷乙醇500 μL,固定2 h 过夜,4℃保存,染色前用PBS 洗去固定液。在细胞沉淀中加100 μL RNase A 溶液,重悬细胞后以37℃水浴30 min,再加入400 μL PI 染色液混匀,4℃避光孵育30 min,之后用流式细胞仪进行检测分析。
1.3.6 流式细胞术检测细胞内ROS 表达水平 取对数生长期、生长状态良好的HCT-116 细胞、RKO细胞,以5×105/孔的细胞数目接种于6 孔板中,在37℃、5%CO2的培养箱中孵育。待细胞贴壁之后,HCT-116 细胞各加入4、6 μmol/L 的Dioscin,RKO 细胞各加入5、10 μmol/L 的Dioscin,另各自设立对照组,收集细胞弃去上清后用预冷的PBS 洗涤2次,之后加入10 μmol/L的DCFH-DA 溶液,在室温中避光孵育10 min,孵育完成后用PBS 洗涤细胞2次,再用500 μL PBS 重悬细胞,用流式细胞仪检测细胞内ROS 表达水平。
1.3.7 荧光染色法观察细胞超氧化物的表达情况 取生长状态良好的HCT-116 细胞,以3×105/孔的细胞浓度接种于6 孔板中,每孔2 mL 的细胞悬液。待细胞贴壁后,药物组加入Dioscin(4、6 μmol/L)处理细胞,对照组加入相同体积的DMSO 溶剂。取生长状态良好的RKO 细胞,以5×105/孔的细胞浓度接种于6 孔板中,每孔2 mL 的细胞悬液。待细胞贴壁后,药物组加入Dioscin(5、10 μmol/L)处理细胞,另设对照组。在培养箱中继续培养24 h 后收集细胞并用预冷的PBS 缓冲液洗涤细胞2 次,按照荧光探针MitoSOX Red 及DAPI 染色剂说明书处理待测细胞,在荧光显微镜下观察拍照。
1.3.8 Western 印迹法检测细胞相关蛋白的表达 取处于对数生长期生长状态良好的HCT-116 细胞、RKO 细胞以5×105个/孔细胞密度接种于6 孔板中,每孔2 mL 的细胞悬液。待细胞贴壁后,HCT-116 细胞加入Dioscin(4、6 μmol/L)处理,RKO 细胞加入Dioscin(5、10 μmol/L)处理,对照组细胞加入等体积的DMSO 溶剂。置于37℃、5%CO2培养箱中培养24 h 后弃去培养液,用遇冷的PBS 缓冲液冲洗2 遍后收集各组细胞,分别加入200 μL 的RIPA 裂解液提取细胞总蛋白,用BCA 蛋白浓度测定试剂盒进行蛋白浓度测定,蛋白样品进行SDS-PAGE 凝胶电泳,之后湿转到PVDF 膜上,用含有5%脱脂奶粉的TBST 溶液封闭1 h,分别加入β-actin、Bcl-2、Nrf2、AKT、p-Akt、Caspase-9 以及cleaved Caspase-9 蛋白抗体(稀释比例为1:1 000),一抗4℃孵育过夜,室温下用TBST 溶液洗膜3 次,每次10 min。然后分别加入辣根过氧化物酶标记的二抗(稀释比例为1:5 000),室温孵育1 h,室温下用TBST 溶液洗膜3次,每次10 min。采用化学发光法检测,结果在化学发光成像仪上显影,使用Image J 软件对各蛋白条带的灰度值进行半定量分析,计算目的蛋白和内参蛋白的灰度比值。
1.4 统计学处理 除特殊说明外,所有实验均进行3 次及以上的生物学重复测试。使用GraphPad Prism 7.0 软件绘图并进行统计分析,结果均用表示,组间差异比较应用单因素方差分析(One-way ANOVA)进行统计学分析,P<0.05 表明差异有统计学意义。
2 结果
2.1 Dioscin 对结肠癌细胞生长的影响 CCK-8 实验结果显示,以不同浓度Dioscin 分别作用于HCT-116 细胞、RKO 细胞,分别检测24 h 和48 h 的细胞存活率。HCT-116 细胞结果显示,经过Dioscin 处理24 h 后,与对照组相比,2、4、6、8、10 μmol/L 组的细胞存活率降低(均P<0.05)。经过Dioscin 处理48 h后,与对照组相比,2、4、6、8、10 μmol/L 组的细胞存活率降低(均P<0.05);RKO 细胞结果显示,经过Dioscin 处理24 h 后,与对照组相比,5、10、15、20、25 μmol/L 组的细胞存活率降低(均P<0.001)。经过Dioscin 处理48 h 后,与对照组相比,5、10、15、20、25 μmol/L 组的细胞存活率降低(均P<0.001)。从时间梯度上,48 h 相较于24 h 的25 μmol/L组的细胞存活率降低(P<0.05),结果见图1。此外,Dioscin 作用HCT-116 细胞24 h 和48 h 的半数抑制浓度(IC50)值分别为6.15 μmol/L 和5.89 μmol/L,RKO 细胞24 h 和48 h 的半数抑制浓度(IC50)值分别为16.15 μmol/L 和13.77 μmol/L。
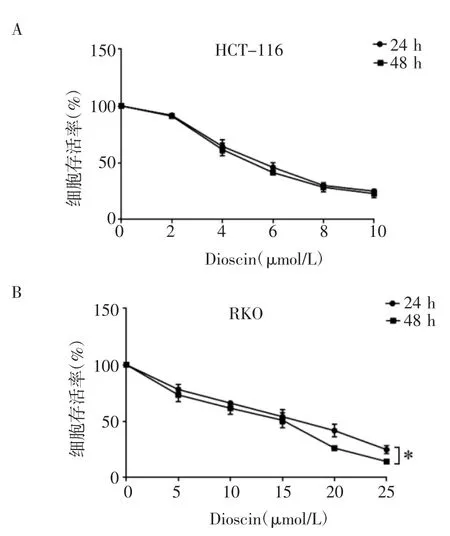
图1 Disocin 对结肠癌细胞存活率的影响Fig 1 Effect of Dioscin on cell viability rates of colon cancer cell
2.2 Dioscin 对结肠癌细胞LDH 释放量的影响 HCT-116 细胞结果显示,经过Dioscin 处理24 h 后,与对照组相比,2、4、6、8、10 μmol/L 组细胞的LDH 释放量升高(均P<0.05)。经过Dioscin 处理48 h 后,与对照组相比,2、4、6、8、10 μmol/L 组细胞的LDH 释放量升高(均P<0.001)。由图2 可看出,从时间梯度上,48 h 相较于24 h 的10 μmol/L 组细胞的LDH释放量升高(P<0.001);RKO 细胞结果显示,经过Dioscin 处理24 h 后,与对照组相比,5、10、15、20、25 μmol/L 组细胞的LDH 释放量升高(均P<0.001)。经过Dioscin 处理48 h 后,与对照组相比,10、15、20、25μmol/L组细胞的LDH 释放量升高(均P<0.01)。从时间梯度上,48 h 相较于24 h 的25 μmol/L组细胞的LDH 释放量升高(P<0.001)。

图2 Dioscin 对结肠癌细胞LDH 释放量的影响Fig 2 Effect of Dioscin on LDH release of colon cancer cells
2.3 Dioscin 对结肠癌细胞DNA 含量的影响 Dioscin作用细胞24 h 后,HCT-116 细胞和RKO 细胞的DNA 含量则随Dioscin 浓度增加明显上升,且差异显著(P<0.05,P<0.001)(图3)。

图3 Dioscin 对结肠癌细胞DNA 含量的影响Fig 3 Effect of Dioscin on DNA content of colon cancer cells
2.4 Dioscin 对结肠癌细胞凋亡的影响 HCT-116细胞的结果显示,与对照组相比,4、6 μmol/L 组细胞总凋亡率增加(均P<0.001),且6 μmol/L 组相较于4 μmol/L 组总凋亡率也呈上升趋势(P<0.05);RKO 细胞的结果显示,与对照组相比,5、10 μmol/L组细胞总凋亡率增加(P<0.01,P<0.001),且10 μmol/L组相较于5 μmol/L 组总凋亡率具有统计学差异(P<0.01)(图4)。

图4 Dioscin 对结肠癌细胞凋亡的影响Fig 4 Effect of Dioscin on apoptosis of colon cancer cells
2.5 Dioscin 对结肠癌细胞凋亡相关蛋白表达的影响 HCT-116 细胞的Western 印迹结果显示,与对照组相比,4、6 μmol/L 组细胞Bcl-2 蛋白表达水平下调(均P<0.001),cleaved Caspase-9 蛋白表达水平上调(均P<0.001);RKO 细胞的Western 印迹结果显示,与对照组相比,10 μmol/L Dioscin 组Bcl-2 蛋白表达下调(P<0.001),Dioscin 组cleaved Caspase-9蛋白表达水平均上调(P<0.01,P<0.001)(图5)。
2.6 Dioscin 通过氧化应激机制导致结肠癌细胞凋亡 用Dioscin 处理HCT-116、RKO 细胞24 h 后,使用荧光探针法处理后以流式细胞术检测细胞内ROS 水平变化情况。结果显示,经4、6 μmol/L Dioscin 处理后,HCT-116 细胞内ROS 水平较对照组上调(P<0.05,P<0.001);经5、10 μmol/L Dioscin处理后,RKO 细胞的ROS 水平较对照组上调(均P<0.001),且HCT-116 及RKO 细胞的ROS 表达情况均呈现浓度依赖性(图6)。
通过荧光探针法检测线粒体超氧化物的表达情况,HCT-116 细胞结果显示,与对照组相比,4、6 μmol/L 组细胞的超氧化物含量增多(均P<0.001),且随着Dioscin 浓度增加,超氧化物含量也逐渐上调(P<0.001);RKO 细胞结果显示,经5、10 μmol/L Dioscin 处理后,细胞的超氧化物含量较对照组增多(均P<0.001),见图7。
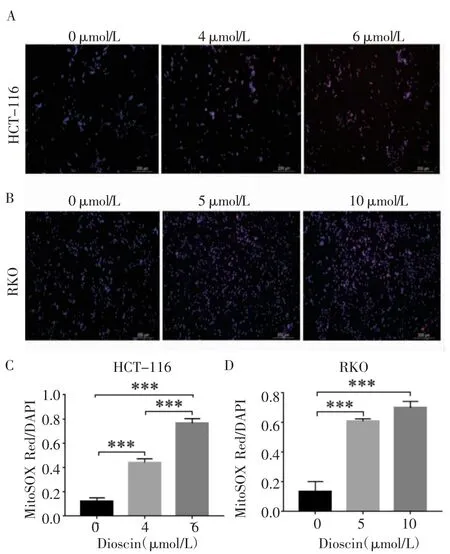
图7 Dioscin 对结肠癌细胞超氧化物含量的影响(200×)Fig 7 Effect of Dioscin on superoxide content of colon cancer(200×)
从图8 可以看出,经4、6 μmol/L Dioscin 处理后,HCT-116 细胞的SOD 活性较对照组降低(P<0.05,P<0.001);经5、10 μmol/L Dioscin 处理后,RKO细胞的SOD 活性较对照组降低(均P<0.001),且HCT-116 及RKO 细胞的SOD 的表达情况均呈现浓度依赖性。
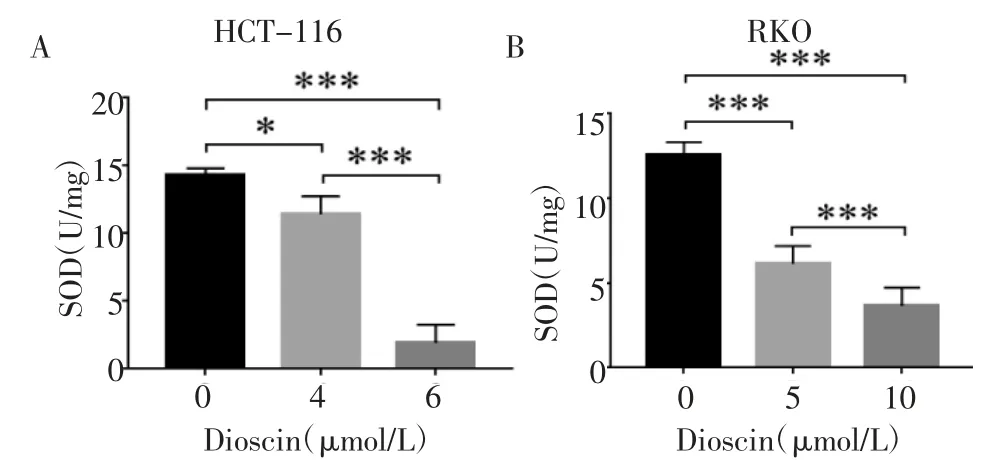
图8 Dioscin 对结肠癌细胞SOD 活性的影响Fig 8 Effect of Dioscin on SOD activity of colon cancer cells
2.7 Dioscin 对结肠癌细胞Nrf2 信号通路相关蛋白表达的影响 Western 印迹法检测相关蛋白表达结果显示,与对照组相比,HCT-116、RKO 药物组细胞随着Dioscin 浓度增加,磷酸化Akt(P<0.05,P<0.001)和Nrf2(均P<0.001)表达水平逐渐下调(图9)。

图9 Dioscin 对结肠癌细胞Nrf2 信号通路相关蛋白表达的影响Fig 9 Effect of Dioscin on Nrf2 signaling pathway-related protein expression of colon cancer cells
3 讨论
结肠癌是常见的恶性实体肿瘤,其不良预后严重影响了人类的身心健康。Dioscin 是一种传统中草药提取的天然糖苷,广泛存在于多种草本植物中[14],已有研究表明其具有抗癌活性[15]。基于肿瘤发生、发展的复杂性,本实验以人结肠癌HCT-116、RKO 细胞为研究对象,探讨Dioscin 激活氧化应激,诱导细胞凋亡的机制。
细胞凋亡是细胞受基因调控的一种程序性死亡形式,在正常情况下机体通过凋亡来清除受损或病变细胞来维护机体健康。细胞凋亡主要有内源性和外源性两种途径,内源性途径主要在线粒体水平由DNA 损伤和代谢应激启动凋亡[16]。在线粒体途径中调控细胞凋亡的主要因子是Bcl-2 抗凋亡蛋白[17],Bcl-2 表达改变会影响线粒体膜通透性,从而使细胞色素C 释放激活下游Caspase 蛋白,最终导致细胞凋亡[18]。有研究表明Dioscin 可通过上调Caspase 3、下调Bcl-2 的表达来抑制肝癌细胞活性[19],也有研究表明Dioscin 可以激活线粒体信号途径导致皮肤癌细胞凋亡[20]。对于结肠肿瘤,本研究结果表明Dioscin 可通过线粒体途径对肿瘤细胞产生毒性作用,诱导细胞凋亡。Western 印迹结果同样表明加药后抗凋亡蛋白Bcl-2 表达下调,促凋亡蛋白cleaved Caspase-9 表达上调。
在许多病理状态下,发生活性氧和抗氧化系统失衡即为氧化应激。细胞ROS 的产生主要在线粒体内,若ROS 产生过多致使内环境失衡,细胞就会发生氧化应激,造成细胞凋亡[21]。一般情况下,机体中存在的SOD 等抗氧化系统可通过清除氧自由基对抗氧化应激,清除线粒体氧化还原过程中产生的ROS[22]。在炎症方面,有研究发现Dioscin 通过改善氧化应激、细胞凋亡来减轻二甲基亚硝胺(DMN)诱导的急性肝损伤[23];在肿瘤方面,已有文章阐明Dioscin 可促进ROS 介导的p38-MAPK/HSP27 信号途径来诱导肺鳞癌细胞的凋亡[24]。本研究表明了Dioscin 可通过ROS 介导的氧化应激来激活线粒体途径的结肠癌细胞凋亡。
PI3K/Akt 是氧化应激的主要途径之一,跟细胞凋亡相关的PI3K/Akt 信号转导的下游靶点为Nrf2[25]。Nrf2 是一个监控机体氧化应激的重要转录因子,在正常生理条件下,Nrf2 通过与Keap1 结合来维持稳定状态,但在蛋白激酶的作用下,Nrf2 可以和Keap1解离转入细胞核内,并识别ARE 序列以激活后续的SOD 等多种抗氧化蛋白酶[26],进而消除有害物质使ROS 失活。Western 印迹结果表明,加药后抗氧化蛋白Nrf2、p-Akt 表达下调,说明Dioscin 可能通过PI3K/Akt/Nrf2 信号通路抑制SOD 表达,使细胞超氧化物含量及ROS 升高,进而激活后续的线粒体相关凋亡途径。
针对胆囊癌的研究证实Dioscin 可通过ROS介导的PI3K/Akt 信号转导诱导胆囊癌细胞凋亡[27]。对于Dioscin 有关结肠癌的相关研究中,有文章表明Dioscin 可通过P38 和JNK 途径抑制肿瘤生长[10]。本研究提示Dioscin 可能通过抑制PI3K/Akt/Nrf2信号通路来介导ROS 蓄积从而激活下游的线粒体途径诱导细胞凋亡。目前还有研究表明Dioscin 还可通过铁死亡[28]、细胞焦亡[29]等方式来延缓其他疾病进展,故而对于Dioscin 治疗结肠癌的更多机制研究,还有待进一步发现。
综上所述,Dioscin 可能通过PI3K/Akt/Nrf2 信号通路介导氧化应激发挥作用,抑制人结肠癌HCT-116 细胞及RKO 细胞生长并诱导其凋亡,进一步证明了Dioscin 的抗结肠癌作用,为其对结肠癌的临床应用提供了理论和实验依据。
