CD155 依赖m6A 修饰调控宫颈癌细胞的恶性行为
2022-09-28祁小珍石立莹
祁小珍,石立莹
(天津医科大学基础医学院病原生物学教研室 天津 300070)
宫颈癌与乳腺癌、结直肠癌和肺癌是全球女性四大常见癌症[1]。近几十年研究表明,表观遗传学中RNA 转录组学在癌症中发挥重要作用[2-3]。
N6-甲基腺苷(m6A)作为真核信使RNA 中最丰富的修饰,在生物的各种进程中发挥关键性作用,其甲基化转移酶复合物由METTL3、METTL14、WTAP、RBM15 和KIAA1429 等组成[4]。其中METTL3 是甲基化转移酶复合物中起主要作用的催化亚基。最近的研究显示,METTL3 与宫颈癌的恶性行为及不良预后相关[5]。YTHDF1 属于YTH 结构域蛋白家族,是识别m6A 修饰位点重要的阅读器(Reader),主要功能是识别RNA 上m6A 修饰位点,增强RNA的稳定性及提高RNA 翻译效率。
脊髓灰质炎病毒受体CD155(PVR)在多数正常组织中低表达而在癌组织中高表达,如结肠癌、肺腺癌、黑色素瘤和胰腺癌等[6-9]。最近有文章报道,CD155 的异常表达与宫颈癌的恶性行为和不良预后相关,但CD155 在宫颈癌细胞中异常表达的调控机制还有待研究。因此,本文从转录组的方向出发,初步探究在宫颈癌细胞中CD155 mRNA 甲基化后的表达调控机制。
1 材料和方法
1.1 细胞培养和细胞转染 人宫颈癌细胞HeLa 和S12 细胞均购买于ATCC 细胞库,HeLa 细胞培养液是含有6%胎牛血清(FBS)、100 μg/mL 链霉素和100 IU/mL 青霉素的RPMI1640(Gibco),细胞培养在37℃、5%CO2的培养箱中,在细胞密度达到80%时进行传代培养。取对数生长期细胞,以1×105个/mL密度接种至24 孔板,每孔加入250 μL 无血清培养基。在细胞密度达到70%~80%时,参照脂质体2000试剂使用说明进行转染。
1.2 质粒的构建 分别构建CD155 过表达质粒pCNAD3-Flag/CD155 和敲降质粒pSilencer-shR/CD155(pshR-CD155),其对照组分别是PCDNA3-Flag 和pSilencer-NC,构建质质粒所用引物见表1。
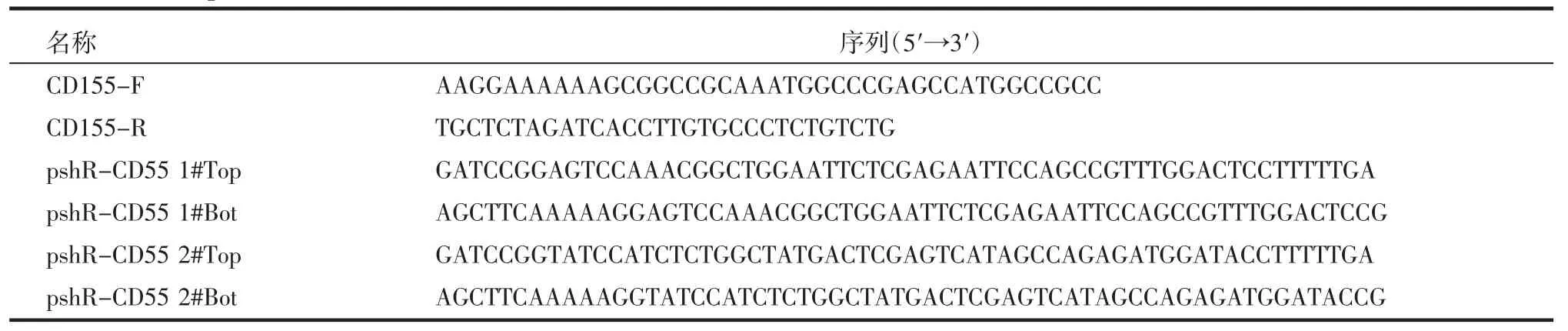
表1 引物序列Tab 1 Primer sequences
1.3 Western 印迹实验 HeLa 细胞转染过表达和敲降CD155 质粒及其对照质粒48 h 后,RIPA 裂解细胞制备蛋白样品,将蛋白样品在10%的SDSPAGE 胶上电泳分离后,转移至甲醇预先激活的PVDF 膜上,5%脱脂牛奶在室温下封闭2 h,一抗Anti-Ecad 4℃孵育过夜,TBST 洗膜4 次,二抗羊抗兔在常温孵育2 h,TBST 洗膜4 次,加入发光液室温孵育1 min 后,进入暗室曝片,根据条带深浅选择合适的曝光时间。
1.4 细胞增殖和克隆实验 按预定分组转染细胞,24 h 后将细胞以6×103个/mL 的密度接种到96 孔板中,每个组设置5 个复孔,分别培养24、48、72 h后向每个孔中加入10 μL MTT,6 h 后吸弃MTT 后加入100 μL DMSO,摇床震荡10 min 后使用酶标仪检测490 nm 和570 nm 处每个孔的光密度(OD)值,进行3 次独立重复实验后取平均值进行t 检验分析。克隆形成实验预实验后,细胞消化计数,将5×102个细胞接种到12 孔板中,每个分组3 个复孔,在完全培养液中培养14 d,然后弃去培养液,使用结晶紫染色10 min,冲洗干净后进行计数,使用Image J 计数并进行分析。
1.5 细胞的迁移实验 细胞转染24 h 后,消化收集细胞,取6×104个细胞,离心后弃净培养液,使用200 μL 无血清培养液重悬后加入小室的上方,同时在小室下方的培养板里加入800 μL 10%的1640完全培养液。放入37℃、5%CO2的培养箱中,36 h 后弃去上层液体,加入甲醇固定,室温固定30 min 后弃去甲醇,在结晶紫中染10 min,冲洗干净,用棉签擦去上室表面的残余细胞,晾干后取出膜,用中性树脂封片并晾干,在正置显微镜下计数细胞,随机照取5 张图片,计数迁移细胞数目。
1.6 细胞侵袭实验 将50 μL Matrigel 基质胶加入300 μL 无血清1640 培养基中充分吹打混匀,取50 μL 混合液平铺在小室内,4℃放置30 min,37℃、5%CO2的培养箱放置过夜,取8×104个细胞,离心后弃净培养液,使用200 μL 无血清培养液重悬后加入小室的上方,同时在小室下方的培养板里加入800 μL含10%血清的1640 完全培养液。放入37℃、5%CO2的培养箱中,36 h 后弃去上层液体,加入甲醇,室温固定30 min,弃去甲醇,在结晶紫中染10 min,冲洗干净,用棉签擦去上室表面的残余细胞,晾干后取出膜,用中性树脂封片并晾干,正置显微镜下观察,随机照取3 张图片,计数侵袭细胞数目。
1.7 RNA 免疫共沉淀实验和实时定量逆转录聚合酶链式反应(qRT-PCR)使用RIP 试剂盒,按照说明书进行实验,得到3 组产物:总RNA(input-RNA)、m6A 抗体特异性捕获的CD155RNA(m6A-ip-RNA)、IgG 抗体吸附的非特异性RNA(IgG-ip-RNA)。Nanopdrop2000 测定RNA 浓度后,进行qRT-PCR,计算3 组中CD155 表达的相对定量,实验重复3 次。
使用TRIzol 试剂提取细胞及其他转染组细胞的总RNA,使用Nanodrop 2000 测定RNA 浓度以及OD260/OD280 的比值,将RNA 逆转录成cDNA 进行实验,同时做3 个复孔取平均值,以β-actin 为内参,以2-△△Ct计算CD155 表达的相对定量,实验重复3 次,RT-qPCR 所用引物如表2。
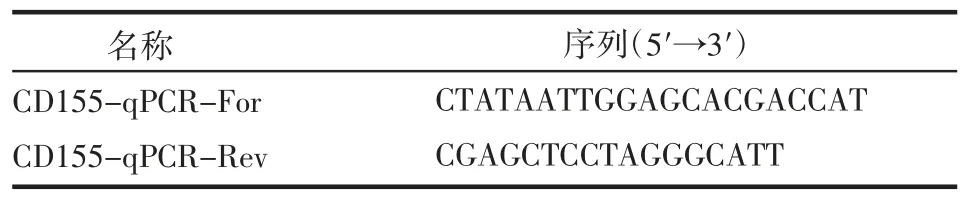
表2 qRT-PCR 引物Tab 2 qRT-PCR primers
1.8 生物信息学网站 KM-Plotter(http://kmplot.com/analysis/index.php?p=service)、TCGA(http://www.cbioportal.org/)预测CD155 的预后,GEPIA(http://gepia.cancer-pku.cn/index.html)预测宫颈癌组织中CD155的表达情况,m6ATarget [m6A2Target(canceromics.org)]数据库在线预测CD155 的识别者。
1.9 统计学处理 采用GraphPad Prism 和ImageJ软件对所得3 次重复数据进行分析和作图,数据均符合正态分布,采用t 检验进行统计分析,P<0.05 差异有统计学意义。
2 结果
2.1 CD155 在宫颈癌中呈现高表达 与癌旁组织相比,宫颈癌组织中的CD155 有较高水平(图1A),并且高水平的CD155 表达与宫颈癌不良预后相关(图1B、1C)。在宫颈癌和非宫颈癌细胞系中进行RT-qPCR,检测CD155 的RNA 水平。结果显示,相比于非宫颈癌永生细胞S12,宫颈癌细胞系HeLa、C33A 中CD155 有较高水平的表达(t=3.749,P<0.05),见图1D。
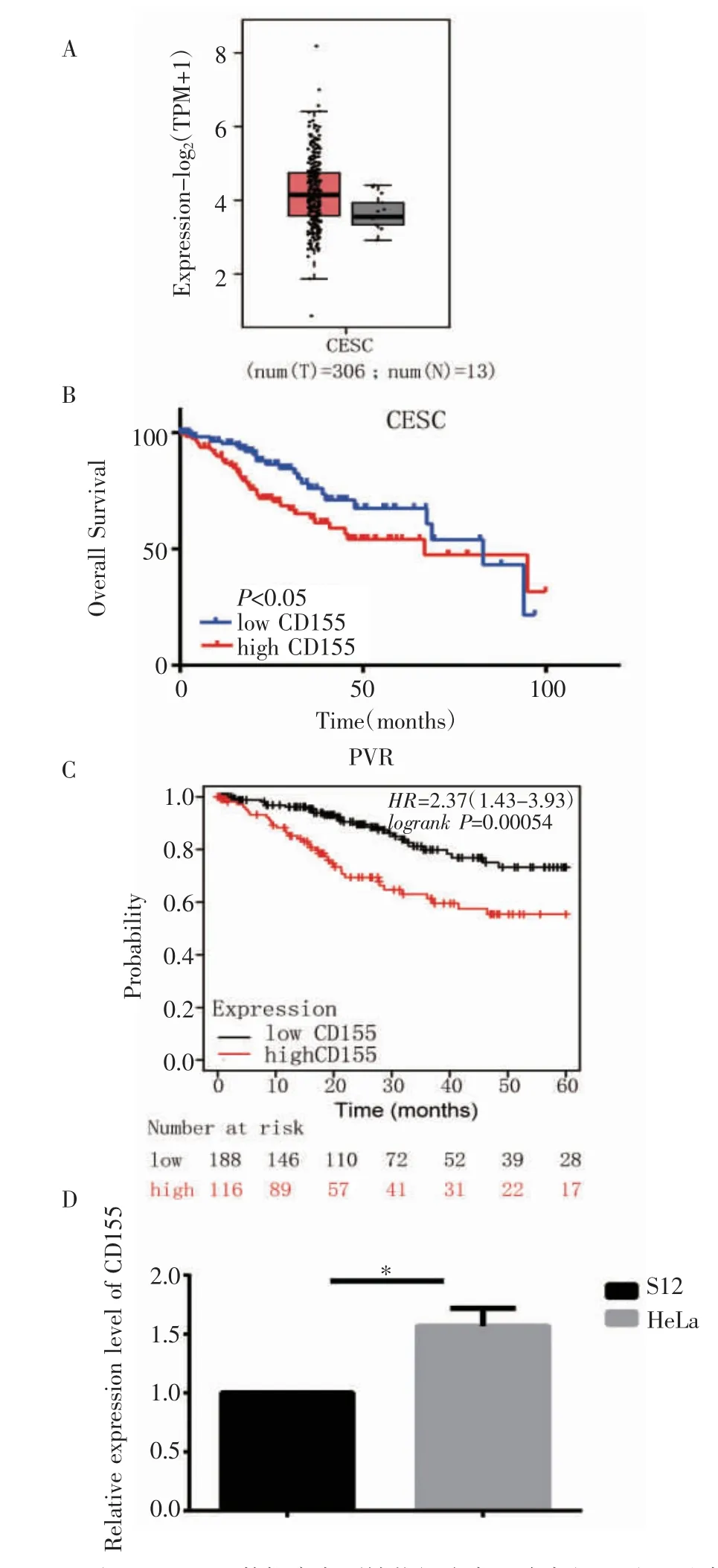
图1 CD155 在宫颈癌组织和细胞中的表达情况Fig 1 Expression of CD155 in cervical cancer tissues and cells
2.2 CD155 提高HeLa 细胞存活率,使细胞克隆形成增加 Western 印迹实验证明,CD155 过表达质粒pCD3-Flag/CD155 和CD155 敲降质粒pshRCD155 1#和pshR-CD155 2#是有效的(图2A、2B)。选取效果最好的敲降质粒pshR-CD155 2#进行接下来的实验。过表达CD155 或者敲降CD155 后,与对照组相比,细胞存活率表现为升高或降低(图2C,t=3.152,P<0.05)。克隆形成实验结果显示,过表达或敲降CD155 后,细胞增殖能力增强或减弱(图2D,t=3.706,P<0.05)。
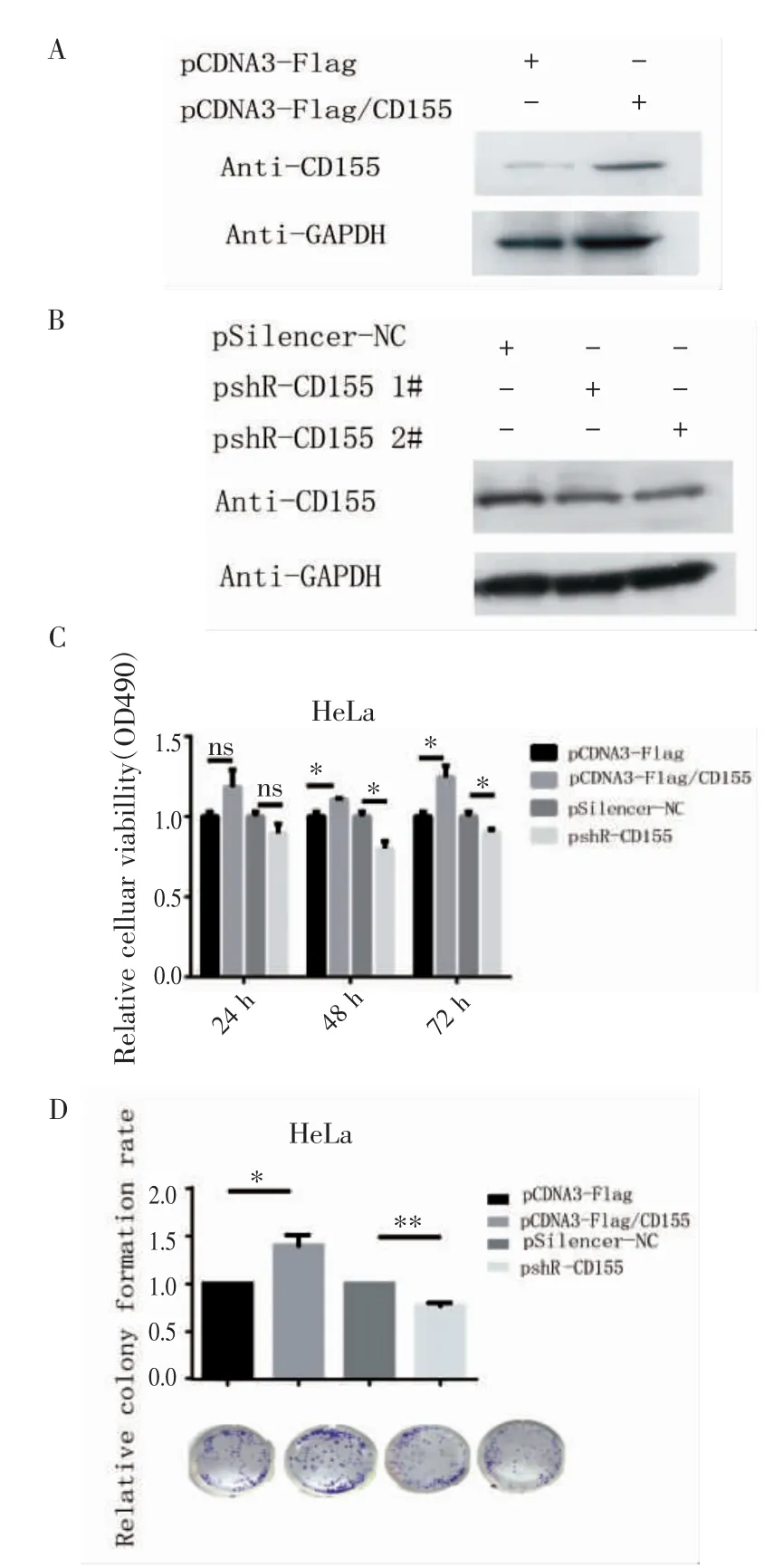
图2 CD155 对HeLa 细胞生长和增殖能力的影响Fig 2 The effect of CD155 on the growth and proliferation of HeLa cells
2.3 CD155 增强HeLa 细胞的迁移和侵袭能力,促进HeLa 细胞的EMT 进程 过表达或敲降CD155质粒转染细胞后,进行小室迁移实验,结果显示,与对照组相比,转染过表达CD155 质粒后细胞的迁移能力增强,敲降CD155 后与对照组相比,细胞的迁移能力减弱(图3A,t=5.422,P<0.01)。在铺设matrigel的小室内进行小室迁移实验,与对照组相比,过表达CD155 后穿过小室的细胞增多,敲降CD155 后穿膜细胞相对减少(图3B,t=3.599,P<0.05)。过表达CD155 后,E-cad 表达降低,Vimentin 表达升高,敲降CD155,E-cad 表达升高,Vimentin 表达降低(图3C,t=3.599,P<0.05)。
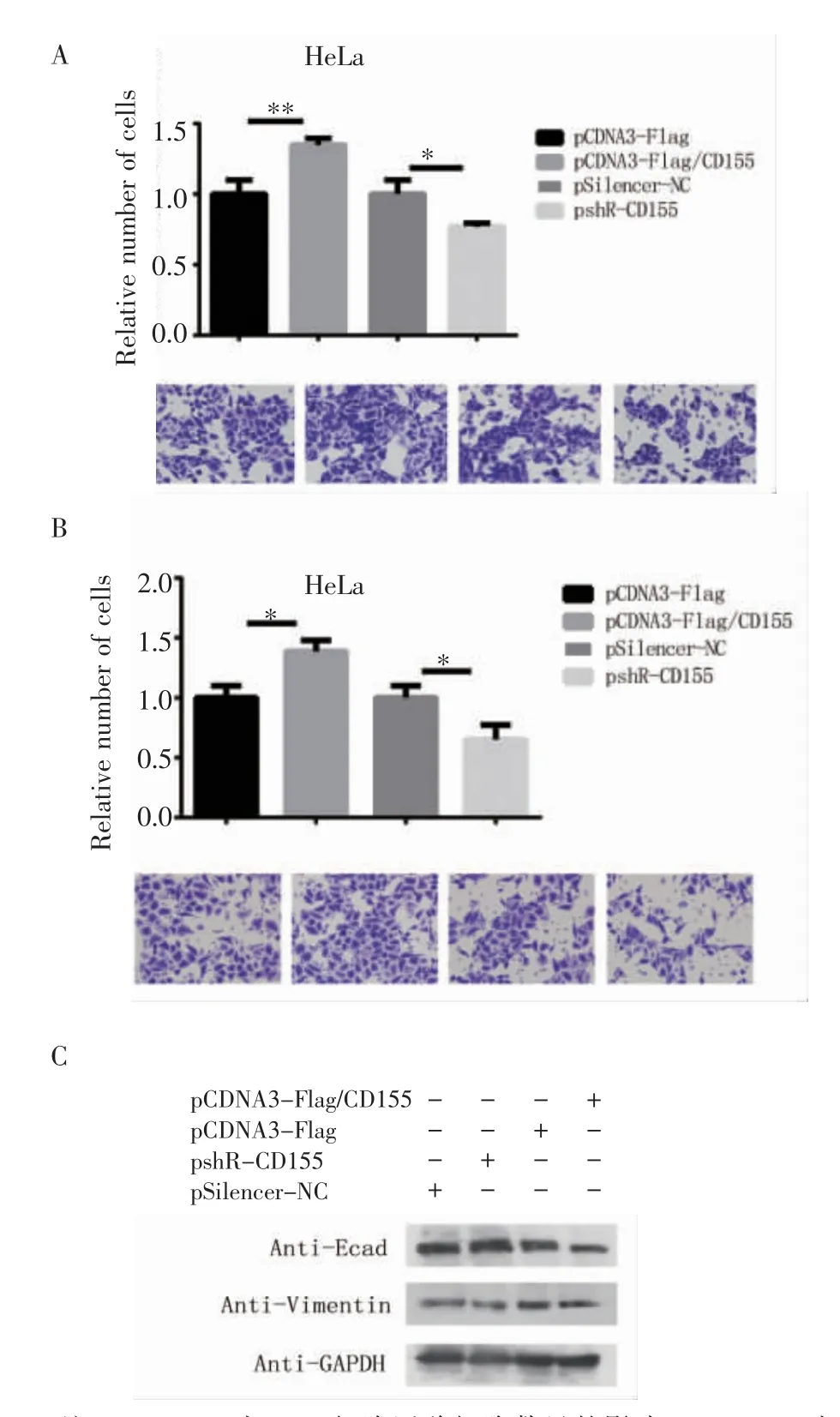
图3 CD155 对HeLa 细胞迁移、侵袭能力和细胞EMT 进程的影响Fig 3 The effect of CD155 on HeLa cell migration,invasion ability and cellular EMT process
2.4 宫颈癌细胞中CD155 的表达受m6A 修饰调控敲降METTL3 质粒和它的对照质粒转入HeLa 细胞中,之后进行MeRIP-RT-qPCR 实验,与对照组相比,敲降METTL3 后免疫沉淀物中的CD155 RNA 的富集明显减少(图4A)。当METTL3 过表达或敲降时,CD155 的RNA(t=6.725,P<0.05)和蛋白水平也随之升高或降低(图4B、4C)。敲降METTL3 后,CD155RNA 的半衰期降低(图4D,t=5.622、6.063、5.857,均P<0.05)。
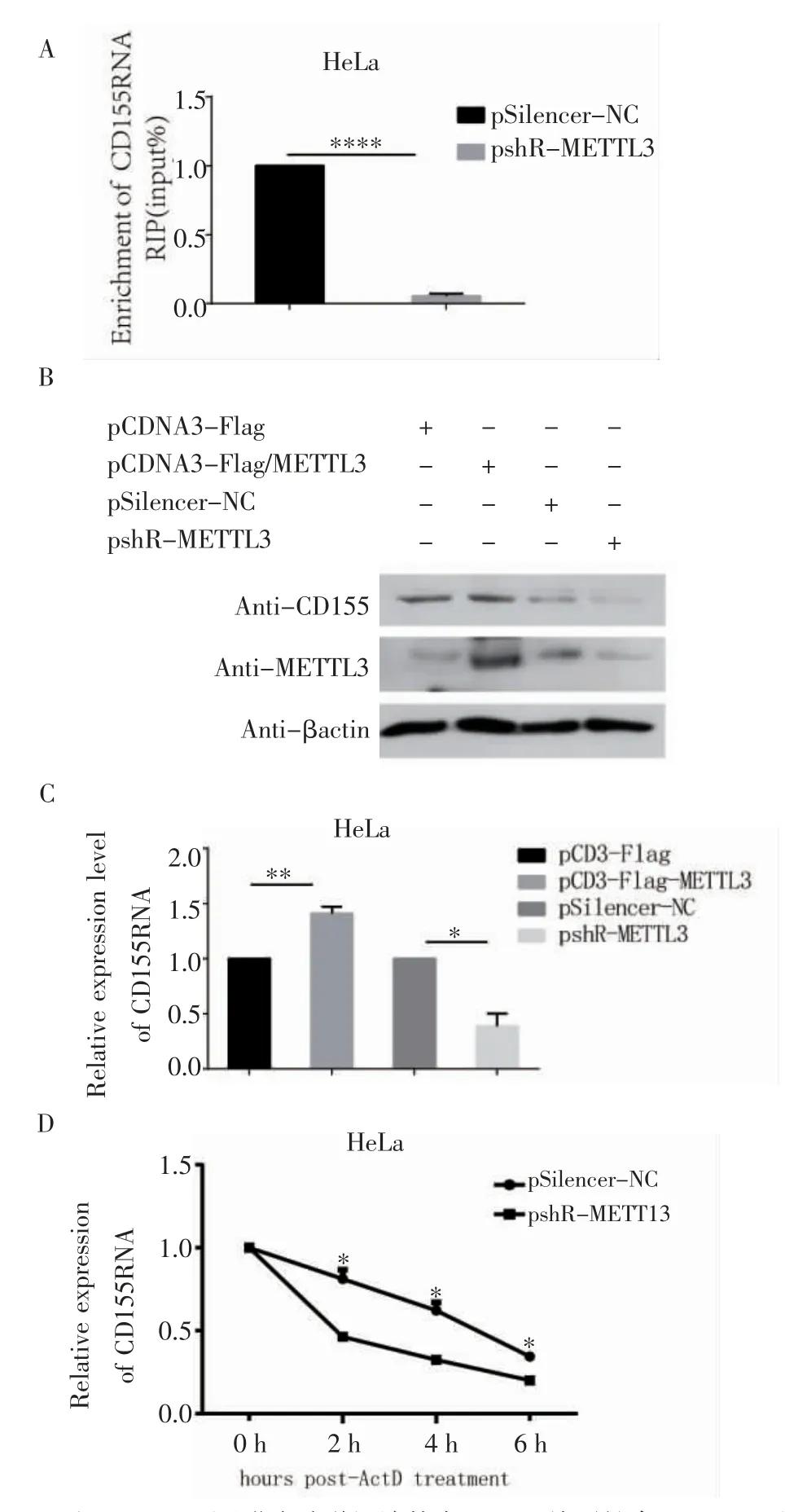
图4 宫颈癌细胞中CD155 的表达受m6A 修饰调控的验证Fig 4 Verification that the expression of CD155 in cervical cancer cells is regulated by m6A modification
2.5 CD155 甲基化后Reader 的鉴定 结果显示,CD155 甲基化后的阅读器可能是YTHDF1 和YTHDF3(图5A),与对照组相比,YTHDF1 比YTHDF3 明显促进了CD155 蛋白的表达(图5B)。与对照组相比,过表达或敲降YTHDF1,CD155 蛋白的表达随之增加或减少(图5C)。与对照组相比,敲降YTHDF1 后细胞中CD155RNA 的半衰期呈现降低趋势(图5D,t=10.93、5.602、4.359,均P<0.05)。pCD3-Flag/YTHDF1 和pCD3-Flag/YTHDF1mut 质粒都是有效的(图5E),进行RIP-RT-qPCR 实验,结果显示,和对照组相比,YTHDF1 组有效富集了CD155 的RNA(t=4.686,P<0.01),但YTHDF1 mut组中CD155RNA 的富集程度不如YTHDF1 组(图5F,t=4.462,P<0.05)。
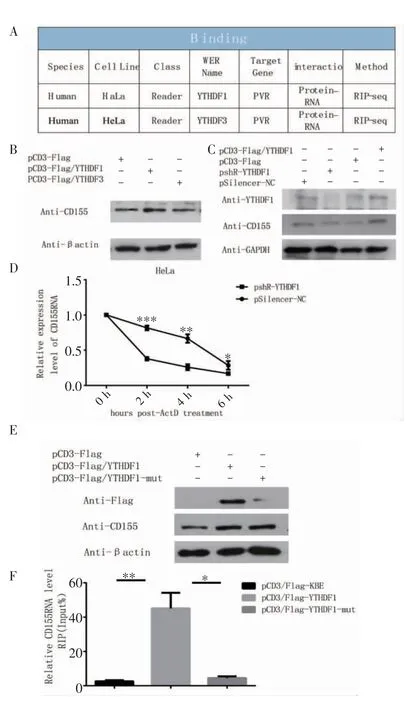
图5 CD155 甲基化后Reader 的鉴定Fig 5 Identification of Reader after CD155 methylation
3 讨论
m6A 的异常修饰在肿瘤进程中有着重要的作用,m6A 修饰参与肝癌和乳腺癌等的迁移侵袭进程[10-12]。m6A 修饰也参与乳腺癌与子宫内膜癌等的增殖进程[13-14]。宫颈癌的相关发病机制是一个非常复杂和多种因素相互作用的结果,研究表明CD155可以作为宫颈癌不良预后的指标[15]。本研究发现了一个有意义的机制,即m6A 可能与CD155 一起参与宫颈癌的发病机制。
目前有研究显示CD155 在多种肿瘤中高表达并且促进肿瘤的恶性行为,例如CD155 在肺腺癌、卵巢癌和胶质瘤等癌症中表达异常升高[16-18]。本实验证明CD155 促进宫颈癌细胞的恶性行为,这与目前CD155 与肿瘤关系的研究结果一致。METTL3 在宫颈癌中的作用在目前的文献中说法不一,有的文献显示宫颈癌中METTL3 的表达升高并且抑制癌症的进程[19],有的文献显示METTL3 的表达升高并促进宫颈癌的进程[20-21]。本研究结果表明宫颈癌细胞中METTL3 表达较高。
为了探究CD155 在转录水平上的调控机制,实验证明METTL3 使CD155RNA 上的甲基化修饰增加,敲降METTL3 后Western 印迹和RT-qPCR 结果显示CD155RNA 的翻译效率降低,CD155RNA 稳定性降低。本研究结果表明METTL3 使CD155RNA的m6A 修饰增加,进而促进CD155 的表达和增强CD155 的稳定性。目前的研究表明,RNA 被m6A 修饰后,有不同阅读器识别相应的m6A 位点,决定RNA 的稳定性以及翻译效率[22]。本研究通过预测及实验证明CD155 的阅读器是YTHDF1,并且YTHDF1 依赖m6A 修饰位点促进CD155 的表达,这种模式符合m6A 修饰调控方式。最后通过挽救实验进一步证明METTL3 通过调控CD155 的表达,促进宫颈癌细胞的恶性行为。
总之,本研究说明了METTL3 能够使CD155 RNA上的m6A 甲基化修饰增加,进而有YTHDF1 识别m6A甲基化位点促进CD155 的表达。未来还可以通过测序进一步找出CD155RNA 上的甲基化修饰位点。
