miR-501通过下调eIF4E3促进胃癌细胞增殖、迁移和侵袭
2022-09-28黄金丽关宏伟黄玉红张晴晴
黄金丽,关宏伟,卢 颖,侯 力,黄玉红,张晴晴,宋 波
2018年最新统计显示,我国胃癌死亡人数约占全球胃癌死亡的一半[1]。单链非编码microRNAs(miRNAs)长度为19~25个核苷酸,其可结合相关靶基因mRNA的3′-UTR区域,改变mRNA的稳定性或调控其翻译。编码hsa-miR-501-5p(miR-501)的基因位于X染色体上,有文献报道miR-501在胃癌细胞和组织中表达增高[2-3],可靶向Wnt/β-catenin信号通路的抑制因子DKK1、NKD1和GSK3β,促进胃癌干细胞样表型,与胃癌较差的预后有关[2],也可靶向LPAR1促进胃癌细胞增殖和迁移[3]。eIF4E3是真核翻译起始因子4E家族的第3个成员,现有研究提示eIF4E3在急性髓细胞白血病(acute myeloid leukemia,AML)、头颈部鳞状细胞癌(squamous cell carcinoma of head and neck,HNSCC)中起抑癌作用[4-5],eIF4E3高表达也与乳腺癌良好生存率有关[6]。经miRNA分析软件TargetScan预测,eIF4E3是miR-501的潜在靶点。因此,miR-501可能通过下调eIF4E3表达,参与调控胃癌细胞的恶性生物学行为。本文通过体外细胞实验探讨miR-501对胃癌细胞增殖、迁移和侵袭能力的影响及其对eIF4E3表达的靶向调控,以期为胃癌诊断、治疗提供新的潜在靶点。
1 材料与方法
1.1 材料人胃黏膜上皮细胞GES-1和胃癌MGC-803细胞,购自上海生命科学研究院细胞资源中心。SGC-7901细胞由空军军医大学西京医院消化内科惠赠,BGC-823细胞为大连医科大学解剖学教研室李岩教授赠予。RPMI-1640、DMEM高糖培养基和胎牛血清(FBS),均购自美国Gibco公司。Lipofectamine 2000、TRIzol试剂、eIF4E3引物,购自美国Invitrogen公司。miR-501 mimic购自广州锐博生物公司;siRNA eIF4E3购自苏州吉玛基因公司;eIF4E3 3′-UTR野生型及突变型载体,购自上海吉凯基因公司。miR-501引物购自美国Applied Biosystems公司;eIF4E3多克隆抗体购自美国Signalway Antibody(SAB)公司;Taqman MicroRNA Reverse Transcription Kit和TaqMan Universal Master Mix II,购自美国Applied Biosystems公司。PrimeScript RT Reagent Kit和TB Green Premix Ex Taq II,均购自大连Takara公司。双荧光素酶报告系统,购自美国Promega公司。
1.2 脂质体介导的细胞转染(1)实验分组:miR-501 mimic组(miR-501)和miRNA无关序列对照组(NC);eIF4E3敲低组(eIF4E3-si)和siRNA无关序列对照组(NCi)。(2)BGC-823细胞按照3×105个/孔铺至6孔板中,待细胞生长密度达60%~70%时,利用Lipofectamine 2000将终浓度为100 nmol/L的miR-501 mimic或siRNA eIF4E3转入细胞,6 h后加入20%FBS。细胞转染24 h后提取RNA,48 h后提取蛋白。
1.3 qRT-PCR检测miR-501和eIF4E3 mRNA表达水平TRIzol试剂提取总RNA,按试剂盒说明反转录生成cDNA,在Agilent MX3005p上进行荧光定量PCR。U6为miR-501的内参,β-actin为eIF4E3的内参,采用2-ΔΔCt方法计算miR-501和eIF4E3 mRNA相对表达量。miR-501(Applied Biosystems公司,批号:P161011-002 H09),U6(Applied Biosystems公司,批号:P160808-004 E06);eIF4E3引物序列:正向引物:5′-CTGGGTCAAAGTCCAGAGGA-3′,反向引物:3′-CATAAGACCCGGTGAGCAGT-5′;β-actin引物序列:正向引物:5′-GGGAAATCGTGCGTGACATT-3′,反向引物:3′-GGAACCGCTCATTGCCAAT-5′。
1.4 Western blot检测eIF4E3蛋白表达收集细胞提取蛋白,每组上样40 μg,采用12%SDS-PAGE凝胶电泳,转膜后5%脱脂奶粉封闭2 h,一抗eIF4E3(1 ∶200)孵育,4 ℃过夜,β-tubulin(1 ∶500)为内参。山羊抗兔或抗鼠荧光二抗(1 ∶16 000)37 ℃孵育1 h。Odessey红外荧光成像仪扫膜成像。
1.5 细胞增殖活性检测(1)CCK-8实验:转染细胞以3×103个/孔接种到96孔板中,分别培养1、2、3、4、5天后,每孔加入10 μL CCK-8试剂,孵育2 h后酶标仪检测各孔450 nm处光密度值,绘制细胞增殖曲线。(2)细胞克隆形成实验:将转染细胞(1×103个/孔)接种到6孔板中,每2天更换新鲜培养基,14天后4%多聚甲醛固定15 min,1%结晶紫染色30 min,计数并拍照。
1.6 Transwell小室实验检测细胞迁移和侵袭能力Transwell小室侵袭实验用无血清培养基按1 ∶4稀释基质胶,将转染细胞(5×104个)加入上室,下室加入600 μL含10%血清培养基,12 h后甲醇固定20 min,1%结晶紫染色30 min,100倍显微镜下随机选取5个视野计数。Transwell小室迁移实验时上室不用基质胶包被,直接将转染细胞消化计数后加入上室。
1.7 双荧光素酶检测miR-501与eIF4E3的靶向关系化学合成含miR-501结合位点的eIF4E3 mRNA 3′-UTR野生型(wt)和突变型(mut)双链寡核苷酸,通过XhoI-XbaI酶切位点插入pmiRGLO载体中。293T细胞(5×104个)铺于24孔板中,过夜后利用Lipofectamine 2000转染细胞进行实验分组。(1)野生组:eIF4E3-wt和miR-501共转染;(2)野生对照组:eIF4E3-wt和NC共转染;(3)突变组:eIF4E3-mut和miR-501共转染;(4)突变对照组:eIF4E3-mut和NC共转染。同时转染pRL-TK Renilla质粒作为发光内参。转染48 h后采用Dual-Luciferase Reporter Assay System检测细胞荧光素酶活性。每孔荧光素酶相对活性=每孔萤火虫/Renilla(发光值),对照组表达量化为1,野生组和突变组分别与其对照组进行比较。
1.8 生物信息学分析miR-501和eIF4E3在正常胃组织和胃癌组织中的表达利用TCGA(The cancer genome atlas)数据库,比较miR-501和eIF4E3 mRNA在正常胃组织和胃癌组织中的表达差异。
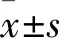
2 结果
2.1 胃癌细胞和组织中miR-501的表达通过qRT-PCR检测内源性miR-501在胃癌细胞系中的表达水平,结果发现胃癌细胞SGC-7901、BGC-823和MGC-803中miR-501表达水平分别是正常胃黏膜上皮细胞GES-1的2.78±0.28、2.51±0.30和1.62±0.14倍(P<0.05,图1A)。利用TCGA数据库比较387例胃癌组织中miR-501表达与40例正常胃组织的差异,结果发现miR-501在胃癌组织中的表达显著高于正常胃组织(P<0.001,图1B),提示miR-501高表达可能与胃癌发生有关。

图1 miR-501在胃癌细胞和组织中的表达:A.与正常胃黏膜上皮细胞GES-1比较;B.与正常胃组织比较(TCGA数据库),*P<0.05,**P<0.01,***P<0.001
2.2 miR-501对胃癌BGC-823细胞增殖的影响CCK-8实验结果显示,与阴性NC组相比,miR-501 mimic转染的BGC-823细胞培养5天后在450 nm处的吸光度值明显增高(23.03%±4.60%)(P<0.01,图2A)。细胞克隆形成实验结果显示,miR-501组BGC-823细胞的克隆集落数为(513±41)个,高于NC组的(357±17)个(P<0.05,图2B),提示miR-501可增强胃癌细胞的增殖活性。
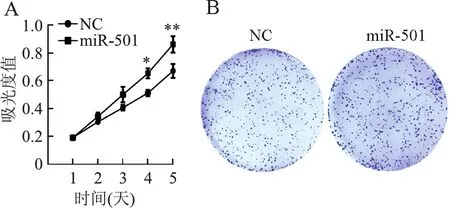
图2 miR-501可促进BGC-823细胞增殖能力:A.CCK-8实验;B.细胞克隆形成实验;与NC组比较,*P<0.05,**P<0.01
2.3 miR-501对胃癌BGC-823细胞迁移和侵袭的影响Transwell小室迁移实验结果显示,转染miR-501的BGC-823细胞穿膜数为(587±16)个,高于NC组的(396±34)个(P<0.05,图3A)。Transwell小室侵袭实验结果显示,miR-501组BGC-823细胞穿膜数为(553±43)个,高于NC组的(398±21)个(P<0.05,图3B),提示miR-501可促进胃癌细胞的迁移和侵袭能力。

图3 miR-501可促进BGC-823细胞迁移和侵袭能力:A.Transwell小室迁移实验;B.Transwell小室侵袭实验;与NC组比较,*P<0.05
2.4 miR-501与eIF4E3的靶向调控关系利用TargetScan(www.targetscan.org)数据库预测eIF4E3 mRNA 3′-UTR区域包含有与miR-501结合的位点(AAAGGAT)(图4A),将包含miR-501预测结合位点的eIF4E3 mRNA 3′-UTR野生型(eIF4E3-wt)或突变型(eIF4E3-mut)寡核苷酸序列插入pmiRGLO载体,进行双荧光素酶报告基因实验。结果显示:与共转染miRNA无关序列和eIF4E3-wt相比,共转染miR-501和eIF4E3-wt的293T细胞中,荧光素酶活性降低(44.86%±4.82%)(P<0.01),而共转染miR-501和eIF4E3-mut则荧光素酶活性无明显改变(图4B),表明eIF4E3是miR-501的直接靶点。
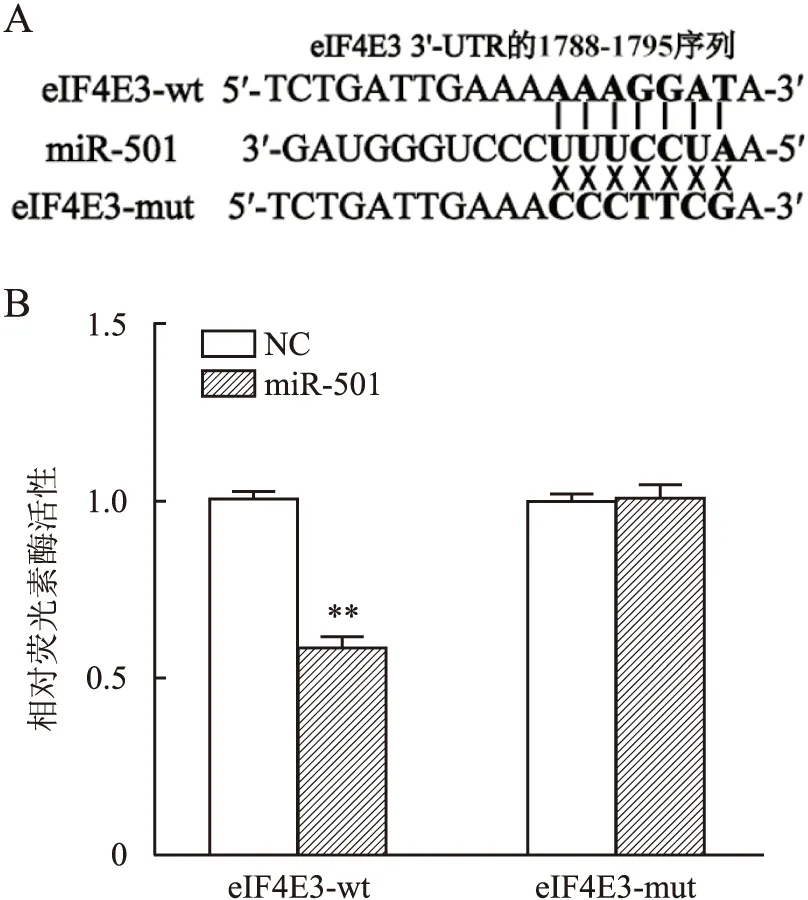
图4 miR-501可靶向调控eIF4E3:A.eIF4E3 mRNA 3′-UTR与miR-501结合位点示意图,eIF4E3-wt为野生型,eIF4E3-mut为突变型;B.双荧光素酶报告基因实验,**P<0.01
2.5 miR-501对eIF4E3 mRNA和蛋白表达的影响为了进一步揭示miR-501和eIF4E3之间的调控关系,通过qRT-PCR和Western blot法检测eIF4E3 mRNA和蛋白表达。与NC组相比,miR-501过表达可使BGC-823细胞eIF4E3 mRNA水平降低(40.78%±5.93%)(P<0.05),与阳性对照eIF4E3-si组趋势一致(图5A);BGC-823细胞转染miR-501后eIF4E3蛋白表达也显著减少,与eIF4E3-si组趋势保持一致(图5B),表明miR-501可在转录后水平负调控eIF4E3表达。

图5 miR-501可下调eIF4E3 mRNA和蛋白表达:A.qRT-PCR实验;B.Western blot实验;*P<0.05,**P<0.01
2.6 敲低eIF4E3对胃癌细胞增殖、迁移和侵袭的影响及eIF4E3 mRNA在胃癌组织中的表达本组利用针对eIF4E3的siRNA转染BGC-823细胞以敲低eIF4E3表达。CCK-8实验显示:与转染siRNA无关序列(NCi)组相比,eIF4E3敲低可显著增强BGC-823细胞的增殖活性,450 nm处光密度值增加了24.62%±5.34%(P<0.01,图6A)。同时细胞克隆形成实验显示:eIF4E3敲低可使BGC-823细胞的克隆形成数量为(546±55)个,明显增多;而NCi组为(357±17)个(P<0.05,图6B)。Transwell小室迁移实验显示:与NCi组的穿膜细胞数(182±13)个相比,eIF4E3-si组的穿膜细胞数为(299±32个),明显增多(P<0.01)。Transwell小室侵袭实验也呈相同趋势,eIF4E3-si组的穿膜细胞数为(271±14)个,多于NCi组的(166±21)个(P<0.01,图6C)。这些结果表明,eIF4E3敲低可促进胃癌细胞增殖、迁移和侵袭能力。通过TCGA数据库比较eIF4E3 mRNA在415例胃癌组织和34例正常胃组织中的表达差异,结果发现eIF4E3 mRNA在正常胃组织中的表达显著高于胃癌组织(P<0.001,图6D),提示eIF4E3低表达可能与胃癌发生有关。
图6 敲低eIF4E3可促进胃癌细胞增殖、迁移和侵袭,eIF4E3 mRNA在胃癌组织中表达降低:A.CCK-8实验;B.细胞克隆形成实验;C.Transwell小室实验;D.TCGA数据库分析eIF4E3 mRNA表达水平;*P<0.05,**P<0.01,***P<0.001
3 讨论
胃癌是常见的消化道恶性肿瘤,病死率仅次于肺癌[1,7],严重威胁患者健康。因此,探讨胃癌发生、发展的分子机制,寻找诊断的生物学标志物和有效的治疗靶点,对于改善胃癌患者预后是非常必要的。
本组前期研究发现,miR-501在子宫颈癌组织中表达增高,其高表达与子宫颈癌分化程度、原发瘤大小、FIGO分期和淋巴结转移有关,miR-501可通过靶向下调抑癌基因CYLD,激活其下游的NF-κB p65促进子宫颈癌细胞的增殖、迁移和侵袭能力[8]。本文探讨miR-501在胃癌细胞恶性表型中的作用及其通过靶向下调eIF4E3的表达,发挥促癌作用的分子机制。本实验结果显示miR-501在胃癌细胞和组织中表达明显增高,miR-501过表达可明显促进胃癌细胞的增殖活性以及迁移和侵袭能力。Fan等[2]报道miR-501在胃癌细胞和组织中表达上调,是胃癌患者预后差的预测因子。另有文献报道miR-501在肝癌[9-10]、肺腺癌[11]、HNSCC组织[12]中过表达,且与肺腺癌高TNM分期相关[11]。近期有学者发现miR-501可促进结直肠癌细胞增殖和对5-FU耐药[13]。这些研究表明miR-501可能具有促癌作用,本组结果与文献报道一致。
目前,文献对eIF4E3的研究较少[14-15],其在胃癌中的作用尚不清楚。现有的研究提示其与eIF4E1不同[16],eIF4E3可起抑癌基因作用。Borden课题组首先报道,在AML标本中eIF4E3表达显著降低[4];有文献报道eIF4E3在HNSCC中表达缺失[5];一项关于乳腺癌的研究发现,eIF4E3高表达与乳腺癌更好的生存率相关[6]。本实验通过双荧光素酶报告基因实验证实eIF4E3是miR-501的直接靶点,miR-501可在转录后水平负调控eIF4E3蛋白表达,eIF4E3沉默可增强胃癌细胞增殖、迁移和侵袭能力,eIF4E3 mRNA在胃癌组织中表达显著低于正常胃组织。在AML和HNSCC中研究者发现eIF4E3表达与eIF4E1呈负相关,eIF4E3具有特殊识别m7G帽子结构的新作用机制,可抑制VEGF、c-Myc、Cyclin D1和NBS1 mRNA的表达,而这些通常是eIF4E1的下游因子,推测eIF4E3可能与具有促增殖作用的eIF4E1产生竞争,通过抑制eIF4E1功能而起到抑癌作用[4,17]。最近有文献报道miR-1298可通过靶向eIF4E3,抑制TGF-β/Smad通路和激活Wnt通路,抑制氧化损伤[18]。
综上所述,miR-501在胃癌细胞和组织中表达增高,miR-501可增强胃癌细胞增殖、迁移和侵袭能力,其可能是通过靶向下调抑癌基因eIF4E3表达而实现的。因此,miR-501有望成为胃癌治疗的潜在候选靶点。
