肾脏双相型乳头状肾细胞癌的临床病理及分子学特征
2022-09-28张龙宵李云霞于文娟蒋艳霞李玉军
杨 静,张龙宵,李云霞,于文娟,张 伟,蒋艳霞,李玉军
乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是仅次于肾透明细胞癌的第二大常见肾细胞癌,占肾癌的15%~20%[1]。1997年,Delahunt和Eble根据癌细胞形态特点将PRCC分为两型[2],Ⅱ型比Ⅰ型预后差[3]。然而,Saleeb等[4]研究发现,多达50%的PRCC并不能完全符合上述分型,不同作者给予不同的名称,如嗜酸细胞型、透明细胞型、实性型、Warthin瘤样型等。2012年Petersoon等[5]首次描述2例具有特殊形态特征的肾细胞癌,称为“双相型鳞样腺泡状肾细胞癌(biphasic squamoid alveolar renal cell carcinoma,BSARCC)”。2018年Trpkov等[6]进一步研究发现,该类型肾癌形态学上并没有真正鳞状分化的证据(无角化或细胞间桥),免疫组化标记鳞状细胞均不表达p63和CK5/6,为避免术语上的混淆,建议将该类型的肾细胞癌命名为双相型乳头状肾细胞癌(biphasic papillary renal cell carcinoma,BPRCC)。本文着重探讨BPRCC的临床病理特征、分子遗传学特点和预后,旨在提高临床与病理医师对其的认识水平。
1 材料与方法
1.1 临床资料收集2010~2020年青岛大学附属医院和海军第九七一医院病理诊断的乳头状肾癌372例,经两位以上高年资病理医师在多人共览显微镜下对HE及免疫组化切片进行复诊,最终筛选6例BPRCC。6例BPRCC中男性4例,女性2例;年龄32~67岁,中位年龄58岁,平均55岁;肿瘤直径1.4~6.5 cm,平均3.0 cm。4例患者系体检发现(7天~1年),2例患者分别因腰痛和血尿就诊。
1.2 方法
1.2.1免疫组化 6例标本均经10%中性福尔马林固定,常规脱水、石蜡包埋、4 μm厚切片,行HE和免疫组化EnVision法染色,光镜下观察。免疫组化在Roche公司的BenchMark XT全自动免疫组化机上进行染色,操作步骤按罗氏诊断优化程序进行。抗体包括vimentin、EMA、CK7、CA9、CD10、P504s、CD117、RCC、p63、CK(34βE12)、Cyclin D1、HMB-45、Melan A、WT-1、GATA3和BRAF V600E,均购自福州迈新公司。具体操作步骤严格按试剂盒说明书进行。
1.2.2FISH 本组4例行FISH检测,染色体7(D7Z1)探针(CEP 7)、染色体17(D17Z1)探针(CEP 17)和染色体Y(DYZ3)探针(CEP Y),均购自上海雅培公司。具体操作步骤严格按试剂盒说明书进行。CEP 7、CEP 17由Spectrum Green标记,荧光显微镜下可见绿色信号,CEP Y由Spectrum Orange标记,荧光显微镜下可见橘色信号。高倍镜下选取单个不重叠的细胞核用于计数,每个样本至少计数100个细胞核,当>15%的肿瘤细胞出现3个或3个以上绿色信号时,判读为第7、17号染色体三倍体。
2 结果
2.1 临床特点6例BPRCC发病部位:右肾5例,左肾1例。CT扫描多表现为肾实质内类圆形稍高或低密度影,边界清,增强扫描4例有不同程度强化(图1),1例局部突出于肾轮廓外。依据WHO(2016)肾细胞癌TNM分期进行病理分期:6例均为pT1期(5例pT1a期、1例pT1b期)。5例行肾部分切除术,1例行根治性肾切除术。6例患者采用电话随访,随访时间3~66个月,术后未进行其他任何治疗,未见复发或转移(表1)。
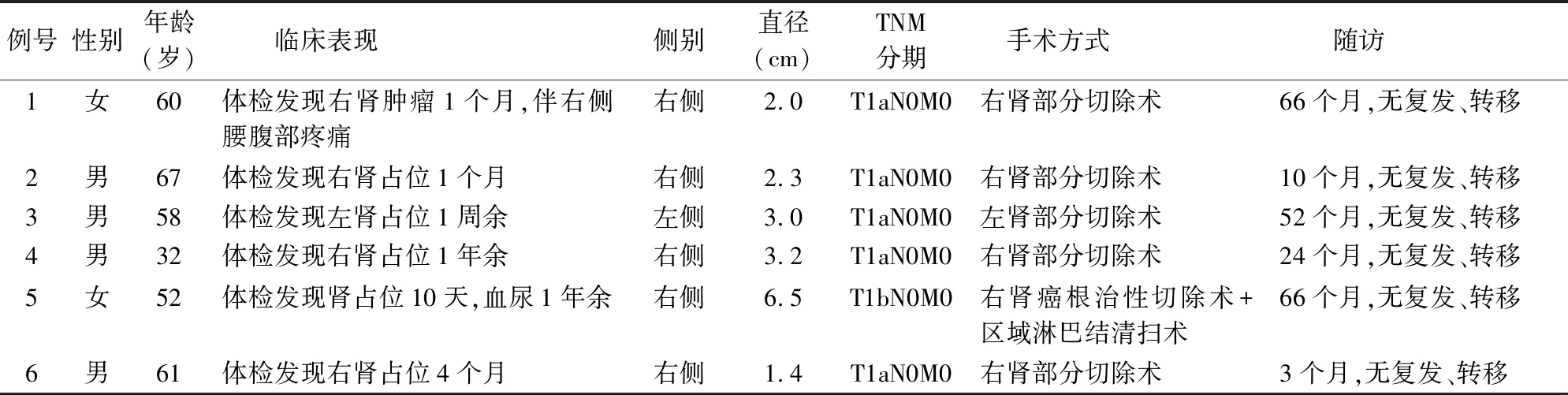
表1 6例双相型乳头状肾细胞癌的临床特点
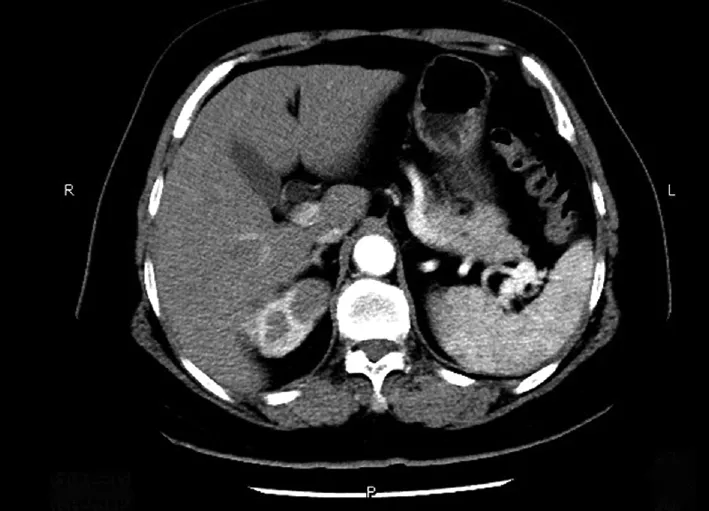
图1 CT示:右肾肾实质内类圆形稍高密度影,边界清
2.2 病理检查眼观:肿瘤呈结节状,边界清楚,灰白、灰黄色,质软,细腻。镜检:瘤组织边界清楚,2例有较厚的纤维性假包膜,4例无包膜与周围肾组织连接,其中3例呈多灶性侵及肾实质。所有病例均可见大小不等、形态不同的两种瘤细胞,以小细胞成分为主,组织学上大细胞呈单个或小簇状(3~5个大细胞),位于小细胞构成的腺泡中央为其突出特点(图2)。大细胞胞质丰富嗜酸性,边界不清,核圆形,核仁可见(WHO/ISUP核分级3级),4例大细胞胞质内可见程度不等的吞饮现象(图3),1例大细胞呈片、团状及微结节状排列(图4)。小细胞胞质稀少、嗜碱性或双嗜性,核小圆形,核分级1~2级,呈腺泡状(6例)、紧密的小管状(5例)、实性(2例)或乳头状(3例)排列,1例胞质浅染泡沫样(图5),1例瘤组织边缘见典型乳头状癌结构,4例间质有灶状泡沫样巨噬细胞聚集,3例有少量砂粒体。所有病例均未见坏死、血管浸润、腔静脉癌栓、肾上腺侵犯、肉瘤样分化以及转移。
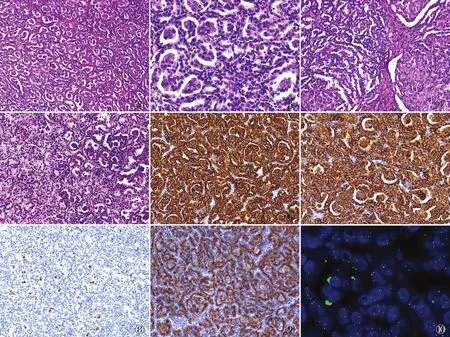
图2 瘤组织构成于大量肾小球样结构 图3 大细胞胞质嗜酸,核圆形,核仁可见,有程度不等的吞饮现象 图4 大细胞呈微结节状,小细胞呈紧密的小管状排列 图5 小细胞泡沫样 图6 大小两种瘤细胞中CK7均呈弥漫强阳性,EnVision法 图7 大小两种瘤细胞中P504s均呈阳性,EnVision法 图8 Cyclin D1仅在大细胞中阳性,EnVision法 图9 RCC在小细胞中阳性,在大细胞中阴性,EnVision法 图10 7号染色体呈三倍体改变,FISH检测
2.3 免疫表型大、小两种瘤细胞vimentin、EMA、CK7(图6)和P504s(图7)均呈弥漫强阳性,CD10、CA9、CD117、WT-1、GATA3、p63、CK(34βE12)、HMB-45、Melan A、WT-1和BRAF V600E均呈阴性;Cyclin D1(图8)仅在大细胞(6/6)中呈阳性,RCC(图9)仅在小细胞(4/6)中呈阳性;Ki-67增殖指数在较大的细胞中为1%~20%,在小细胞中≤1%。
2.4 FISH检测4例BPRCC中有3例检测到(75%)7号染色体三体(图10),1例(25%)存在17号染色体三体;3例男性患者中有2例(67%)存在Y染色体缺失。
3 讨论
BPRCC是一种新近认识的罕见肾细胞癌,截止目前国外文献报道91例,国内仅见2例个案报道[7-8]。组织学上被描述为大小不等的两种细胞群以鳞样腺泡状生长和形成肾小球样结构为主要特征[5,9]。
文献报道[6,9]两宗高龄患者,平均年龄分别为62、55岁,以男性略多见。本组6例患者平均年龄55岁,男性4例,女性2例;4例为体检发现,2例因腰痛和血尿就诊,与文献报道基本一致[5-6]。Trpkov等[6]报道,约30%(8/25)的BPRCC表现为多灶性,本组6例均为单侧单灶发生,可能与病例数相对较少有关。
本组6例均可见高核级嗜酸性瘤细胞,单个或簇状位于胞质稀少嗜碱性小细胞构成的腺泡腔内,形成特征性的肾小球样结构,占比多少不等(2%~95%)。国内户燕姣等[7]首次报道1例BPRCC,并依据其独特形态命名为“伴肾小球样结构的乳头状肾癌”。近年研究显示,双相型形态除肾小球样结构外大细胞也可呈实性片、团状或微结节状排列,与腺泡或小管状排列的小细胞混杂存在[10],支持BPRCC生长方式的多样性。尽管乳头状结构是经典型PRCC的突出形态特点,但BPRCC往往没有或仅见小灶状乳头状结构,Petersson等[5]报道2例BPRCC中仅1例显示比例极小的乳头状结构(≤2%)。本组有4例(4/6)乳头状结构占3%~60%,2例(2/6)无明显乳头状结构,支持该类型肾细胞癌是一种以实性生长方式为主、并伴双相细胞形态的肾癌。文献报道[5-6,9],大多数BPRCC均可见大细胞吞噬中性粒细胞、淋巴细胞或细胞碎片的现象(伸入运动或吞饮现象),其临床意义尚不清楚。本组有4例(4/6)标本仅个别细胞可见伸入运动或吞饮现象,因此其不能作为该肿瘤的特征性改变。与经典型PRCC一致,BPRCC瘤组织间质内泡沫细胞较常见[5],4例可见多灶性泡沫细胞聚集,对该类型的肾细胞癌诊断具有重要提示作用。
多个文献表明,BPRCC大小不等瘤细胞vimentin、EMA、CK7、AMACR、和PAX-8均呈弥漫强阳性[6,11]。p63和CK(34βE12)在具有鳞样形态的大细胞中阴性,提示大细胞并非真正的鳞状分化。Cyclin D1仅出现在较大的细胞中,较大细胞Ki-67增殖指数明显高于较小细胞[5-6,9]。此外,本组发现 RCC仅在小细胞(4/6)表达,提示Cyclin D1和RCC可能是BPRCC的独特免疫组化标志物,有助于鉴别。
研究表明,BPRCC与Ⅰ型PRCC关系密切。Hes等[9]报道21例BSARCC中有10例可见典型PRCC成分;Denize等[12]研究发现60%(9/15)的BPRCC存在致病性MET基因变异;Chartier等[13]报道的病例显示BSARCC与典型的Ⅰ型PRCC明显混杂在一起,为BPRCC与Ⅰ型PRCC关系密切的观点提供了有力证据。本组有1例瘤组织边缘可见小片状典型Ⅰ型PRCC区,与Trpkov等[6]报道相似,大小不等、形态不同的两种细胞群以及免疫组化表达的差异,提示两类肿瘤细胞可能处于不同增殖、分化阶段,大细胞可能为Ⅰ型PRCC基础上的高级别转化。
分子遗传学:BPRCC往往具有PRCC的遗传学特征,表现为7、17号染色体三体或Y染色体缺失。Hes等[9]报道11例均存在7、17号染色体扩增,4例男性患者出现Y染色体丢失。Denize等[12]发现14例(87.5%)BPRCC存在7号染色体三体。本组4例行FISH检测结果表明,均存在7号(3/4)或17号(1/4)染色体三体,而2例男性存在Y染色体缺失,进一步支持该肿瘤属于PRCC的亚型。
BPRCC往往由于缺乏典型的乳头状结构极易误诊为其他良恶性肾肿瘤,需进行鉴别诊断。(1)后肾腺瘤:缺乏典型的双相形态,呈小腺泡状或实性生长,免疫组化标记CK7、AMACR、EMA均阴性,而WT-1阳性。(2)黏液样小管状和梭形细胞癌:本组6例中有4例可见多少不一的紧密小管状结构,易误诊为黏液样小管状和梭形细胞癌。但BPRCC往往存在肾小球样结构,而无梭形细胞及黏液样间质。作者认为大小细胞双相型分化、肾小球样或微结节状结构,以及Cyclin D1、RCC选择性免疫组化着色有助于该肿瘤的诊断。FISH检测7、17号和Y染色体异常对BPRCC的确诊具有重要辅助作用。
文献报道BPRCC绝大多数是低分期(pT1期)和惰性,多具有良好的临床病程,但少数病例也可表现为侵袭性的生物学行为。Ulamec等[11]报道10例BPRCC中有9例为pT1期,1例(pT3期)出现肾被膜浸润并侵犯肾周脂肪,术后8年复发。Hes等[9]对14例BPRCC随访1~96个月,5例出现扩散转移,其中3例出现区域淋巴结和双侧肺转移并带瘤存活(6~24个月),2例分别于术后29和45个月死于广泛转移,提示部分BPRCC具有侵袭性。Trpkov等[6]报道28例BPRCC中有23例获随访,1例术后8年出现肿瘤复发,1例术后54个月死亡。本组4例BPRCC的TNM分期均为Ⅰ期,肿瘤较小,术后未行任何治疗,随访3~66个月,患者均无瘤存活,较支持该类型肾癌具有惰性的生物学行为。
综上所述,BPRCC是具有独特形态学特征的罕见PRCC亚型,以存在大小不等的两种细胞群、呈肾小球样、微结节状排列为特征,Cyclin D1和RCC选择性免疫组化染色对该类型肾癌的诊断具有重要提示作用,大小细胞可能是处于不同增殖、分化阶段的瘤细胞,绝大多数病例表现为低分期和惰性,预后良好。
