响应面法优化花生中黄曲霉毒素的提取及其在快检评价中的应用
2022-09-27张盈月周家宏飞2
赵 萍,张盈月,周家宏,陈 飞2,
(1.南京师范大学食品与制药工程学院,江苏 南京 210023)(2.南京师范大学南京市特色生物资源功能成分开发工程研究中心,江苏 南京 210023)(3.南京师范大学生命科学学院,江苏 南京 210023)
真菌毒素对粮食的污染在全球范围内都较普遍. 据联合国粮农组织统计,全世界每年约有25%的粮食受到真菌毒素污染,约有2%的农作物因污染严重而失去利用价值. 黄曲霉毒素是常见的污染之一. 黄曲霉毒素(Aflatoxin B1/B2/G1/G2,AFTS)主要是由黄曲霉(Aspergillusflavus)及寄生曲霉(Aspergillusparasiticus)产生的次生代谢产物. 黄曲霉毒素主要污染粮油及其制品,特别是花生和玉米等含水量较高的禾谷类及油料作物[1],其中黄曲霉毒素B1(AFB1)毒性最大,是一种强遗传毒性致癌物.
国际癌症研究机构(IARC)已将AFB1和自然发生的AFTS混合物归类为第1类致癌物质(人类致癌物质;国际癌症研究机构,IARC 1993,2002年)[2]. 鉴于AFTS的强毒性,全球已有60多个国家制订了食品和饲料中的AFTS限量标准和法规[3-4]. 国际食品法典委员会(CAC)规定,食品中AFTS的最大残留限量标准为15.0 μg/kg;欧盟规定直接食用花生中AFB1的限量值为2.0 μg/kg,AFTS总和为4.0 μg/kg;美国食品与药物监督管理局(FDA)规定,食品中AFTS的限量值为15.0 μg/kg;我国标准规定玉米、花生中AFB1的限量20.0 μg/kg,稻谷、糙米、大米中AFB1的限量为10.0 μg/kg,小麦及其他谷物中AFB1的限量为5.0 μg/kg. 相比于发达国家,我国制定的限量标准只对AFB1总量作出规定,并无对AFTS总量的限制要求[5].
随着各种法规所规定的食品和饲料中黄曲霉毒素限量水平的降低,迫切需要开发和验证更可靠的分析方法来测定真菌毒素. 目前常用的分析技术包括快速筛查和确证定量[6-10]. 快速筛查主要以免疫化学为基础,如酶联免疫吸附测定、胶体金免疫渗滤法、胶体金免疫层析法等,市场上大部分关于真菌毒素的快检产品即基于上述免疫化学技术原理,这些检测方法具有快速、简便、灵敏度高等特点. 确证定量主要以色谱技术为基础,如高效液相色谱法、高效液相色谱-质谱联用法等,色谱类检测结果准确性高、重现性好、灵敏度高,但对设备依赖性强,检测成本高. 我国快检技术较起步较晚,技术不成熟,快检产品评价体系不完善,市场上的快检产品良莠不齐,部分产品无法满足标准要求,易出现重复性差、假阴性率高等情况,特别是对复杂基质进行额外处理导致检测过程繁琐且耗时长等缺点,造成对食品安全监管的阻碍[11]. 因此,规范试剂盒的使用,并确保所使用的快检产品符合相关质量管理与质量控制要求,成为了保障食品安全的重点之一.
分析检测在食品安全的控制和管理中起着至关重要的作用,开发改进样品中真菌毒素的提取方法一直是研究的热点,是关系着分析检测能否成功的关键因素[12-14]. 快检产品虽然具有快速、准确、简便、灵敏等特点,可用于粮油产品的质量监控,但市场上仍有部分产品无法满足标准要求,因此在快检产品使用前,有必要应用更为可靠的方法对其进行评价验证. 本文提出对参考方法的提取条件利用超声辅助响应面设计的方法进行优化[15],使样品中的黄曲霉毒素释放更加完全,毒素检测值更接近真实水平,从而提高参考方法的准确度,进一步提高快检试剂盒验证指标的准确性,可用于试剂盒评价.
1 材料与方法
1.1 材料与试剂
去壳花生米(河南兰考);甲醇、乙腈、乙醇(TEDIA,色谱纯);AFB1标准品溶液、AFTS混合标准品溶液、AFTS免疫亲和柱(北京华安麦科生物技术有限公司);AFB1试剂盒:定性试剂盒8家,定量试剂盒2家.
1.2 仪器与设备
高效液相色谱仪Agilent 1100(配有荧光检测器)(安捷伦科技有限公司);HF2500柱后光化学衍生器(北京华安麦科生物有限公司,需另配);SCIENTZ-650E超声波细胞粉碎机(宁波新芝生物科技股份有限公司);D3024R高速冷冻离心机(大龙兴创实验仪器有限公司);XH-A旋涡混合器(南京大学普阳科学仪器研究所).
1.3 实验方法
1.3.1 黄曲霉毒素的提取
花生去壳后粉碎并过24目筛后备用. 称取上述花生样品5 g,根据设计的体积分数及料液比加入溶剂,涡旋混匀,根据设计的不同超声时间及超声功率进行超声破碎,在8 000 r/min下离心10 min,取上清备用.
1.3.2 色谱条件
色谱柱:C18(2.1 mm×150 mm;1.7 μm);进样量:20 μL;柱温:40 ℃;流动相:甲醇∶水=50∶50;流速:1.0 mL/min. 荧光检测器:激发波长:360 nm;发射波长:440 nm. 另配光化学衍生器.
1.3.3 黄曲霉毒素标准溶液的制备
AFTS标准工作溶液的制备:以浓度为2.6 μg/mL的AFTS(AFB1∶AFB2∶AFG1∶AFG2=3∶1∶3∶1)混合标准品溶液,溶解于甲醇,分别配制5.2、13、26、52、104 ng/mL不同梯度的标准工作溶液.
1.3.4 黄曲霉毒素提取工艺优化
根据相关文献[12,16-19]中关于AFB1的提取工艺,选择甲醇、乙腈、乙醇3种不同溶剂及5种对花生中AFTS提取量有较大影响的因素(不同体积分数、料液比、超声时间、超声功率)进行单因素实验. 在单因素实验的基础上,采用Box-Benhnken Design中心组合设计响应面法优化AFTS的提取工艺.
1.3.4.1 单因素实验
研究不同的溶剂及体积分数(60%甲醇、60%乙腈、60%乙醇;70%甲醇、70%乙腈、70%乙醇;80%甲醇、80%乙腈、80%乙醇)、料液比(1∶3,1∶4,1∶5,1∶6,1∶7(g∶mL))、超声时间(5、10、15、20、30 min)、超声功率(160、180、200、220、240 W)对花生中AFTS提取量的影响,重复3次,取均值.
1.3.4.2 响应面实验
以单因素实验结果为基础,通过Design-Expert 11软件,根据Box-Benhnken Design 中心组合试验设计原理对花生中黄曲霉毒素提取的溶剂比、料液比、超声时间、超声功率进行实验设计,以AFTS提取量为响应值(Y),设计四因素三水平的相应实验,如表1所示.

表1 响应面实验因素及水平
1.3.5 参考方法的验证
按照优化后的提取条件进行样品制备,标准工作溶液为AFB1(浓度分别为0.5、2.0、5.0、10.0、20.0、40.0 ng/mL),以标准品浓度为横坐标、峰面积为纵坐标作图,得到标准曲线回归方程. 对空白花生进行加标回收实验,加标水平为10、15、20 μg/kg,重复3次,取均值,计算拟合度R2和加标回收率.
1.3.6 快检试剂盒验证[20]
根据GB2761—2017《食品安全国家标准:食品中真菌毒素限量》,花生及其制品中黄曲霉毒素B1的限量指标为20 μg/kg;将AFB1含量>20 μg/kg的样品称为阳性样品,<20 μg/kg的样品称为阴性样品.
1.3.6.1 定性试剂盒验证
实验方法:选择市场上8家不同品牌的主流AFB1定性试剂盒厂家的产品进行实验,依次编号1-8,产品基本信息如表2所示. 根据不同厂家试剂盒的说明书对样品进行相应的前处理,制备阴性样品(加标水平10 μg/kg)、阳性样品(加标水平30 μg/kg),平行测定5次.
验证指标:灵敏度、特异性、假阴性率、假阳性率、符合率.
1.3.6.2 定量试剂盒验证
实验方法:选购市场上两家主流的AFB1酶联免疫试剂盒进行评价,编号A、B,基本信息如表2所示. 分别评价低(加标水平10 μg/kg)、中(加标水平30 μg/kg)、高(加标水平40 μg/kg)3个水平的样品. 每个水平制备2个样品,每个样品重复测定3次,即一个水平的样品重复测定6次(n=6);制备两个空白样品(不加标),每个平行测定10次(n=20).

表2 试剂盒基本信息
验证指标:准确度、线性和范围、检测限和定量限、参考方法一致性.
1.4 数据处理
利用Excel及Origin Pro 9.1软件对实验结果进行分析;采用Design-Expert 11软件进行响应面中心组合试验设计,对数据进行回归拟合,作出响应曲面图,并进行线性回归和方差分析. 实验数据均为3次平行实验的平均值,P<0.05,为具有统计学意义的显著差异.
2 结果与分析
对按照1.3.3节制备的标准品溶液进行高效液相色谱检测,得到AFTS的标准曲线公式为y=79 768x+53 302,R2=0.999 5.
2.1 单因素实验结果
单因素实验结果如图1所示. 由图1(a)可以观察到,在相同溶剂不同的体积分数下,提取量随着体积分数的增加呈现先上升后下降的趋势,这可能是由于黄曲霉毒素难溶于水,因此有机溶剂体积分数小的提取量低,随着有机溶剂体积分数的增加花生中脂溶性等成分溶出量也会增加,这些成分影响黄曲霉毒素的溶出率,从而导致提取量低[21]. 因此考虑60%~80%的溶剂体积分数为进一步的优化范围. 在相同体积分数下,甲醇、乙腈、乙醇3种不同溶剂对黄曲霉毒素的提取量是甲醇>乙腈>乙醇. 综上,选取60%~80%的甲醇溶液进行响应面优化实验.
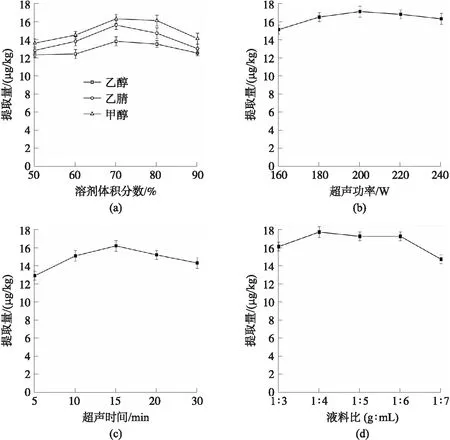
图1 单因素实验对提取量的影响
由图1(b)可以发现,随着料液比的增加,提取量呈现先上升后下降的现象,这可能是随着样品与溶剂的接触面积加大且伴随着溶剂浓度的增加[22],促使样品中的黄曲霉毒素溶出率增加;增加到一定量后,溶剂趋于饱和,黄曲霉毒素的溶出趋于平衡,提取量几乎不再变化;此时再提高料液比,反而会使样品中其他杂质成分溶出,阻碍了黄曲霉毒素与溶剂的结合,导致提取量降低. 因此,本文选择料液比1∶3、1∶4、1∶5(g∶mL)进行响应面优化实验.
由图1(c)可以发现,随着超声时间增加,黄曲霉毒素提取量呈现先上升后下降趋势. 超声有助于黄曲霉毒素的提取,在一定程度上,超声时间越长,黄曲霉毒素提取量越大;超声时间大于15 min后,提取量反而降低,可能是过长的超声时间导致杂质溶出,影响黄曲霉毒素的释放[23]. 因此,本文选择超声时间10、15、20 min进行响应面优化实验.
由图1(d)可以发现,黄曲霉毒素提取量随超声功率的加强先增加后减少. 超声有助于黄曲霉毒素的提取,随着超声频率的增加,促进了黄曲霉毒素的溶解,从而提取量增加;当超声功率增加到220 W后,提取量反而减少,可能是过高的频率使样品中的其他杂质溶出阻碍了黄曲霉毒素的溶解[24]. 因此,选取180、200、220 W进行响应面优化实验.
2.2 响应面实验结果
根据单因素试验结果确定因素与水平,以黄曲霉毒素提取量为响应值,采用中心组合设计响应面试验优化黄曲霉毒素提取工艺,设计与结果见表3.

表3 黄曲霉毒素提取的响应面实验设计与结果
利用Design-Expert 11软件对试验结果进行多元回归拟合,得到二次多项回归模型方程:
Y=7.307 04+0.072 192A+0.056 850B+0.352 667C+0.059 233D-0.000 012AB+0.000 375AC+1.927 92×10-17AD+
0.000 18BC+0.000 027BD-0.000 600CD-0.000 505A2-0.000 130B2-0.051 875C2-0.002 090D2.
从表4结果可知,模型P值<0.050 0,说明模拟项显著,表明回归模型达到显著水平[23].在这种情况下,A、B、D、A2、B2、C2、D2都是重要的模型项.失拟项的P值大于0.050 0,表示失拟项不显著,模型不失拟,选择合理.预测的R2为0.943 7,与调整后的R2差值小于0.2,说明模型符合,能够用于对花生中AFTS的提取工艺条件进行分析和预测[25].
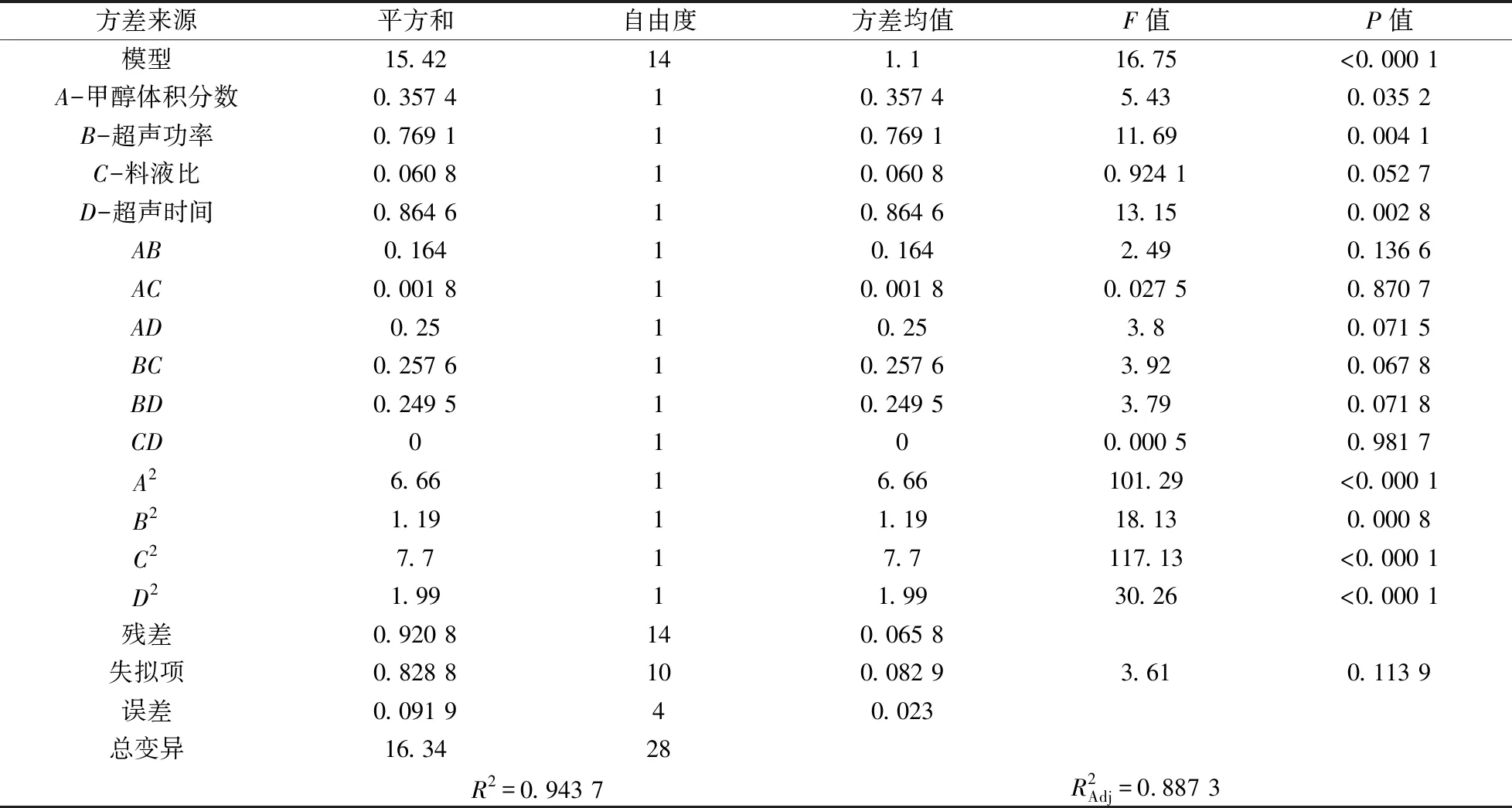
表4 回归方程的方差分析
等高线的形状反映出交互效应的强弱大小,圆形表示两种因素交互作用不显著,而椭圆形则与之相反[26]. 由图2可知,甲醇体积分数、超声功率、料液比和超声时间之间的交互作用对花生中AFTS提取效果的影响均出现抛物面型关系,所得到的响应面都存在一个极大值点.

图2 两因素交互作用对AFTS提取效果影响的响应面和等高线
经过响应面优化,根据拟合二阶模型公式得到理论上花生中黄曲霉毒素的最佳提取工艺条件为:甲醇溶液浓度65.578%,超声功率206.696 W,料液比1∶4.064,超声时间14.700 min. 在此最优条件下,AFTS提取量的理论值为18.346 μg/kg. 考虑到实际操作的可行性,将上述最优条件调整为甲醇体积分数65%,超声功率206 W,料液比1∶4,超声时间15 min. 为了验证该模型的有效性及实用性,在此最佳提取条件下对该模型做3次重复验证试验,花生中AFTS的提取量均值为18.06 μg/kg,与预测结果基本一致. 可见,该模型能较好地预测实际黄曲霉毒素的提取情况[27],因此后续实验中使用该最佳提取工艺条件.
2.3 参考方法验证
以标准品浓度为横坐标、峰面积为纵坐标作图,得到标准曲线回归方程如图3所示. 标准品工作液的线性关系良好,R2=0.999 7,能够满足检测的要求.
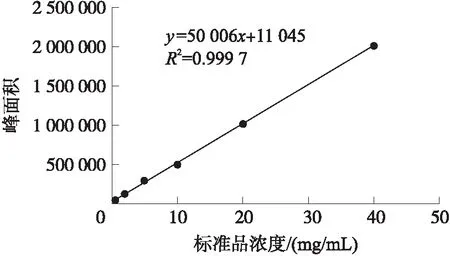
图3 AFB1标准曲线图
2.3.1 基质实验
选取花生样品按照参考方法处理后进行检测,重复3次,计算后发现基质样品中的AFB1值低于检测限,说明样品中AFB1含量极少,可用于后续实验.
2.3.2 加标回收实验
对优化后的参考方法进行加标回收验证,如表5所示,参考方法的3种加标水平的平均回收率在90%~100%,符合回收率允许限. 与其他检测黄曲霉毒素的方法相比,回收率相当,如姚誉阳等[28]通过优化提取条件、净化方法和色谱条件建立了QuEChERS-高效液相色谱-柱后光化学衍生法检测粮谷类食品中的AFTS,对阴性样品进行3种水平的添加回收实验,回收率均值在86.4%~97.8%;Li等[29]采用一种表面增强拉曼散射传感策略来用于花生样品中AFB1的定量测定,回收率在89%~121%之间;Jia等[30]建立了一种基于量子点纳米棒的横向流动荧光条免疫传感器,对低、中、高3种添加水平的莲子的AFB1进行测定,回收率在94.0%~116.0%之间. 说明优化后的参考方法可靠性较高,可采用此参考方法对试剂盒进行评价验证.

表5 参考方法的加标回收率
2.4 AFB1定性试剂盒验证
首先采用参考方法对两种不同加标水平的花生样品中AFB1的含量进行确证,结果如表6所示. 表7所示为定性试剂盒检测结果. 如表8所示,经统计分析,AFB1定性试剂盒检测结果的灵敏度为100%,特异性为0.98,假阴性率为0,假阳性率为2%;卡方检验结果为0<3.84,表示试剂盒检测方法与参考方法的阳性确证比率在5%的置信区间内,无统计学差异,说明试剂盒检测结果与现有方法一致.

表6 参考方法检测结果(n=5)
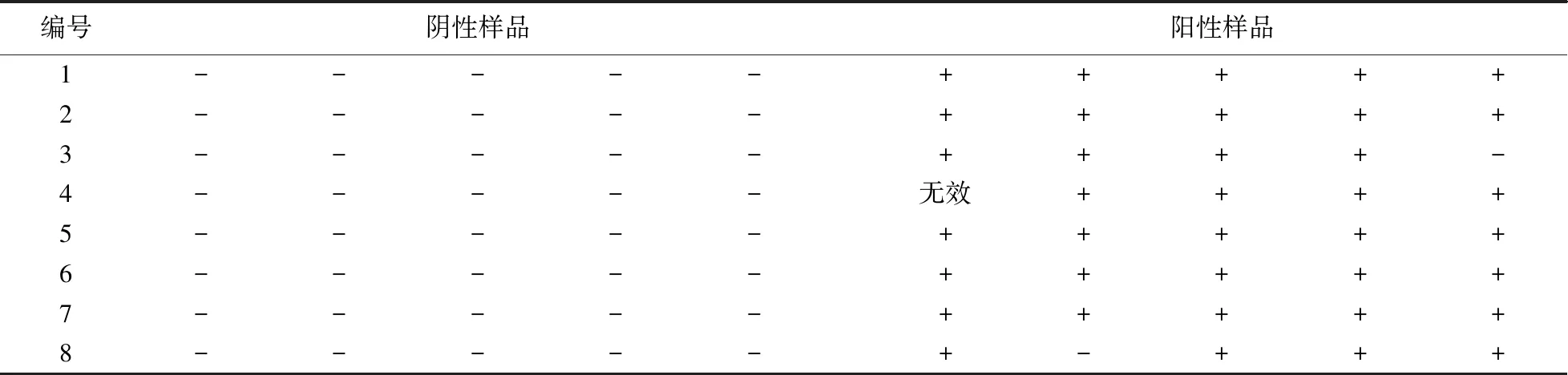
表7 AFB1定性试剂盒测定结果(n=5)
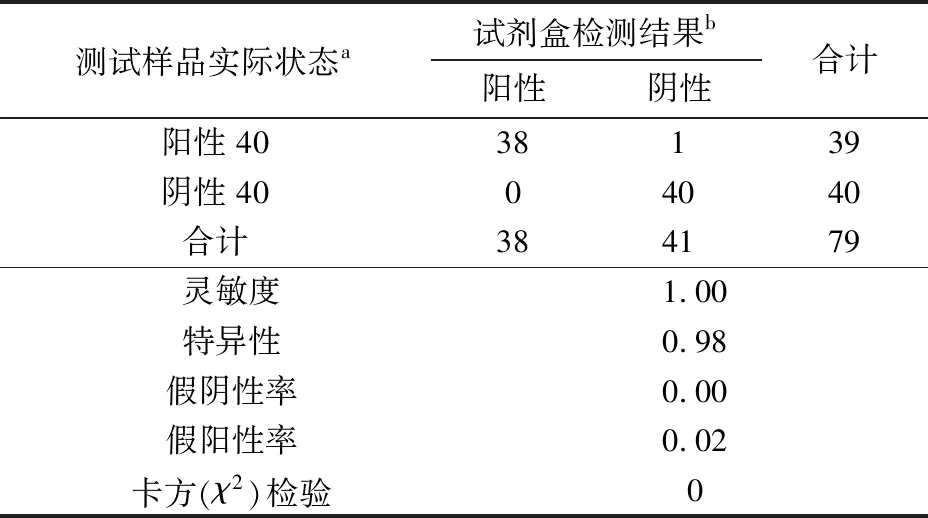
表8 AFB1定性试剂盒检测结果统计分析
从检测结果看,市场上的AFB1定性快检技术已相对成熟,与实验室参考方法较为一致. 但实际检测过程中仍存在一些问题. 由于胶体金法不能进行准确定量,只通过T线和C线的显色判断结果,若抗原浓度在小范围波动时难以准确读取测定结果,当样品的毒素含量在产品检出限水平附近时,可能会因检验人员的主观因素导致不同的判断结果,从而导致结果呈现假阳性或假阴性的可能[31-32]. 实验室参考方法对花生中黄曲霉毒素的前处理进行优化后,无需复杂的试剂及仪器,加标样品的回收率>85%,说明优化后的提取方式能够使样品中的黄曲霉毒素尽可能地全部释放出来,使检测结果更接近样品中黄曲霉毒素的实际值. 可见,试剂盒的质量不仅体现于试纸条的灵敏度,还需要对样品前处理方法进行把控,使其在快速简便的基础上保证更大程度地提取样品中的毒素量,从而提高结果的准确度.
2.5 AFB1定量试剂盒验证
图4所示为两家AFB1定量试剂盒的标准曲线图. 如表9所示,试剂盒检测空白(未加标)样品的值均<1 μg/kg≪20 μg/kg. 从表10和11可以看出,定量试剂盒检测的结果与参考方法之间的偏倚程度较小,说明试剂盒方法可靠性较高;两家试剂盒的平均回收率都在85%以上,说明试剂盒准确度较高. 根据试剂盒自带不同浓度的标准溶液进行检测,得到A厂家试剂盒定量的线性范围为0.03~2.43 μg/kg;B厂家试剂盒定量的线性范围为0.1~8.1 μg/kg. 两家试剂盒的检测限分别为1.706和2.261 μg/kg,远低于《食品安全国家标准:食品中真菌毒素限量标准》中的黄曲霉毒素限量标准值;定量限分别为1.909和2.274 μg/kg,均在线性范围内;RSD分别为0.02和0.07,由此可知试剂盒的精密度较高且重复性较好.
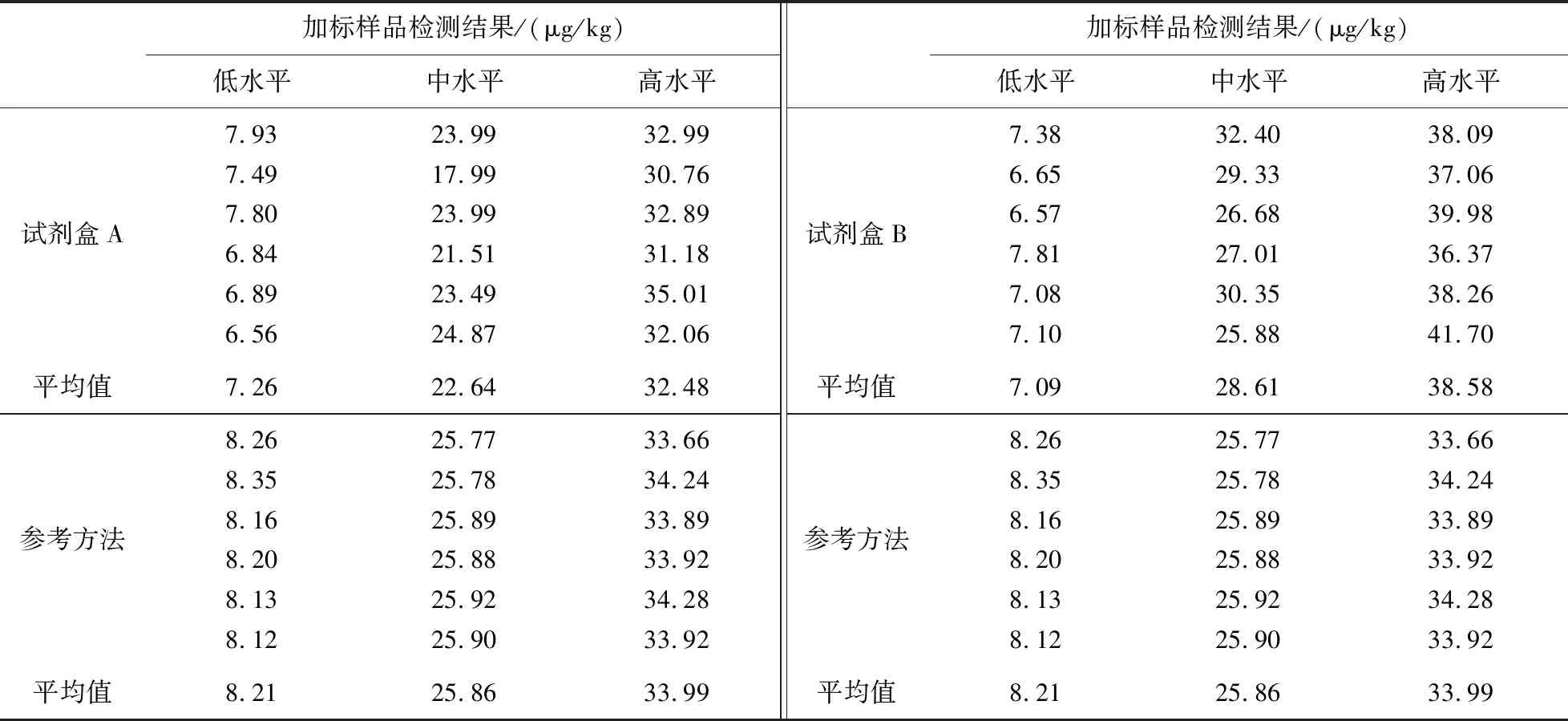
表10 参考方法与AFB1定量试剂盒检测结果(加标样品)对比
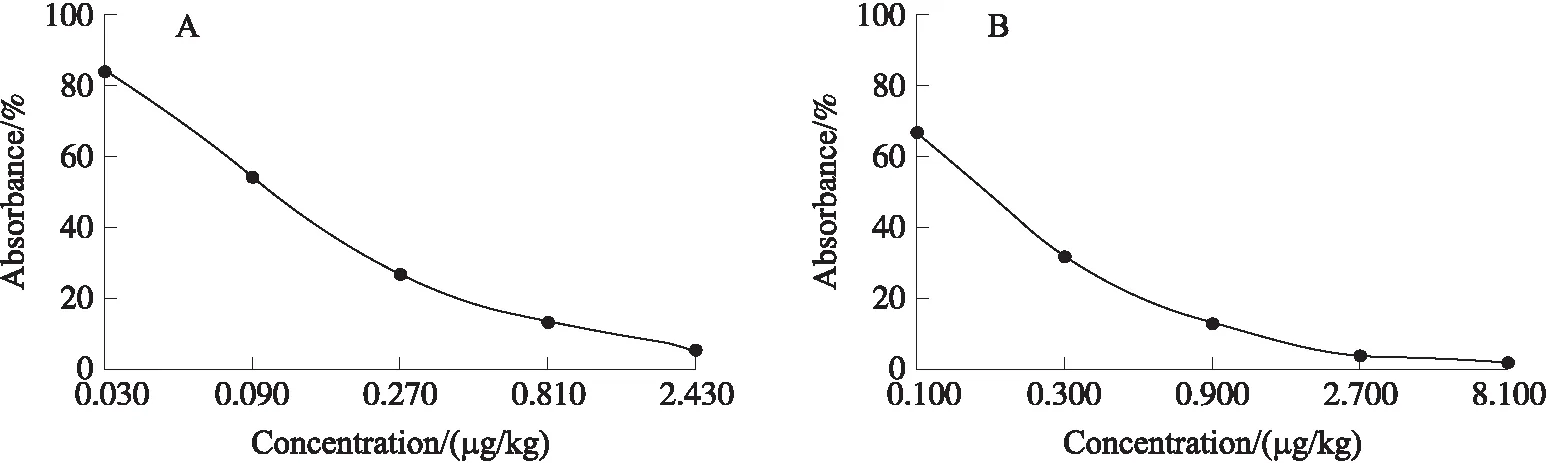
图4 AFB1定量试剂盒标准曲线图
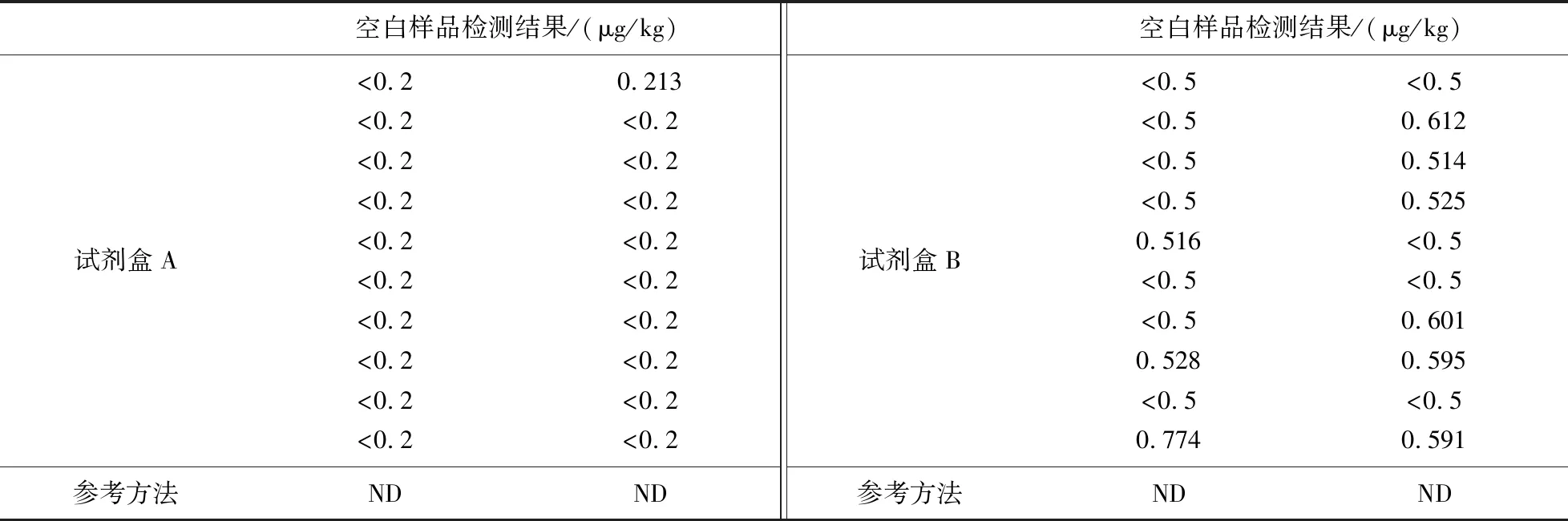
表9 参考方法与AFB1定量试剂盒检测结果(空白样品)对比
AFB1是常见的一类真菌毒素,市场上关于AFB1的酶联免疫试剂盒技术相对成熟,检测结果与实验室参考方法对比进行指标评价后呈现较一致且良好的结果. 在实际检测过程中对实验室设备专业性、实验人员操作熟练度要求较高,否则易出现标准曲线拟合度较差、检测结果呈假阴性或假阳性的情况. 本文在参考方法中以超声辅助提取对花生样品的前处理进行了优化,检测结果的回收率>85%. 提高AFB1检测结果的真实水平不仅依赖于仪器的精密度以及酶联免疫试剂盒中检测试剂的质量,更需从源头提高样品中AFB1的提取量,减小因操作熟练度等造成的误差[33].

表11 定量试剂盒验证指标结果
3 结论
本文通过单因素实验及超声辅助响应面实验对花生中AFTS提取方法进行了优化,通过高效液相色谱—光化学柱后衍生法检测花生中AFTS的提取量,结合实际操作可行性,确定了最优的提取方式:甲醇体积分数65%,超声波功率206 W,料液比1∶4,超声时间15 min. 利用上述最佳提取工艺并结合高效液相色谱—光化学柱后衍生法对花生中AFB1进行检测,结果表明花生中AFB1的低、中、高3种水平的加标回收率均>85%,说明此法可作为AFB1胶体金快检方法和酶联免疫快检方法的参考方法.
本文对胶体金和酶联免疫快检方法进行评价验证,经数据分析可知AFB1定性及定量试剂盒的检测结果基本能满足市场监管要求;但在实际检测过程中,部分厂家的试剂盒存在前处理耗时过长、试剂不常规且专业设备依赖性强,从而失去了快速现场检测的意义;有些产品定性检测判读可视信号不明显,易出现假阴性、假阳性情况. 因此,不仅要对快检方法的试剂及试纸条进行质量监管,还要注意快检产品对样品前处理方式的要求,在保证溶剂常规化的情况下要尽量优化提取步骤,使样品中毒素的提取量尽可能接近真实水平,减小因仪器、人员操作等问题产生的误差,从而提高检测效率.
本文通过响应面实验优化提取方法来提高花生中AFTS的提取量和检测效率,同时增强了参考方法的可靠性,提高了对快检方法评价验证指标的要求. 本文认为,有必要进行试剂盒样品基质处理方式对检测结果干扰等方面的研究,尤其是检测含有油脂类的复杂基质,样品的前处理方式对结果的准确性影响尤为显著. 本文从样品处理方式对AFTS检测结果进行了研究,其他因素对于商品化试剂盒质量的影响仍需进一步的研究,从而使商品化试剂盒质量的评价验证体系越来越完善,以切实保障食品安全.
