电解二氧化锰中硫的化学物相分析(续)
2022-09-27何京明雷顺新覃威鑫黄守健班美妹刘素华刘守廷
何京明,雷顺新,覃威鑫,黄守健,班美妹,刘素华,刘守廷
(1. 广西博测检测技术服务有限公司,广西 南宁 533007; 2. 横县综合检验检测中心,广西 南宁 530300)
0 前 言
化学物相分析是基于各种矿物(化合物)在化学溶剂中的溶解度和溶解速度的差异,选择合适的化学溶剂进行溶解,使目标检测矿物(化合物)进入溶液,然后在溶液中测定矿物(化合物)的百分含量[1]。
前期研究中[2]分别采用四氯化碳、弱酸性的氯化钠-盐酸溶液(或碱性的碳酸钠溶液)分离电解二氧化锰产品中的单质硫和硫酸盐,采用乙酸-过氧化氢浸取分离电解二氧化锰产品中硫化物。然而在酸性溶液中,电解二氧化锰中的四价锰与过氧化氢作用时,有下列反应发生:MnO2+H2O2+2H+=Mn2++O2↑+2H2O[3]。随着反应进行,电解二氧化锰晶体溶解于酸性过氧化氢溶液中,如果电解二氧化锰存在结合态的硫酸盐,硫酸盐也会随着电解二氧化锰晶体溶解而溶解到溶液中。前期研究中[2],认为通过乙酸-过氧化氢法处理后溶液中所测的硫是硫化物的观点有待商榷。为探讨电池用电解二氧化锰中是否存在硫化物或包裹于电解二氧化锰晶体中的硫酸根,本文继续利用化学物相分析法分析电解二氧化锰中硫元素组成及变化情况,以期对电解二氧化锰生产工艺条件考察有所参考。
1 试验部分
1.1 试剂
除非另有说明,分析中仅使用认可的分析纯试剂和符合《分析实验室用水规格和试验方法》(GB/T 6682—2008)规定三级水。使用试剂有四氯化碳、盐酸、氯化钠、碳酸钠、氢氧化钠、碘化钾、硫代硫酸钠、淀粉、抗坏血酸(维生素C)。
碘酸钾标准滴定溶液(1/6 KIO3=0.03 mol/L):称取1.070 1 g已于180 ℃±2 ℃的电烘箱中干燥至恒量的工作基准试剂碘酸钾,精确至0.000 1 g。溶于约200 mL新煮沸过的冷水中,加入0.2~0.5 g氢氧化钠(NaOH)及25 g碘化钾(KI)溶解后移入1 000 mL容量瓶中,再用新煮沸过的冷水稀释至刻度,摇匀。此滴定溶液对硫酸根的滴定度为1.443 mg/mL。
硫代硫酸钠标准滴定溶液(Na2S2O3=0.03 mol/L):将7.8 g硫代硫酸钠(Na2S2O3·5H2O)和0.05 g无水碳酸钠(Na2CO3)溶于1 000 mL水中,缓缓煮沸10 min,冷却,放置2周后用4号玻璃坩埚过滤。
碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液体积比K的标定:从滴定管中缓慢放出15.00 mL碘酸钾标准滴定溶液于250 mL碘量瓶中,加入50 mL水及10 mL盐酸(20%),于暗处放置5 min,在摇动下用硫代硫酸钠标准滴定溶液滴定至淡黄色后,加入约2 mL淀粉溶液(10 g/L),再继续滴定至蓝色消失,记录滴定消耗硫代硫酸钠标准滴定溶液体积V。碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比K按下式计算:
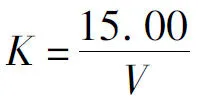
(1)
式(1)中K为碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比;15.00为加入碘酸钾标准滴定溶液的体积,mL;V为消耗硫代硫酸钠标准滴定溶液的体积,mL。
氨性硫酸锌溶液(100 g/L):将50 g硫酸锌(ZnSO4·7H2O)溶于150 mL水和350 mL氨水中。静置24 h后使用,必要时过滤后使用。
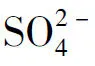
1.2 仪器和设备
电子分析天平:感量0.1 mg,日本A&D仪器有限公司,型号规格GH-200;硫化物测定酸化吹气装置,原理图见图1。
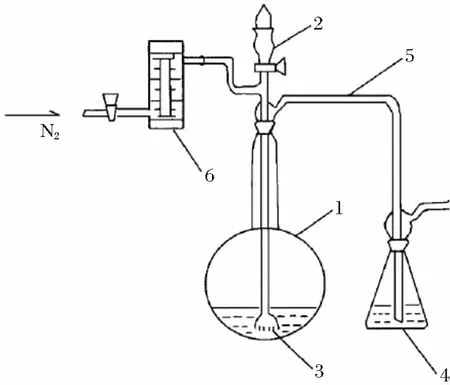
1.500 mL圆底反应瓶;2.加酸漏斗;3.多孔砂芯片;4.250 mL碘量瓶;5.玻璃连接管;6.流量计图1 硫化物测定酸化吹气装置原理
1.3 试验方法
1.3.1 试验原理
试样按前期研究[2]经四氯化碳法来分离电解二氧化锰产品中的单质硫,以及用弱酸性的氯化钠-盐酸溶液(或碱性的碳酸钠溶液)作为溶剂分离电解二氧化锰产品中游离态的硫酸盐后,滤渣(电解二氧化锰)在还原条件下,用盐酸分解,产生的硫化氢气体收集于氨性硫酸锌溶液中,然后用碘量法测定其硫化物含量;过滤盐酸分解液,用50~60 ℃水洗涤反应瓶及滤纸5~7次。滤液按硫酸钡重量法测定硫,结果为电解二氧化锰结合态的硫酸盐之硫含量。
1.3.2 试验步骤
按图1连接好硫化物测定酸化吹气装置。向250 mL碘量瓶中加入20 mL氨性硫酸锌溶液和100 mL水,按图1将玻璃导气管插入到碘量瓶中。
称取产品电解二氧化锰约4 g(精确至0.000 1 g),分别经前期研究[2]四氯化碳法和盐酸-氯化钠溶液或碳酸钠溶液浸提后,滤渣(电解二氧化锰)置于500 mL的圆底反应瓶中,加入10 g固体抗坏血酸,加100 mL水,轻轻摇动使试样完全分散,立即按图1连接好各部件。
由分液漏斗向反应瓶加入10 mL盐酸(1+1),迅速关闭活塞。开启氮气阀,控制气体流量为100~150 mL/min(每秒4~5个气泡),将反应瓶的溶液加热至微沸20~25 min,停止加热,继续通气4~5 min。
关闭氮气阀,用水冲洗玻璃导气管。将溶液冷却至室温,加入15.00 mL碘酸钾标准滴定溶液,在充分搅拌下加入30 mL盐酸(1+1),于暗处放置5 min,用硫代硫酸钠标准滴定溶液滴定至淡黄色后,加入约2 mL淀粉溶液(10 g/L),再继续滴定至蓝色消失,记录滴定消耗硫代硫酸钠标准滴定溶液体积V2。圆底反应瓶中盐酸分解液过滤于400 mL烧杯中,用50~60 ℃水洗涤反应瓶及滤纸5~7次。滤液按硫酸钡重量法测定硫,结果为电解二氧化锰结合态的硫酸盐之硫含量。
1.3.3 结果的计算与表示
电解二氧化锰中硫化物中硫的质量分数w(S2-)按下式计算:
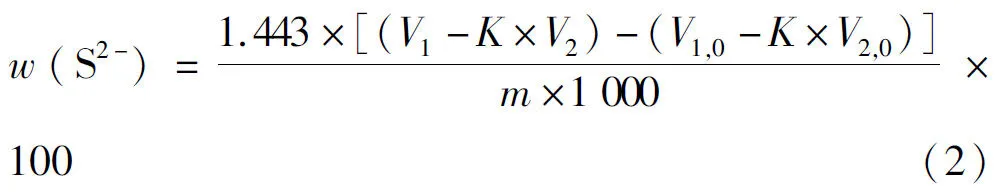
式(2)中w(S2-)为硫化物硫的质量分数(以SO2-4计),%;V1为加入碘酸钾标准滴定溶液的体积,mL;V2为滴定时消耗硫代硫酸钠标准滴定溶液的体积,mL;V1,0为空白试验加入碘酸钾标准滴定溶液的体积,mL;V2,0为空白试验消耗硫代硫酸钠标准滴定溶液的体积,mL;K为碘酸钾标准滴定溶液与硫代硫酸钠标准滴定溶液的体积比;m为电解二氧化锰试样的质量,g;1.443为碘酸钾标准滴定溶液对硫的滴定度,mg/mL。电解二氧化锰结合态的硫酸盐之硫含量的质量分数按下式计算:
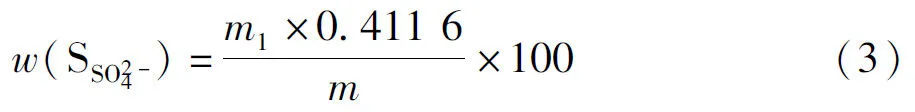
式(3)中w(SSO2-4)为电解二氧化锰结合态的硫酸盐之硫含量(以SO2-4计),%;m1为硫酸钡沉淀的质量,g;m为电解二氧化锰试样的质量,g;0.411 6为硫酸钡换算成硫酸根的换算因子的数值。
2 试验结果与讨论
2.1 还原剂选择
标准文献《萤石 硫化物含量的测定 碘量法》(GB/T 5195.4—2006)和《水泥化学分析方法》(GB/T 176—2017)采用氯化亚锡作为还原剂测定萤石、水泥中硫化物[4-5];《水质 硫化物的测定 亚甲基蓝分光光度法》(HJ 1226—2021)、《土壤和沉积物 硫化物的测定 亚甲基蓝分光光度法》(HJ 833—2017)采用抗坏血酸、乙二胺四乙酸二钠及氢氧化钠混合溶液为抗氧化剂测定水、土壤和沉积物中硫化物[6-7]。电解二氧化锰在酸性溶液中,均可与氯化亚锡、草酸、草酸钠、抗坏血酸反应,考虑检测硫化物后反应液要进一步进行硫酸钡重量法测定电解二氧化锰结合态的硫酸盐含量,会因锡离子易水解、残留草酸根与钡离子形成沉淀,从而干扰后续硫酸钡重量法测定试验,固试验采用维生素C(C6H8O6)作为还原剂,盐酸分解电解二氧化锰。其化学反应式如下:
C6H8O6(维生素C)+MnO2+2H+=C6H6O6(脱氢维生素C)+Mn2++2H2O
C6H6O6为脱氢维生素C,维生素C、脱氢维生素C结构式见图2。
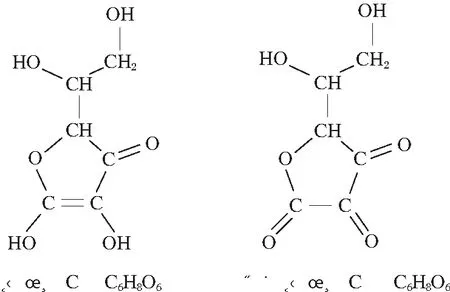
图2 维生素C、脱氢维生素C结构式
2.2 试验结果
采用前期研究[2]四氯化碳法来分离1#、2#电解二氧化锰产品中的单质硫,再用弱酸性的氯化钠-盐酸溶液或碱性的碳酸钠溶液作为溶剂分离电解二氧化锰产品中游离态硫酸盐,并测相应的硫含量。所得的电解二氧化锰按本文1.3.2章节试验步骤测定其硫化物和结合态硫酸盐的硫含量,结果见表1。
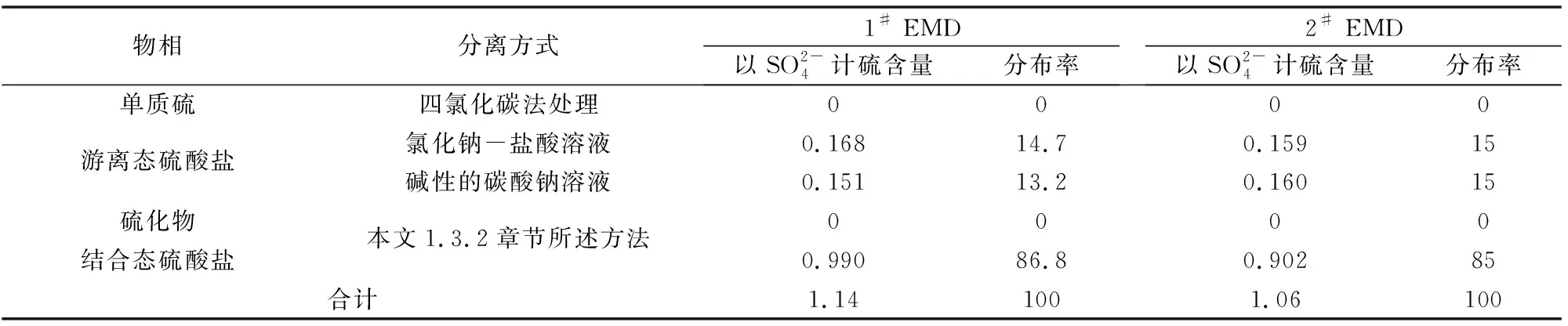
表1 电解二氧化锰产品中的硫化学物相分析结果 %
由表1电解二氧化锰产品中的硫化学物相分析结果可知,某公司生产的电解二氧化锰产品中的硫由结合态硫酸盐和游离态硫酸盐组成,无单质硫和硫化物,二氧化锰结合态硫酸盐占85%~87%,游离态硫酸盐占13%~15%。
2.3 讨论
电解二氧化锰的结合水存在于二氧化锰晶格中,成为二氧化锰晶格的组成部分,含量一般为3%~5%[8-10],结合水的存在有利于质子在二氧化锰晶格内的扩散,对二氧化锰的电化学活性有利。同时也不利于二氧化锰晶格附近的H+、SO2-4、Mn2+等离子向外扩散。由表1电解二氧化锰产品中的硫化学物相分析结果可知:用氯化钠-盐酸溶液或碱性的碳酸钠溶液作为溶剂,游离态硫酸盐含量基本一致,要使电解二氧化锰完全溶解于溶液,破坏二氧化锰晶格,才能完全测定二氧化锰产品的硫含量。
3 结 论
对某电解二氧化锰产品中硫进行化学物相分析方法研究,采用四氯化碳法来分离电解二氧化锰产品中的单质硫;弱酸性的氯化钠-盐酸溶液或碱性的碳酸钠作为溶剂分离电解二氧化锰产品中非晶体包裹硫酸盐;再在还原条件下,用盐酸分解,产生的硫化氢气体收集于氨性硫酸锌溶液中,然后用碘量法测定其硫化物含量;过滤盐酸分解液,用50~60 ℃水洗涤反应瓶及滤纸5~7次。滤液按硫酸钡重量法测定硫,结果为电解二氧化锰晶体包裹的硫酸盐之硫含量。某公司生产的电解二氧化锰产品中各价态硫含量总和与总硫量吻合,试验证明无单质硫和硫化物存在,电解二氧化锰晶体包裹的硫酸盐和非晶体包裹硫酸盐的硫分别为85%~87%和13%~15%。
