土荆皮乙酸诱导人前列腺癌细胞系DU145凋亡
2022-09-27刘冬梅
刘冬梅,徐 强,李 峰
(1.南通市肿瘤医院 病理科,江苏 南通 226006;2.南通大学附属医院 检验科, 江苏 南通 226001)
前列腺癌(prostate cancer, PC)是男性最常见的治疗生殖系统肿瘤之一,在中国由于饮食方式的改变和人口老龄化的加快,PC患者数量显著增加[1-2]。目前,早期患者通过手术切除和放化疗等手段达到良好的治疗效果[3],但是仍然有约22%的患者存在晚期或转移的风险,严重威胁男性的生命健康,迫切需要开发更有效的新型靶向药物来预防和治疗前列腺癌。有研究证实萜类化合物具有广泛的生物活性,包括潜在的治疗作用[4]。土荆皮乙酸(pseudolaric acid B,PAB)是二萜类化合物的一种,已有研究证实PAB通过诱导细胞凋亡,显著抑制肿瘤细胞的生长和增殖,并影响细胞周期以及抑制肿瘤血管生成等,是一种新型的微管抑制剂[5]。
过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)是一种转录因子。目前有研究表明PAB是一种新的PPARγ激动剂[6],并能够诱导喉癌、肺癌等多种肿瘤细胞发生凋亡[7]。本研究选用PAB刺激观察其对人前列腺癌细胞系DU145的增殖、凋亡的影响,并探讨其可能作用的分子机制,以期将其作为有效的前列腺癌干预和化学预防的重要措施,为临床前期试验做好基础研究准备。
1 材料与方法
1.1 材料
人PC细胞系DU145(中国科学院典型培养物保藏委员会细胞库),RPMI-1640培养基和胰蛋白酶(HyClone公司);胎牛血清(Gibco公司);annexin V-FITC/PI染料试剂盒、TUNEL试剂盒(诺维赞公司);CCK-8检测试剂盒(日本同仁化学研究所);相关抗体Bcl-2、Bax、PTEN、AKT、p-AKT(CST公司)、β-actin(Sigma-Aldrich公司);土荆皮乙酸(PAB)(大连美仑生物技术公司)、GW9662(Med Chem Express公司);BCA 蛋白浓度测定试剂盒(Thermo Fisher Scientific公司)、DAPI、RIPA裂解液、PMSF、SDS-PAGE凝胶配制试剂盒(碧云天生物技术公司); High-sig ECL高灵敏度化学发光液(上海天能科技公司)。
1.2 方法
1.2.1 细胞的分组及处理:用含10% FBS的1640培养基在37 ℃、5% CO2条件下培养DU145细胞。取对数增殖期的DU145细胞,按3 000个/孔均匀接种于96孔板(每孔体积100 μL),待贴壁后将细胞分别置于PAB终浓度为0(0.5% DMSO)、5、10、20和40 μmol/L的完全培养基中,各浓度设3个复孔,置于细胞培养箱中培养。将细胞分3组:对照组(加0.5% DMSO)、PAB组(加PAB终浓度10 μmol/L)和GW9662+PAB组(GW9662终浓度35 μmol/L处理12 h后再加入PAB终浓度10 μmol/L)。待后续进行凋亡和迁移等实验。
1.2.2 CCK8检测细胞:分别在培养后24、48、72和96 h的时间点向每孔加入事先混匀好的CCK-8预混液(90 μL基础培养基 +10 μL CCK-8 溶液配置)。加入 CCK-8溶液后将96孔板放入培养箱内继续孵育2 h。用酶标仪在波长450 nm处测定每孔吸光度(A) 值。
1.2.3 流式检测细胞凋亡:按1.2.1中的分组,取细胞2×106个/孔接种于6孔板。胰蛋白酶消化收集细胞,预冷PBS洗涤2次,4 ℃离心(1 000 r/min,5 min);加入100 μL 1×结合缓冲液并轻轻吹匀至单细胞悬液;分别加入 5 μL annexin V-FITC和 5 μL PI,避光、室温孵育10 min;加入400 μL 1×结合缓冲液并轻轻吹匀,1 h内进行流式检测。
1.2.4 TUNEL法检测细胞凋亡:调整细胞为2×105个/mL并接种于24孔板中。待细胞贴壁后,按照试剂盒说明书操作最后经TUNEL反应混合液显色,用 DAPI显色剂染细胞核,然后在荧光显微镜下分析样本[在(620±20)nm的荧光下观察BrightRed红色荧光和在460 nm下观察DAPI蓝色荧光]。
1.2.5 划痕实验检测细胞迁移:将细胞分组处理24 h后,将细胞按6×105个/孔均匀接种于6孔板中,按文献[8]操作处理后在显微镜下拍照。
1.2.6 Transwell小室法检测细胞侵袭:Matrigel基质胶用预冷的1640培养基按1∶6进行稀释,向tranwell小室的上室内加入已经稀释好的基质胶100 μL,在恒温培养箱中放置6 h;按文献[8]操作步骤处理如上3组细胞,待48 h后经4%多聚甲醛固定30 min,PBS清洗3次,用0.1%结晶紫染细胞核,镜下随机选取5个视野观察并拍照,统计分析。
1.2.7 Western blot检测凋亡途径相关蛋白及PTEN/AKT通路蛋白表达:将各组细胞处理48 h后用RIPA裂解液裂解,离心收集蛋白。BCA定量,SDS-PAGE 蛋白电泳,转膜(300 mA,100 min),5%脱脂奶封闭; 一抗4 ℃孵育过夜(1∶1 000),二抗(1∶5 000),37 ℃恒温箱孵育90 min;发光鉴定,Imagelab软件分析结果。
1.3 统计学分析

2 结果
2.1 PAB对DU145细胞增殖的影响
随着PAB浓度增加和作用时间的延长,DU145细胞增殖能力明显降低(图1)。在随后的实验中选择PAB浓度为10 μmol/L。

*P<0.01, **P<0.001 compared with control group图1 PAB对DU145细胞增殖的影响Fig 1 Effect of PAB on the proliferation of DU145 cells
2.2 PAB对DU145细胞凋亡的影响
与对照组相比,PAB组细胞凋亡率显著增高(P<0.01)。与PAB组相比,GW9662+PAB组细胞凋亡率显著降低(P<0.05)(图2)。
2.3 TUNEL法观察细胞凋亡
与对照组相比,PAB组的细胞凋亡显著增加(P<0.001)。与PAB组相比,GW9662+PAB组的细胞凋亡率显著下降(P<0.001)(图3)。
2.4 PAB对DU145细胞迁移、侵袭的影响
与对照组比较,PAB组细胞划痕愈合率和穿膜细胞数均显著减少(P<0.05)。与PAB组相比,GW9662+PAB组的细胞划痕愈合率和穿膜细胞数均显著增高(P<0.05)(图4)。
2.5 PAB对BAX、Bcl-2及PTEN/AKT通路蛋白表达的影响
与对照组相比,PAB组细胞Bax和PTEN蛋白表达量显著增加,而Bcl-2、p-AKT 蛋白表达量明显降低(P<0.05)。与PAB组相比,GW9662+PAB组细胞Bax和PTEN蛋白表达量显著降低,Bcl-2、p-AKT蛋白表达量明显增高(P<0.05)(图5)。
3 讨论
局灶性前列腺癌患者一般5年生存率可达88%,而进展型前列腺癌患者经去势治疗的5年生存率只有29%,后期更会进展为去势抵抗性前列腺癌[9],这也是导致化疗效果差和病死率增加的重要原因。目前已有研究表明脂质代谢的改变导致PPARγ信号丢失是前列腺癌的易感因素[10]。

A.detection of DU145 cell apoptosis rates in control, PAB and GW9662+PAB group, repectively; B.statistical analysis of the flow cytometry results; *P<0.01 compared with control group; #P<0.05 compared with PAB group
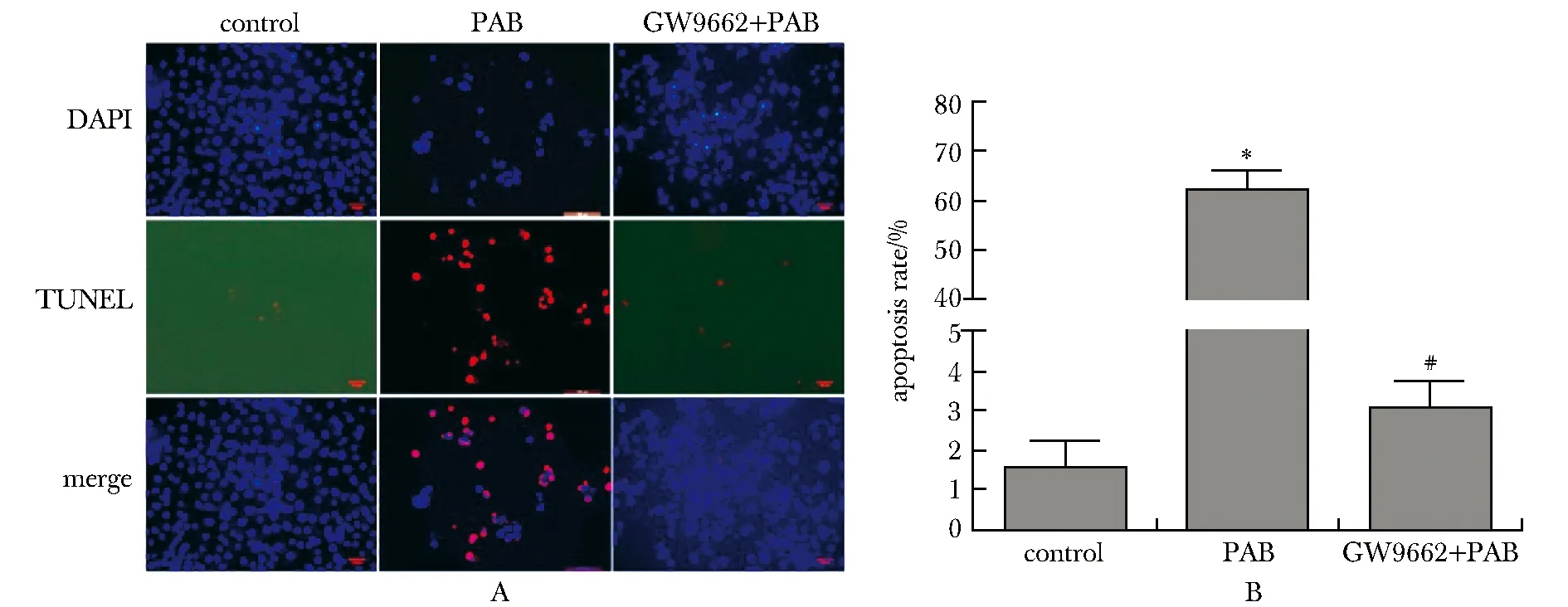
A.detection of PAB on DU145 cell apoptosis(×200); B.statistical analysis of the TUNEL results;*P<0.001 compared with control group; #P<0.001 compared with PAB group
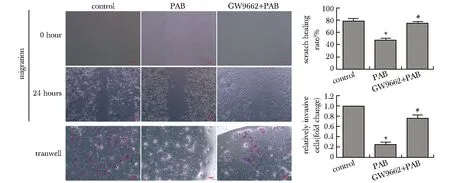
*P<0.05 compared with control group; #P<0.05 compared with PAB group图4 PAB对DU145细胞迁移、侵袭的影响Fig 4 Effect of PAB on the migration and invasion of DU145 cells(×100)
近年来随着对癌预防和治疗的深入研究发现,PAB对多种癌细胞具有抑制增生作用且能够诱导癌细胞的凋亡[7,11]。本研究发现PAB对DU145细胞增殖抑制呈现明显的时间剂量依赖方式,同时PAB显著抑制前列腺癌DU145细胞的迁移和侵袭能力,提示其作为有效的小分子药物对前列腺癌干预和化学预防的潜力。
细胞凋亡中最显著的特点是发生大量的DNA双链断裂。TUNEL技术检测凋亡是利用分子生物学和形态学相结合的方法,能准确地反映出细胞凋亡时的形态。研究结果发现,经PAB单独处理过的细胞能被明显染色,细胞核形态发生明显皱缩,细胞凋亡率明显增加,结合流式细胞检测结果,进一步证明PAB诱导人前列腺癌细胞系DU145的调亡。
此外抑制PI3K/AKT信号通路下调 Bcl-2/Bax表达比例,可诱导细胞肿瘤细胞凋亡[12]。本实验中通过Western blot检测发现PAB对DU145细胞增殖的抑制可能也通过改变 Bcl-2/Bax相对蛋白表达比例,从而诱导细胞发生凋亡来实现。同时PAB上调 PTEN蛋白表达, 进而抑制AKT信号通路的激活,诱导细胞产生凋亡。GW9662为PPARγ选择性拮抗剂,有研究显示,在对小鼠动脉粥样硬化的模型中,GW9662逆转PAB的作用[13]。分别采用PAB和GW9662处理DU145细胞后发现,PAB显著提高PTEN蛋白的表达量,从而使AKT信号通路的激活受阻,诱导细胞凋亡的产生。GW9662可逆转这一变化。以上结果表明PPARγ相关的PTEN/AKT通路可能是PAB抑制肿瘤细胞增殖、侵袭和诱导细胞凋亡的潜在信号通路,为PAB应用于临床抗前列腺癌提供了实验基础和依据。但是,本研究也有不足之处,只研究了PPARγ配体激动剂调节的一方面,涉及的其他相关信号通路及关键靶分子还需要进一步深入研究,以明确其具体调控机制。同时PAB抑制前列腺癌的迁移侵袭等作用还需要体内实验来进一步验证。
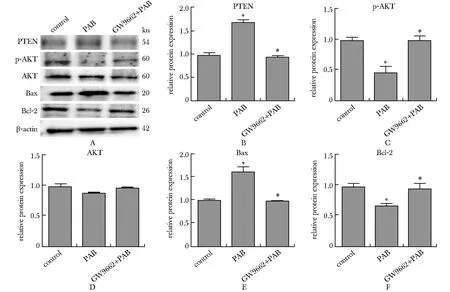
A.Western blot of BAX, Bcl-2, PTEN, p-AKT and AKT protein expressions; B-F.statistical analysis of the Western blot results; *P<0.05 compared with control group; #P<0.05 compared with PAB group
总之,本研究结果表明PAB通过PTEN/AKT信号通路抑制前列腺癌细胞系DU145的增殖、侵袭和诱导细胞的凋亡,提示其作为有效的小分子药物对前列腺癌干预和化学预防的潜力。但是作为一种二萜类化合物,PAB是否通过其他信号通路及关键靶分子抑制前列腺癌生长还需要进一步深入研究。
