EPAS1 siRNA抑制人肾透明细胞癌细胞系HiMet-ccRCC的增殖、迁移及侵袭
2022-09-27陈海滨赵建军
陈海滨,赵建军,谭 超
(河北工程大学附属医院 泌尿外二科, 河北 邯郸 056004)
肾细胞癌是常见泌尿系统恶性肿瘤之一,具有高发病率、高致死率特点,其中70%左右患者为肾透明细胞癌(renal clear cell carcinoma)。肾透明细胞癌恶性程度较高,多数患者对放射治疗和化学药物治疗(简称放化疗)、激素治疗等不敏感,预后效果不佳[1-2]。故而,探究肾透明细胞癌发病机制并发现其生物治疗靶标,对于改善患者预后意义重大。内皮PAS区域蛋白1(endothelial PAS domain-containing protein 1,EPAS1)作为转录因子,在细胞应对缺氧时发挥关键作用,与肿瘤发生发展有关[3-4]。目前有关EPAS1 siRNA对肾透明细胞癌细胞增殖、迁移及侵袭能力的影响鲜有报道,因此本研究以人肾透明细胞癌HiMet-ccRCC为研究对象,采用RNA干扰技术观察EPAS1对肾透明细胞癌HiMet-ccRCC细胞生物学行为的影响。
1 材料及方法
1.1 材料与试剂
人肾透明细胞癌细胞系HiMet-ccRCC(北京北纳创联生物技术研究院);MEM-EBSS培养基(Hyclone公司);LipofectamineTM3000试剂盒(上海吉雅生物科技有限公司);EPAS1 siRNA、non-target siRNA及引物序列(上海生工公司),其中EPAS1 siRNA序列为:正义链:5′-AATTCCACTTGATGCC ATAGGCCTGTCTC-3′和反义链:5′-AACCTATGGC ATCAAGTGGAACCTGTCTC-3′,non-target siRNA序列为:正义链:5′-AAATACAGGGTGGTGTTCCAGC CTGTCTC-3′和反义链:5′-AACTGGAACACCACCCT GTATCCTGTCTC-3′,序列带有FITC标记,以便鉴定转染效率;Matrigel基质胶(北京泽平科技有限公司);3-2(4,5-二甲基噻唑-2)-2-四甲基偶氮噻唑蓝(MTT)(Sigma-Aldrich公司);兔源E-cadherin、N-cadherin、MMP-9、PCNA、GAPDH一抗及对应二抗(北京索莱宝科技有限公司)。
1.2 方法
1.2.1 细胞的分组及处理:取HiMet-ccRCC细胞并将其复苏,培养于含10%灭活FBS+MEM-EBSS培养基中,于37 ℃、5% CO2培养箱中培养,待细胞增长良好且达对数增长期时进行后续实验。
将HiMet-ccRCC细胞重悬后接种于24孔板(2.5×105个/孔);对细胞进行转染,细胞分组:1)对照(control,Con)组;2)阴性对照(negative control,NC)组:加入5 μL Lipofectamine3000和50 pmol/μL国际通用的与所有基因均无同源性序列的non-target siRNA[5];3)沉默EPAS1表达组(EPAS1 siRNA组):加入5 μL Lipofectamine3000和50 pmol/μL EPAS1 siRNA,每组6个复孔。转染24 h后进行后续实验。
1.2.2 RT-qPCR检测各组细胞EPAS1 mRNA表达[6]:各组HiMet-ccRCC细胞使用Trizol试剂进行总RNA提取,测定RNA质量及浓度后将其反转录合成cDNA,然后将2.0 μL cDNA、各2.0 μL上下游引物(表1)、10 μL ULtraSYBR mixture与4.0 μL ddH2O混匀制备反应体系,随后置于荧光定量PCR仪上扩增[设定程序为93 ℃ 30 s,(93 ℃ 5 s、65 ℃ 30 s)×40个循环]。以GAPDH为内参,以2-△△Ct法计算EPAS1 mRNA含量。

表1 引物序列Table 1 Primer sequence
1.2.3 MTT法检测HiMet-ccRCC细胞增殖能力:将转染24 h后的各组HiMet-ccRCC细胞接种于96孔板(5×103个/孔,100 μL),分别于培养0、24、48 h后向各孔中加入20 μL MTT溶液(5 ng/mL),继续培养4 h后弃去上清,添加150 μL DMSO溶解结晶。用FC酶标仪测定各孔细胞在490 nm处的吸光度值(A490 nm),并计算细胞增殖抑制率(%)=(1-实验组A490 nm/对照组A490 nm)×100%。
1.2.4 Transwell小室法测定细胞侵袭、迁移能力:1)细胞侵袭:以不含胎牛血清的MEM-EBSS培养基重悬细胞,按3×103个/孔(200 μL)加入到Transwell小室上层(Transwell小室上层经50 μL 2.0 mg/mL液态Matrigel基质胶预包被),500 μL含10%胎牛血清的MEM-EBSS培养基加入下层,24 h后取出小室,轻轻擦去Matrigel基质胶及上层残留细胞,冲洗后甲醛固定、结晶紫染色。封片后显微镜下观察染色细胞并拍照,随机选6个视野,统计各组细胞侵袭数(Image J软件),取均值。2)细胞迁移:不需要铺胶,其余操作步骤同细胞侵袭实验。
1.2.5 免疫印迹法检测增殖、侵袭、迁移相关蛋白表达:收集并裂解转染24 h后的各组HiMet-ccRCC细胞以提取总蛋白,并参照BCA蛋白定量试剂盒说明书检测蛋白浓度,各样品取30 μg变性的蛋白进行12% SDS-PAGE电泳并转至PVDF膜,封闭(5%脱脂奶粉)2 h后加入一抗(E-cadherin、N-cadherin、MMP-9、PCNA、GAPDH,1∶500稀释),4 ℃孵育过夜,加入二抗(HRP标记山羊抗兔,1∶1 000稀释),室温孵育2 h。显色、曝光,采用Image J软件定量蛋白。
1.3 统计学分析

2 结果
2.1 稳定转染细胞系鉴定
EPAS1 siRNA组细胞转染效果,在镜下均可见绿色荧光,HiMet-ccRCC细胞成功转染non-target siRNA、EPAS1(图1)。

left.cell morphology in bright field; right.cell fluorescence (green fluorescence)图1 荧光显微镜检测NC组、EPAS1 siRNA组转染情况Fig 1 Detection of siRNA transfection in NC group and EPAS1 group by fluorescence microscope(×200)
2.2 RT-qPCR检测HiMet-ccRCC细胞EPAS1 mRNA表达
EPAS1 siRNA组细胞EPAS1 mRNA表达水平明显低于对照组、阴性对照组(P<0.05)(表2)。
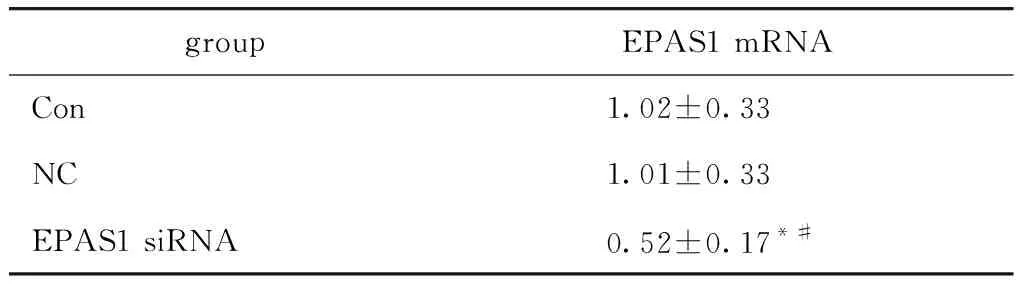
表2 HiMet-ccRCC细胞EPAS1 mRNA表达水平
2.3 MTT法检测HiMet-ccRCC细胞增殖
与对照组、阴性对照组比较,24或48 h后EPAS1 siRNA组HiMet-ccRCC细胞增殖抑制率均显著升高(P<0.05),由于48 h细胞增殖抑制率升高更为明显,因此后续实验选择48 h进行后续实验(表3)。

表3 HiMet-ccRCC细胞增殖情况比较
2.4 各组HiMet-ccRCC细胞侵袭及迁移情况比较
与对照组、阴性对照组比较,EPAS1 siRNA组HiMet-ccRCC细胞迁移数、侵袭数均显著减少(P<0.05)(图2~3,表4)。
2.5 蛋白质印迹法检测增殖、迁移、侵袭相关蛋白表达
与对照组、阴性对照组比较,EPAS1 siRNA组HiMet-ccRCC细胞中E-cadherin蛋白表达上调(P<0.05),N-cadherin、MMP-9、PCNA蛋白表达下调(P<0.05)(图4,表5)。

图2 HiMet-ccRCC细胞迁移情况比较Fig 2 Comparison of migration of HiMet-ccRCC cells (×200)

图3 各组HiMet-ccRCC细胞侵袭情况比较Fig 3 Comparison of invasion of HiMet-ccRCC cells in each group (×200)

表4 各组HiMet-ccRCC细胞迁移及侵袭情况比较

图4 Western blot检测各组HiMet-ccRCC细胞增殖、迁移、侵袭相关蛋白Fig 4 Western blot diagram of proliferation, migration and invasion related proteins of HiMet-ccRCC cells in each group
3 讨论
EPAS1是细胞应对低氧环境的关键转录因子,与血管生成及肿瘤发生关系密切[7]。研究显示,EPAS1rs11894252位点基因多态性与肾透明细胞癌发生有关,且可作为肾透明细胞癌预后标志物[8]。既往研究显示,在原发性和转移性肾透明细胞癌小鼠模型中注射新型EPAS1抑制剂PT2399可导致肿瘤消退[9]。抑制胰腺癌细胞中EPAS1基因表达,能够诱导胰腺癌细胞凋亡及抑制细胞增殖[10]。与正常对照组比较,肾透明细胞癌患者血清EPAS1水平升高,且与淋巴结转移有关,提示EPAS1异常高表达可能参与肾透明细胞癌发生发展过程[11]。非小细胞肺癌细胞PC14HM中敲低EPAS1可抑制体外细胞增殖和体内肿瘤生长,并抑制体内PC14HM细胞腹膜转移[12]。推测抑制EPAS1表达可明显抑制肾癌细胞活力,并促进细胞凋亡、降低肾癌细胞迁移、侵袭能力。本研究中随着培养时间的延长,EPAS1 siRNA组HiMet-ccRCC细胞增殖抑制率明显升高,且在不同时间点EPAS1 siRNA组HiMet-ccRCC细胞增殖抑制率高于对照组、阴性对照组;进一步实验发现,EPAS1 siRNA组HiMet-ccRCC细胞迁移、侵袭数高于对照组、阴性对照组,提示抑制EPAS1基因表达使肾透明细胞癌HiMet-ccRCC细胞增殖、迁移及侵袭等恶性行为得到一定控制。
PCNA可通过调节DNA复制、DNA修复等途径参与癌变过程,是一个促细胞增殖因子[13]。MMP-9作为基质金属蛋白酶家族分子质量最大的成员,通过降解、破坏细胞外基质成分在肿瘤转移过程中发挥重要作用[14]。以细胞黏附分子(如E-cadherin)表达减少、具有间质源性的N-cadherin等表达升高为主要特征的EMT是上皮细胞来源恶性肿瘤细胞获得转移能力的重要生物学过程,调控着癌细胞迁移、侵袭行为[15]。过表达冷诱导RNA结合蛋白可抑制肾癌细胞增殖及迁移,且肾癌细胞中N-cadherin表达明显降低,E-cadherin表达增高[16]。本结果显示,转染EPAS1 siRNA后,HiMet-ccRCC细胞中E-cadherin显著上调,N-cadherin、MMP-9、PCNA显著下调,表明沉默EPAS1抑制HiMet-ccRCC细胞增殖、迁移及侵袭可能与调控E-cadherin、N-cadherin、MMP-9、PCNA表达有关。

表5 各组HiMet-ccRCC细胞增殖、迁移、侵袭相关蛋白表达比较
综上所述,沉默EPAS1可调控E-cadherin、N-cadherin、MMP-9、PCNA表达,抑制HiMet-ccRCC细胞增殖、迁移及侵袭,提示EPAS1在肾透明细胞癌发生和进展中可能为肿瘤促进因子,有望成为肾透明细胞癌的潜在生物靶标。
