混合盐胁迫对白榆幼苗形态及生理指标的影响
2022-09-27郝艳玲闫伟
郝艳玲, 闫伟
(内蒙古农业大学林学院,呼和 浩特 010000)
土壤盐碱化是全球最为严峻的生态问题,已成为影响全球植物生长发育的胁迫因素之一[1]。盐碱胁迫使植物出现生长缓慢、黄化早衰、品质下降以及产量降低等不良表现[2-5]。我国盐渍土面积约占国土面积的25%,近年来,随着气候的变化、环境污染以及对土地使用不当等原因,导致次生盐渍化土壤面积逐年增加[6]。据调查,我国约有2 000 万 hm2的盐碱地和 600 万 hm2的盐渍化土壤[6]。我国绝大部分地区的盐碱地所含盐分复杂,土壤盐化与碱化往往同时发生,对植物构成盐、碱双重胁迫[7]。盐碱害已成为当今造林绿化面临的重要问题。
白榆(Ulmus pumila)又称家榆,为榆科榆属多年生落叶乔木,广泛分布于我国大部分地区。榆树历来是我国北方城市五大乡土园林树种之一,也是世界四大行道绿化树种之一[8],其具有萌蘖能力强、根系发达、木质好、长速快、环境适应性强、抗虫抗病、抗风、抗污染能力强和保持水土能力强等特点[9],已成为我国北方重要的造林树种之一[10];同时,白榆在耐盐碱抗旱等方面也具有一定优势[11-12],可作为盐碱地区造林绿化中的首选树种。因此,研究榆树对土壤混合盐胁迫的响应机制具有重要的理论价值和实际指导意义。
盐碱土中的氯化物、碳酸盐及盐分含量会对植物的存活产生一定的影响,是限制盐碱土分布区植物生长、植被恢复最直接的因素。目前,国内关于白榆抗盐碱胁迫方面的研究多数为单一因子的研究[13-16],关于混合盐胁迫的研究相对较少。混合盐碱胁迫可更好地模拟植物耐盐碱性的实际情况,对耐盐碱品种的选育研究具有实际意义[17]。本研究采用等浓度的NaCl 和NaHCO3混合盐进行胁迫处理,旨在探究混合盐胁迫对白榆幼苗生长、生理指标的影响,并通过耐盐性评价,探究混合盐胁迫条件下白榆幼苗的生长和适应机制,旨在为盐碱地耐盐碱品种的筛选和培育提供参考依据。
1 材料与方法
1.1 试验材料
试验于2020年5—10月在内蒙古农业大学东校区(E 111°70′30″,N 40°81′10″)林学院人工气候室中进行,该地区海拔1 044 m,设定人工气候室温度为20±5 ℃。试验所用的白榆种子于2020年5月采自内蒙古农业大学东校区,千粒重为(5.927 9±0.000 2)g,搓翅去杂,水选剔除空粒和杂质后,自然风干备用。
1.2 试验方法
选择大小一致、饱满且无病虫害的种子,先用质量浓度为1%的高锰酸钾溶液浸泡15 min 消毒,再用蒸馏水冲洗干净,浸泡于27 ℃清水中进行24 h催芽处理,随后播种于基质(主要为蛭石和营养土,体积比为2∶1)中,营养钵高15 cm,直径12 cm。3个月后,选取长势相同的幼苗54 株,重新植苗,每钵种植3 株幼苗。试验开始时浇灌含有等浓度NaCl 和NaHCO3溶液进行处理,设置6个混合盐浓度处理[0(CK)、10(T1)、30(T2)、50(T3)、70(T4)、100(T5)mmol·L-1],每个处理均设置3 次生物学重复。试验开始时,取100 mL 对应浓度的混合盐溶液进行浇灌处理,控制单一变量,使用称重法[18]进行定时补水,以保持土壤中的盐浓度不变。连续胁迫35 d,每7 d的清晨取位于小枝条中部叶片进行单株采样,每个处理采样重复3次,用于测定生理指标。
1.3 指标测定
1.3.1 生长指标测定 在盐胁迫处理前对白榆幼苗的株高(H1)和地径(D1)进行测量;胁迫35 d 后对其株高(H2)与地径(D2)进行第2 次测量,并计算白榆幼苗株高增长量和地径增长量。待所有盐胁迫处理试验结束后用低温烘干法测定其根部干重及地上部分干重,并计算其总生物量、根冠比以及盐耐受系数(salt tolerance coefficient,STI)[19],计算公式如下。

式中,DW盐为盐处理下植株干重,DW对照为对照植株干重。
1.3.2 生理指标测定 参照《植物生理生化实验原理和技术》[20],利用UV-2800H 紫外分光光度计[尤尼柯(上海)仪器有限公司]测定白榆幼苗的生理指标,其中过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定;超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑法测定;丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸法测定;可溶性糖(soluble saccharin,SS)含量采用蒽酮比色法测定;叶绿素(cholrophyll,CHL)含量采用丙酮法测定;电导率采用浸泡法测定。
1.4 数据分析
采用Microsoft Excel 2010 软件对数据进行整理,采用SPASS 24.0软件进行方差分析、显著性检验及多重比较。
2 结果与分析
2.1 混合盐胁迫对白榆幼苗生长指标的影响
2.1.1 混合盐胁迫对白榆幼苗株高增长量和地径增长量的影响 由图1 可知,不同盐浓度胁迫下,白榆幼苗的株高增长量和地径增长量随盐浓度的增加均显著降低(P<0.05)。T1 处理白榆幼苗的株高增长量和地径增长量分别为4.37、0.38 mm,分别较 CK 降低了 42.95%、54.31%;T2 与 CK 相比,株高增长量和地径增长量分别降低61.22%、73.47%。T3、T4、T5 处理抑制作用进一步增强。结果表明白榆幼苗对混合盐胁迫敏感,在低浓度盐胁迫下即可产生明显的生长抑制作用。
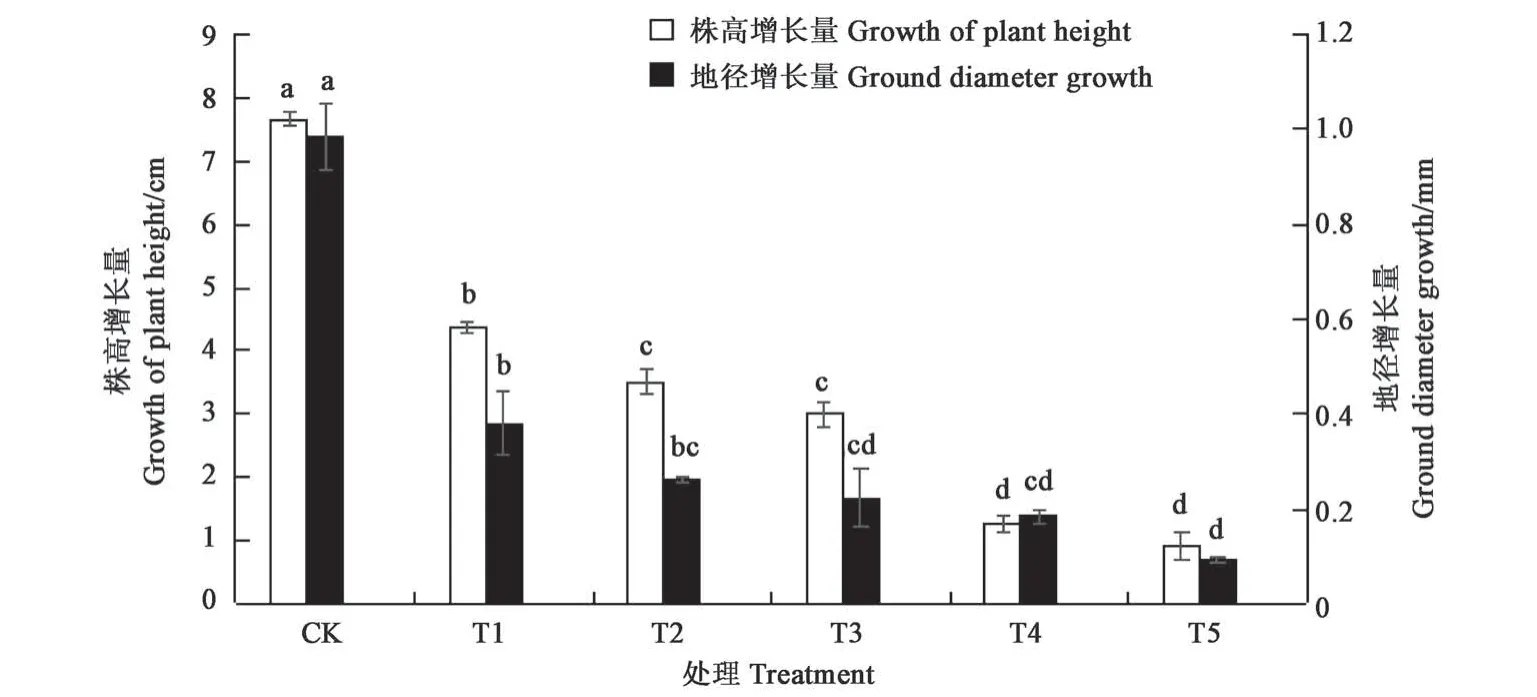
图1 混合盐胁迫下白榆幼苗的株高增长量和地径增长量Fig.1 Plant height growth and ground diameter growth of Ulmus pumila seedlings under mixed salt stress
2.1.2 混合盐胁迫对白榆幼苗生物量、盐耐受系数的影响 由表1 可知,总生物量、根质量和盐耐受系数均随盐胁迫浓度增加而下降,各处理组与CK 相比差异显著(P<0.05)。T5 处理白榆幼苗的总生物量、根质量和盐耐受系数下降最明显,与CK 相比,分别降低了60.01%、57.36%、60.0%;T2、T3、T4、T5处理组间总生物量、根质量以及盐耐受系数下降平缓,差异不显著(P>0.05);T1 处理白榆幼苗的总生物量、根质量和盐耐受系数均显著高于其他盐胁迫处理(P<0.05)。根冠比在某种程度上可反映植物在盐胁迫环境下的适应能力,盐胁迫处理根冠比均大于CK,说明盐胁迫对于植株的根系部分抑制作用小于地上部分,T4 处理根冠比最大,与CK 相比,增加了25.66%,但各盐胁迫处理根冠比与CK 相比差异不显著(P>0.05)。结果表明白榆幼苗应对盐胁迫的策略是通过增加幼苗根部生物量来实现的。

表1 混合盐胁迫下白榆幼苗的生物量和盐耐受系数Table1 Biomass and salt tolerance coefficient of Ulmus pumila seedlings under different mixed salt stress
2.2 混合盐胁迫对白榆幼苗生理指标的影响
2.2.1 混合盐胁迫对白榆幼苗MDA 含量及SS 含量的影响 如图2 所示,同一处理时间时,随着盐浓度的增加,MAD 含量也随之增加;T5 处理胁迫7、14、21、28、35 d 时 MDA 含量分别为 3.47、4.33、3.88、3.93、3.61 mol·g-1,分别比 CK 显著增加了17.63%、72.51%、8.99%、35.52%、45.56%(P<0.05)。在同一盐浓度胁迫处理下,白榆幼苗SS 含量在胁迫 7、14、21、28 d 时均呈现先上升后下降的趋势,T2 处理胁迫 7、14、28 d 时 SS 含量均达到最大值。胁迫35 d 时,白榆幼苗SS 含量随着盐胁迫浓度的增加呈现明显下降趋势,各处理组SS含量均显著低于CK(P<0.05)。结果表明,白榆幼苗在盐浓度较低时,细胞膜系统受到损害,MDA 含量增加,但可通过增加可溶性糖含量进行自我调节。
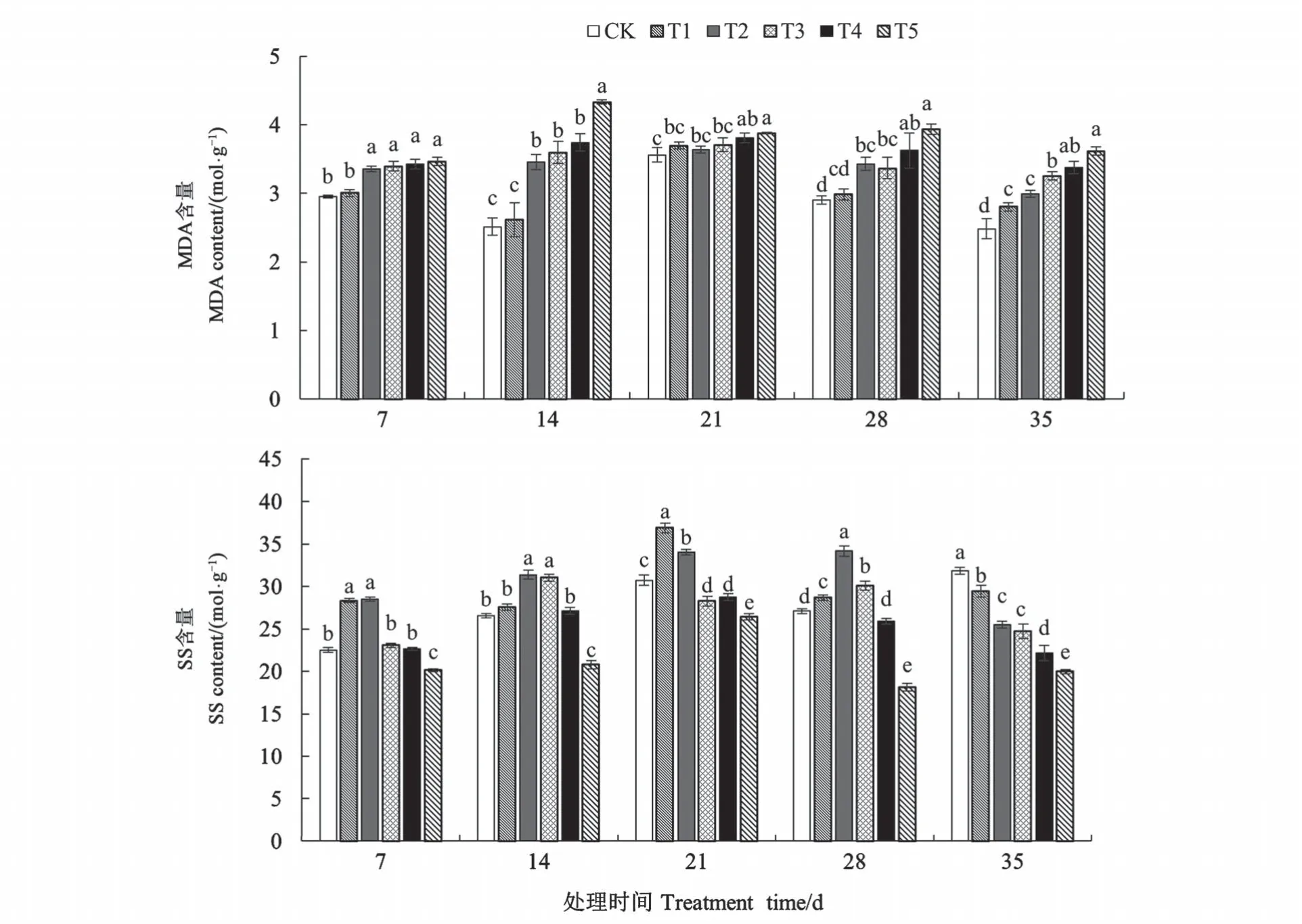
图2 混合盐胁迫下白榆幼苗MDA含量及SS含量的变化Fig.2 Changes of MDA content and SS content of Ulmus pumila seedlings under mixed salt stress
2.2.2 混合盐胁迫对白榆幼苗SOD 活性及POD活性的影响 由图3 可知,同一胁迫处理时间,随着混合盐胁迫浓度的提高,白榆幼苗叶片的SOD活性和POD 活性均呈现先增加后降低的趋势。T2 处理胁迫 7、14、21、28 d 时 SOD 活性均增加到最大值,分别较CK 显著增加了49.25%、22.74%、24.06%、13.55%(P<0.05);T1 处理胁迫35 d 时 SOD 活性达到最大值(P<0.05)。T2 处理胁迫 7、14、21、28、35 时 POD 活性均达到最大值,分别较CK 显著增加了16.82%、12.69%、52.58%、40.66%、31.53%(P<0.05)。结果表明,白榆幼苗可通过提高体内的SOD 活性和POD 活性来抵御低浓度盐胁迫。
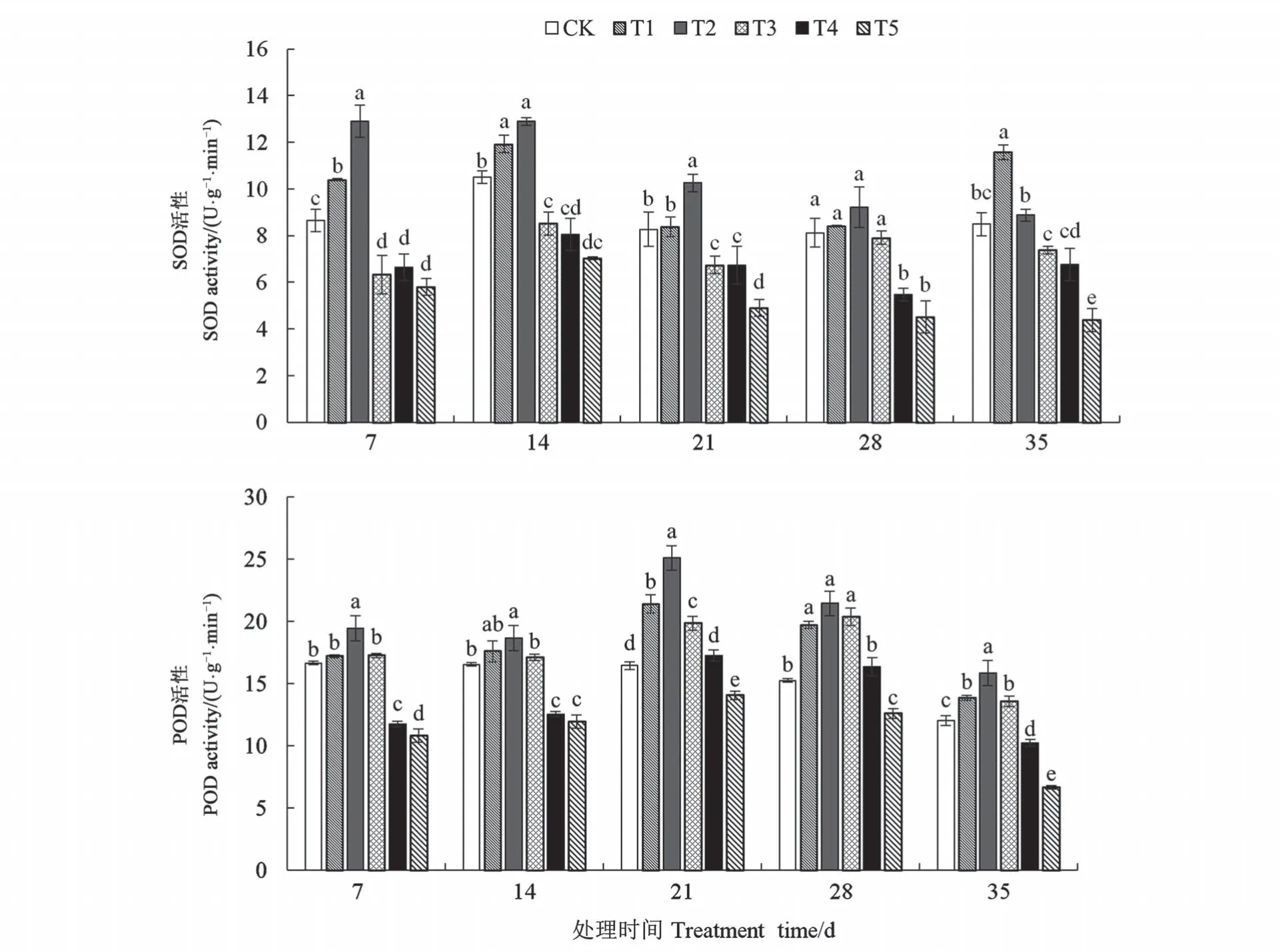
图3 混合盐胁迫下白榆幼苗SOD活性及POD活性的变化Fig.3 Changes of SOD and POD activities of Ulmus pumila seedlings under mixed salt stress
2.2.3 混合盐胁迫对白榆幼苗膜透性及叶绿素的影响 由图4 可知,在同一胁迫时间处理下,随着混合盐浓度的增加,白榆幼苗叶片的相对电导率整体上呈增加的趋势。T5 时,白榆幼苗相对电导率达到最大值,胁迫7、14、21、28、35 d 分别较CK显著增加了52.33%、82.88%、70.17%、91.70%及85.90%(P<0.05)。同一胁迫时间处理下,随着盐浓度的增加,白榆幼苗叶片的叶绿素含量均呈现下降的趋势,T5 处理叶绿素含量在不同胁迫时间下含量均最低,CK 均最高。胁迫 7、14、21、28、35 d 时,T5 处理叶绿素含量分别较CK 显著降低了39.88%、27.11%、58.88%、77.55%、83.96%(P<0.05)。结果表明,盐胁迫对白榆幼苗体内的膜透性及叶绿素损害较为严重,在盐胁迫下,白榆幼苗的相对电导率显著增加,叶绿素含量显著下降。
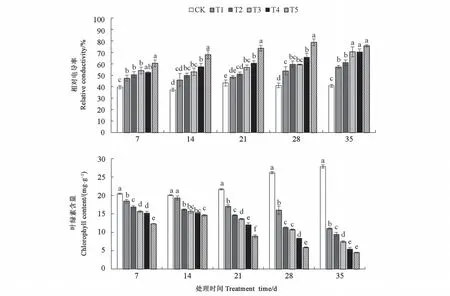
图4 混合盐胁迫下白榆幼苗相对电导率及叶绿素含量的变化Fig.4 Changes of relative conductivity and chlorophyll content of Ulmus pumila seedlings under mixed salt stress
3 讨论
盐碱地成分较为复杂,用单一成分盐对植物进行抗盐性研究存在一定程度的局限性,但目前混合盐胁迫对白榆幼苗生长及生理特性的研究鲜见报道。本研究结果表明,白榆幼苗在混合盐胁迫下,其生物量、株高增长量及地径增长量均受到明显抑制,这与前人对降香黄檀幼苗[21]、柽柳以及白刺[22]等研究结果一致。
根冠比可反映植物在逆境环境中生物量对地上部分与根系部分的分配,植物的不同器官对于盐分的敏感程度不同,进而造成植物生物量分配存在差异[19]。多数植物为能够在高盐浓度的环境下生存,会通过降低地上生物量的积累以维持植物体内的水分[23]。本研究结果表明,不同混合盐浓度处理下白榆幼苗的根冠比均大于对照,说明白榆幼苗应对盐胁迫的策略是通过增加幼苗根部生物量来实现的,原因为增加根系生物量有利于幼苗对水分的吸收,进而稀释细胞内的盐分,提高耐盐性。
膜系统是植物在盐胁迫条件下受植物盐害的主要部位,细胞膜受到损害时丙二醛含量会增加[24],电导率也会发生变化[25]。本研究结果表明,随着盐胁迫浓度的增加,丙二醛含量和相对电导率逐渐增加;同时,植物体内的过氧化物酶和超氧化物歧化酶活性会被激活,从而加大对细胞内自由基的清除作用,提高其自身清除活性氧的能力,减轻膜脂过氧化的程度。在不同胁迫时间处理时,过氧化物酶和超氧化物歧化酶酶活性最大值均出现在盐浓度为30 mmol·L-1时,说明在更高盐浓度胁迫下,盐伤害会导致植物体内产生大量的活性氧,细胞内过氧化物酶及超氧化物歧化酶等保护酶系统也会受到破坏,导致活性降低,膜系统的伤害指数随之增加[26]。
可溶性糖对维持植物体内的渗透压至关重要,其含量在逆境环境下会有所增加[27]。本研究结果表明,随着胁迫时间的延长,可溶性糖含量无显著变化,而较低混合盐胁迫浓度可增加溶性糖含量,原因为低盐胁迫环境下会使白榆幼苗体内渗透压升高,提高细胞的吸水能力;但当盐浓度增高到一定量时,细胞离子平衡系统遭到破坏,渗透势下降,可溶性糖含量会急剧降低[28]。如在盐胁迫处理35 d 时,白榆幼苗可溶性糖含量出现明显下降的趋势,说明植物自身对盐伤害的修复能力已达到极限。
叶绿素是植物进行光合作用的主要色素,叶绿素含量可直接反映植物光合能力。植物在盐胁迫条件下,往往会抑制叶绿素的合成,从而会一定程度影响其生长状况[29]。本研究结果表明,随着盐胁迫浓度的增加,白榆幼苗体内的叶绿素含量呈显著下降的趋势,这与闫晶秋子等[18]对蒙桑盐胁迫研究的结果一致。
林兴生等[30]对稗草进行研究,发现NaCl 浓度为100 mmol·L-1时,植株死亡率高达40%;黄山栾在盐浓度为75 mmol·L-1时部分种苗出现枯萎甚至死亡现象,NaCl 浓度为 100 mmol·L-1时,农桑14 号、农桑12 号以及农桑32 号出现整片叶泛黄,甚至部分植物死亡的情况[18];韩志平等[31]研究结果显示,黄花菜在混合盐胁迫15 d 时致死浓度为100 mmol·L-1;混合盐对植物的影响大于 NaCl 单盐[32-33]。本研究结果表明,盐胁迫35 d 时,混合盐浓度为100 mmol·L-1的白榆幼苗仍可发育,说明白榆幼苗具有较强的抗盐能力。
综上所述,白榆幼苗在盐胁迫条件下,生物量降低、生长发育受到明显的抑制,随着盐胁迫浓度的增加以及胁迫时间的延长,白榆幼苗通过激发自身体内的过氧化物酶和超氧化物歧化酶活性,降低丙二醛含量的积累,从而减少细胞膜损伤的程度;并通过增加可溶性糖含量,提高白榆幼苗的渗透调节能力,降低盐胁迫对白榆幼苗的伤害;在盐浓度为 100 mmol·L-1,白榆幼苗胁迫至 35 d 时,白榆幼苗出现叶片泛黄以及轻微叶片萎蔫,但仍可正常发育生长,说明白榆幼苗表现出较好的适应性和耐盐性,可用于盐碱地造林绿化。
