中间球海胆己糖激酶基因克隆及高温-酸化胁迫对其表达影响的初步研究
2022-09-27武博琼崔东遥焦仁和宋坚湛垚垚常亚青
武博琼, 崔东遥, 焦仁和, 宋坚, 湛垚垚, 常亚青
(大连海洋大学水产与生命学院,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
全球变暖(global warming)是指因温室效应而造成温度上升的气候变化现象[1]。就占地球表面积71%的海洋而言,海洋升温(ocean warming)和海洋酸化(ocean acidification)是全球变暖引发的主要不良现象[2-3]。据联合国政府间气候变化专门委员会(Intergovernmental Panel on Climate Change,IPCC)的预测模型推测,到2100年,海洋表面温度将升高1.8~4.0 ℃,而海水表层pH 将下降至7.8 左右。调查显示,自20 世纪90年代初以来,海洋变暖的速度增加了一倍,其中,2020年海水平均温度是现代海洋观测记录以来最高的一年[4]。此外,野外研究证实,目前全球海水酸化的实际速度远高于工业革命前2 500万年间海水pH的自然变化幅度[5-7]。海水是海洋生物赖以生存的重要介质。研究证实,海洋升温和酸化会对海洋生物的生长、繁殖、发育、代谢、群体规模甚至食物链产生复杂而深刻的影响[8],其中,对海洋生物能量代谢的影响逐渐成为近年来的关注热点。
己 糖 激 酶(hexokinase,HK)是 糖 酵 解(glycolysis)过程的第1个限速酶,是生物体能量收支的重要调控开关[9],研究证实,己糖激酶的活力常受到环境因素的干扰。汝玉涛[10]研究发现,长光照培育下的柞蚕(Antheraea pernyi)蛹脂肪体中的己糖激酶活力呈上升趋势,为蛹蜕皮过程提供更多的能量。朗德鹅(Anser anser)在填饲后期肝脏中HK基因的相对表达显著增加,可促进葡萄糖向脂肪酸转化,加快脂肪肝的形成[11]。在海洋生物研究领域,马氏珠母贝(Pinctada martensii)HK基因在低温胁迫条件下的相对表达呈先上升后下降的趋势,表明HK基因可能参与马氏珠母贝对低温胁迫的响应过程[12]。郭彪等[13]研究显示,凡纳滨对虾(Litopenaeus vannamei)在温度骤升时,肝胰腺中的HK 酶活力先升高后恢复至起始水平,表明凡纳滨对虾可能通过调控HK 酶活力以适应急性高温胁迫。但是,目前就棘皮动物HK基因对海洋环境变化响应规律及模式的研究尚未见报道。
为研究棘皮类动物中HK基因的序列信息和表达规律,初步了解环境变化对棘皮动物体内HK基因表达及酶活力的影响,本研究以寒温带海胆种类——中间球海胆(Strongylocentrotus intermedius)为研究对象,利用cDNA 末端快速扩增(rapidamplification of cDNA ends, RACE)技术获得中间球海胆HK基因的全长cDNA 序列(SiHK)并利用生物信息学软件分析其序列特征。肠和性腺组织担负着海胆食物消化、生殖和储能等重要功能[14],且性腺是有较高营养价值的可食用部位,研究表明,海胆性腺中多不饱和脂肪酸含量占总脂肪酸含量的54.1%[15]。因此,本研究重点研究高温-酸化胁迫下,中间球海胆性腺和肠组织中SiHK基因的相对表达量以及总SiHK酶活力的变化,为深入研究棘皮动物体内HK基因的生物学功能提供基础数据和参考资料。
1 材料与方法
1.1 试验材料
试验以中间球海胆为研究对象,购自大连旅顺龙王塘养殖场,随机选取240 只平均壳径(3.5±0.1)cm、平均体质量(20.2±2.5)g 且健康、活力较好的海胆,于农业农村部北方海水增养殖重点实验室暂养7 d 后开始试验。暂养期间在自然海水条件下进行养殖,投喂海带(Saccharina japonica),每隔2 d进行1次全量换水。
选择平均体质量(25.4±3.3)g 且健康、活力好的中间球海胆,于冰上取管足、围口膜、齿间肌、体腔液、肠和性腺6个组织,做好标记后,在液氮中迅速冷冻,冻存于-80 ℃,用于后续的基因克隆和组织表达分析。
1.2 试验设计
按照参考文献[16]的方法对海水进行酸化处理。根据 IPCC 对海洋 2100年 pH 的预测[17],试验以自然海水为对照(CK),设置3个试验组,试验组分别为高温海水组(HC,ΔT=+3.0 ℃)、酸化海水组(LO,Δ pHNBS=-0.5)和高温酸化海水组(HO,ΔT=+3.0 ℃,ΔpHNBS=-0.5)。每个试验组设置6 次平行组,每个平行组10只海胆。试验期间,利用pH计(PH838,SMART,中国香港)和水质仪(YSI6 920,YSI,美国)实时监测各试验组海水的pHNBS、盐度和温度。总碱度(total alkalinity,TA)依据pH 滴定法进行测定。运用SWCO2 软件(http://neon.otago.ac.nz/research/mfc/people/keith_hunter/software/software.htm/)根据测定的海水pH、盐度、温度和总碱度计算出各组二氧化碳分压(partial pressure of carbon dioxide,pCO2)。
试验持续60 d,期间各试验组海水参数如表1所示。试验期间,每天投喂海带1次,日换水量为总水量的1/2,每2 d进行1次全量换水,换水时及时清除残饵及粪便;为避免海水pH的剧烈波动,换水前后需对温度、pHNBS、盐度、总碱度和二氧化碳分压等海水参数进行检测,待稳定后再开始试验。
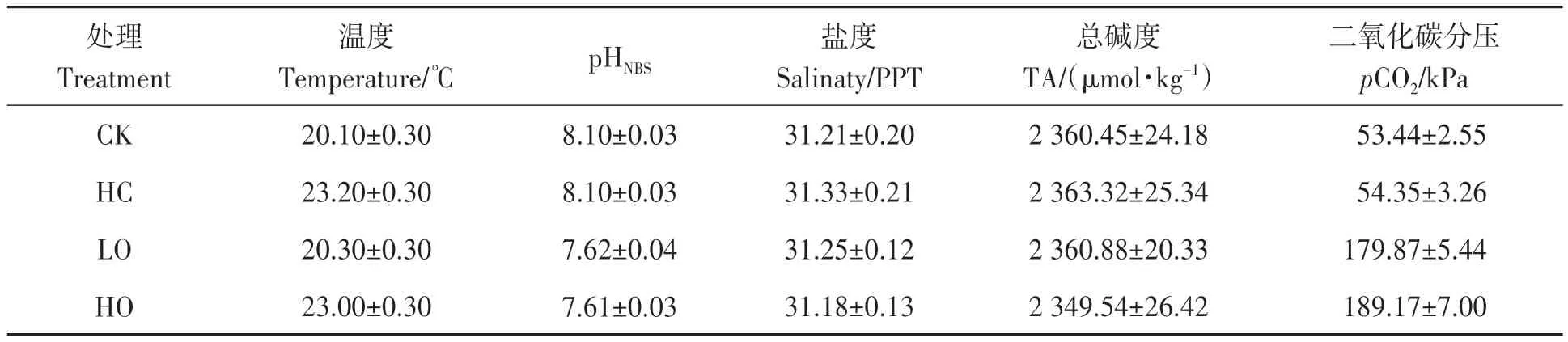
表1 各试验组的海水参数Table1 Seawater parameters of each treatment
1.3 中间球海胆SiHK基因克隆
按照RNA 提取试剂盒(普洛麦格公司)说明书提取中间球海胆各组织中的总RNA。5’RACE及 3’RACE 的反转录参照 Smarter RACE cDNA 试剂盒(Clontech,美国)说明书进行,获得cDNA 模板,-20 ℃冰箱保存备用。根据中间球海胆转录组文库获得SiHK基因的核心片段和引物设计原则,使用Primer Premier 5.0 软件设计引物(表2)。PCR 扩增体系(10 μL):含有1 μL cDNA,上下游引物各0.4 μL,Buffer 1 μL,LA-Taq酶0.2 μL,dNTP 0.8 μL,ddH2O 6.2 μL。PCR 反应条件:95 ℃预变性5 min;94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 1 min,35个循环;72 ℃延伸10 min。PCR 产物经琼脂糖凝胶电泳检测后,切取目的条带,使用柱式DNA 胶回收试剂盒(生工生物工程,上海)进行回收。将回收的PCR 产物与pEASY®-T1 克隆载体(全式金,北京)连接,转化到Trans1-T1 噬菌体抗性的感受态细胞(全式金,北京)中;向转化后的感受态细胞中加入含0.1%氨苄青霉素的LB 液体培养基,37 ℃摇菌培养1 h 后,涂平板,于37 ℃恒温箱中培养12 h,挑取单一菌落至LB 液体培养基中继续扩大培养;取1 μL 培养的菌液为模板,通过菌落PCR 筛选阳性克隆,送至生工生物工程上海有限公司进行测序。
1.4 中间球海胆SiHK序列的生物信息学分析
利用DNAMAN 6.0软件对获得的中间球海胆SiHK基因的3’和5’端序列与核心片段序列进行拼接组装,最终得到SiHK基因的全长cDNA 序列。利用 BLAST(BLASTX,http://blast.ncbi.nlm.nih.gov/Blast.cgi)对SiHK基因核苷酸及其所编码氨基酸序列进行相似性分析;使用ORF Finder(http://www.ncbi.nlm.nih.gov/orffinder)软件确定SiHK基因的开放阅读框(open reading frame,ORF);利用 EXPASY Proteomics Server(http://www.expasy.org)软件对SiHK基因编码的蛋白序列进行理化性质分析;利用SMART(http://smart.emblheidelberg.de/)和 PSIRED v3.3(http://bioinf.cs.ucl.ac.uk/psipred/)软件预测SiHK 蛋白质的结构域和二级结构;利用SWISSMODEL(https://swissmodel.expasy.org/)预测SiHK 蛋白质的三维结构;应用DNAMAN 6.0 软件对SiHK基因编码的氨基酸序列进行多序列比对;利用MEGA 7.0 软件,基于邻接法(neighbor-joining,NJ)构建15种生物HK氨基酸序列的系统进化树。
高校应加强对就业指导模式的改革与创新。高校的任务不仅是让学生获得知识,也应保障学生职业生涯的良好发展,这符合学生和学校共同的利益。构建学生高校命运共同体,能让学校切实重视学生就业能力的提升工作,将就业指导深化、细化。同时,应针对不同阶段的学生实施不同的就业指导内容和指导方式,帮助学生进行职业认知、职业选择与职业规划,为学生提供完善的就业服务。
1.5 qRT-PCR 检测中间球海胆SiHK 基因的相对表达规律
采用LightCycler96 实时荧光定量PCR 仪(Roche Life Science,德国)进行qRT-PCR,反应程序为三步法扩增反应,具体参照说明书进行。从实验室前期获得的中间球海胆转录组文库中筛选出目的基因的核心片段,利用Premier 5 设计引物(表2),选用在中间球海胆组织中稳定表达的β-actin作为内参基因,并对引物的特异性和扩增效率进行检测。反应体系(20 μL):2 μL cDNA,上下游引物各 0.8 μL,2×SYBR®PremixEx TaqTMⅡ 10 μL,ddH2O 6.4 μL。荧光定量 PCR 反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;反应后进行熔解曲线分析,以排除非特异性扩增的污染。采用 2-ΔΔCT法[19]计算SiHK基因的相对表达量。
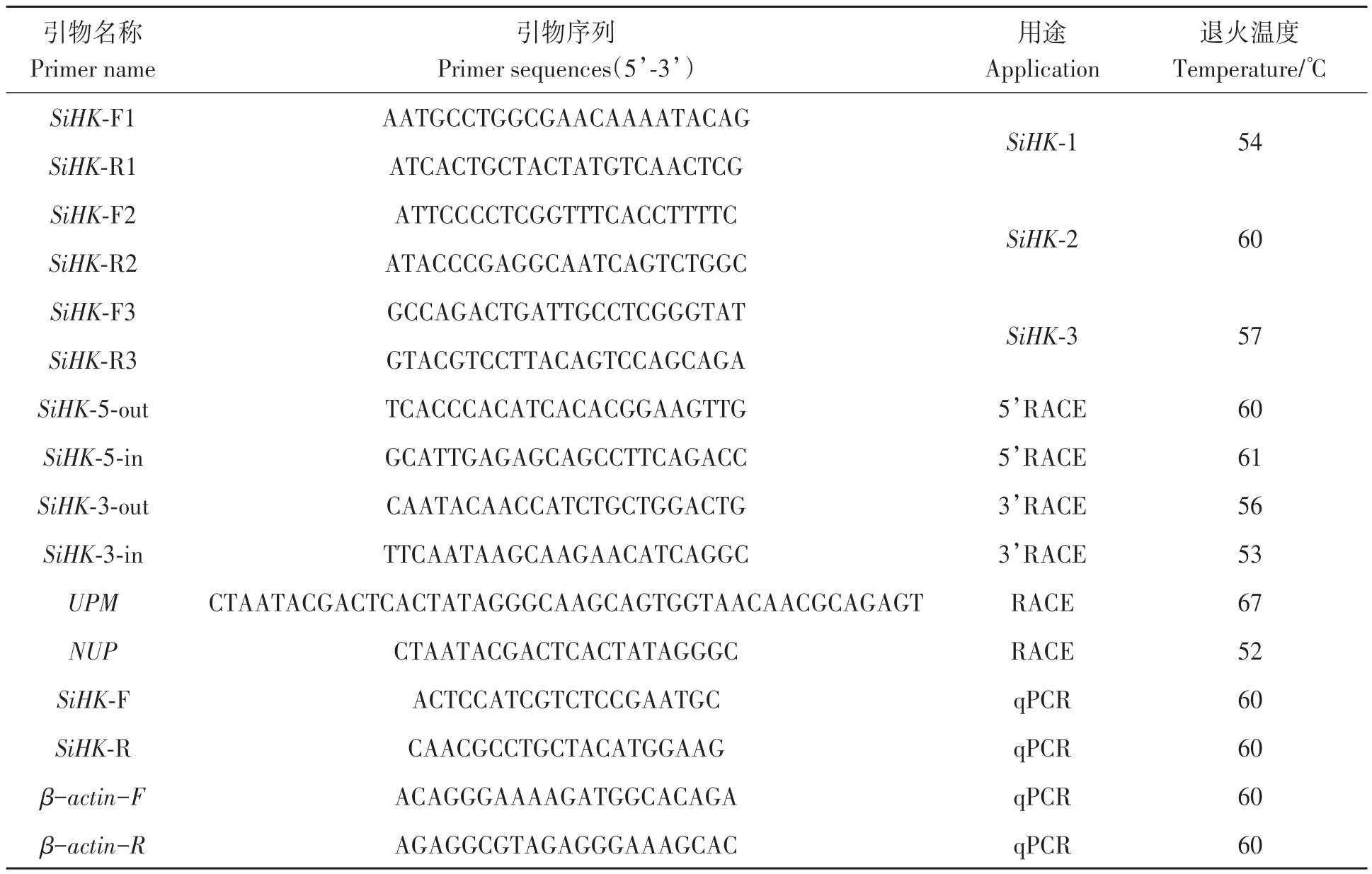
表2 本研究中使用的引物Table 2 Primers used in this study
1.6 中间球海胆组织总SiHK酶活力测定
分别取中间球海胆性腺和肠组织样品各1.0 g,液氮研磨后,按1∶9(质量体积比)加入无菌海水,4 ℃、2 500 r·min-1离心10 min后留取上清液。
总蛋白含量的测定按照总蛋白(total protein,TP)测定试剂盒说明书(南京建成生物工程研究所,南京)进行,将样品和所加试剂混匀,静置10 min,于 595 nm 处,1 cm 光径,双蒸水调零,测定各管吸光值(OD 值)。计算公式如下,标准品质量浓度为 0.563 g prot·L-1。

总SiHK 酶活力的测定按照已糖激酶试剂盒说明书(南京建成生物工程研究所,南京)进行,利用Epoch 酶标仪(Biotek,美国)测定反应底物吸光值,根据说明书中公式,记录在340 nm波长下20 s时的初始吸光度A1 和320 s 时的吸光度A2,计算公式如下。
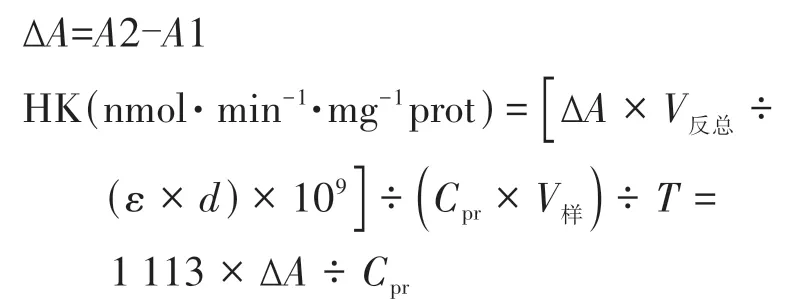
式中,ε 为 NADH 在 340 nm 处摩尔吸光系数(6.22×103L·mol-1·cm-1);d为比色皿光径(cm);V反总为反应体系总体积(L);Cpr为上清液蛋白质质量浓度(mg·mL-1);V样为加入反应体系中上清液体积(mL);T为催化反应时间(min)。
1.7 数据分析处理
采用Excel 2016 和Origin 8.0 进行数据整理和图表绘制,采用SPSS 22.0 统计软件对数据进行统计学分析。
2 结果与分析
2.1 中间球海胆SiHK基因的全长cDNA序列
如图1 所示,中间球海胆SiHK基因的cDNA序列全长2 041 bp,编码476个氨基酸,起始密码子(ATG)位于序列的第103 碱基处,终止密码子(TGA)位于序列的第1 533 碱基处。生物信息学分析结果显示,SiHK基因编码蛋白(SiHK)的理论等电点(pI)为6.44,蛋白分子质量52.72 kD。二级结构预测显示(图2),SiHK 的氨基酸序列中含有 COG5026 结构域,共包含 17个 α-螺旋、13个β-折叠和31个无规则卷曲,相对于仿刺参HK 的二级结构,中间球海胆和紫球海胆(Strongylocentrotus purpuratus)的 HK 在二级结构上更为相似,2 种海胆蛋白序列中存在43个氨基酸残基的差异,中间球海胆SiHK 蛋白序列较紫球海胆HK 蛋白序列多1个无规则卷曲、少1个α-折叠。三维结构预测显示(图3),SiHK 与人(Homo spains)HK 蛋白(PDB 登录号:1cza.1)的相似性为43.34%,具有较为相似的三维结构,存在2个磷酸基团识别位点及其与周围蛋白构成的酶活性中心,磷酸基团识别位点与蛋白质通过盐桥相连接。

图1 中间球海胆SiHK的核苷酸序列及其所编码的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of SiHK in Strongylocentrotus intermedius
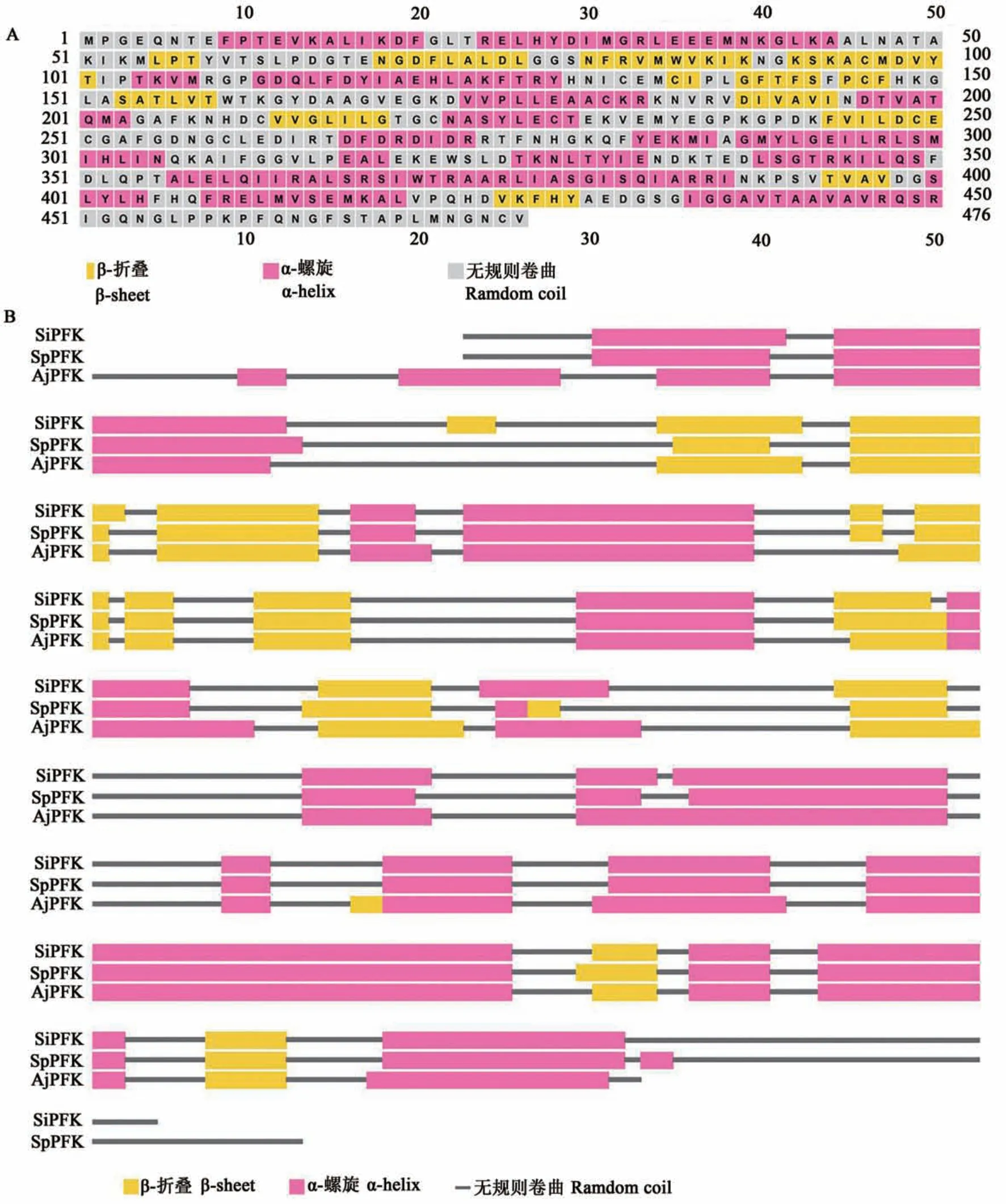
图2 中间球海胆SiHK二级结构预测及其与紫球海胆、仿刺参HK的二级结构比较Fig.2 Secondary structure prediction and comparison of hexokinase between
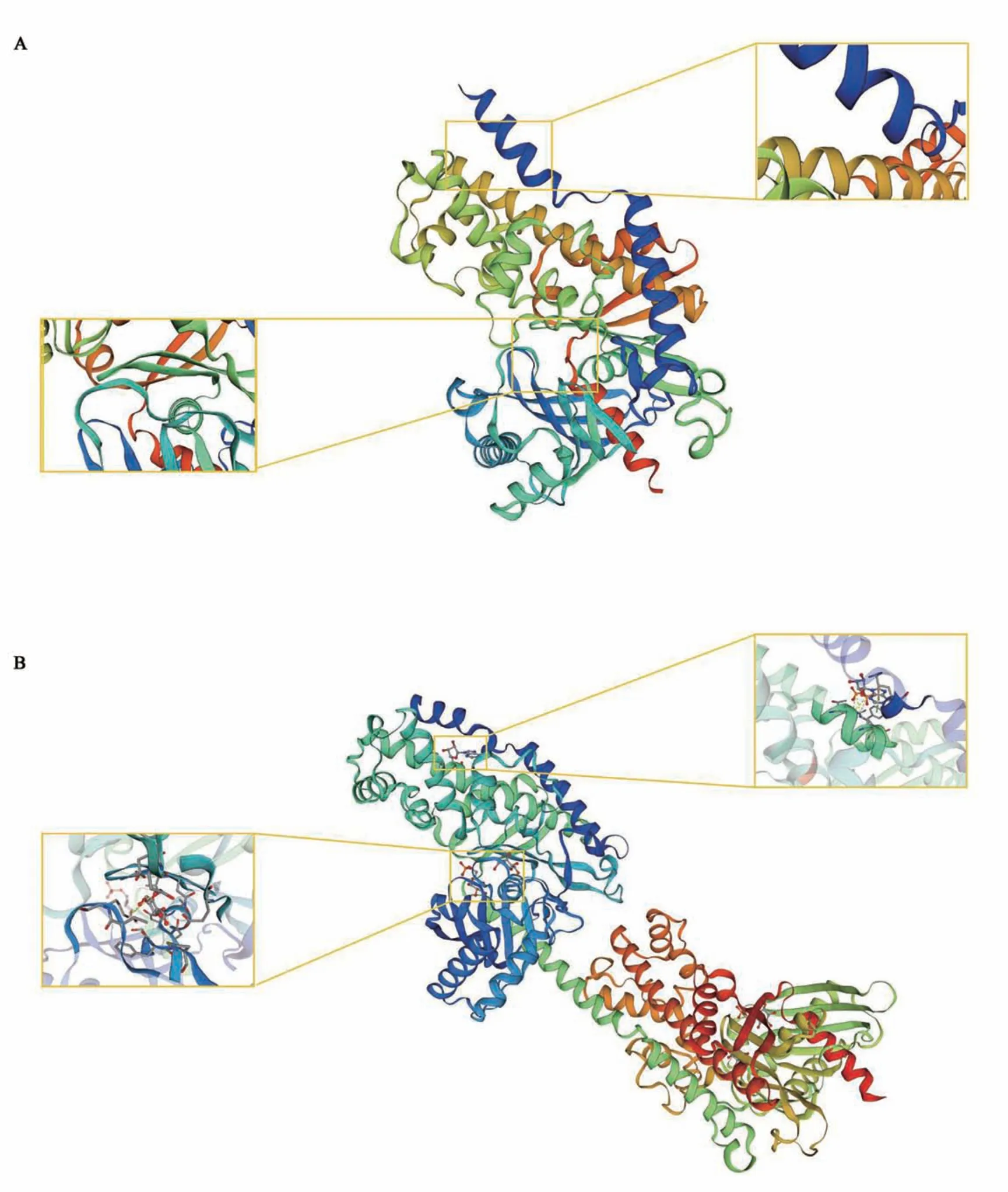
图3 中间球海胆SiHK蛋白质的三级结构Fig.3 3D structure prediction of SiHK
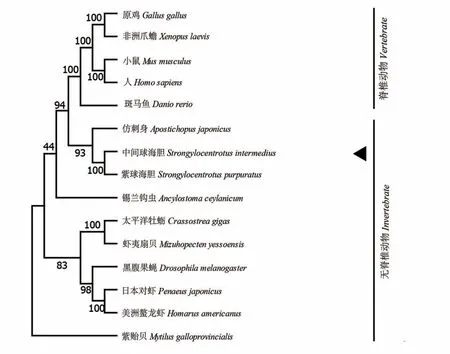
图4 中间球海胆SiHK氨基酸序列系统进化分析Fig.4 Phylogenetic analysis of deduced amino acid sequences of SiHK
2.2 中间球海胆SiHK基因的组织表达及酶活力
2.2.1SiHK基因表达和酶活力 如图5 所示,SiHK基因在6 种中间球海胆组织中均有表达,且具有较为明显的组织特异性,其相对表达量由高到低依次为:性腺>肠>齿间肌>围口膜>管足>体腔液,其中,SiHK基因在中间球海胆性腺组织中的相对表达量最高,在肠组织中的相对表达量次之,而在体腔液中的相对表达量最低。
酶活力检测结果(图5)显示,6 种中间球海胆组织中的总SiHK 酶活力差异较大,其中,在体腔液中总SiHK 酶活力最高,显著高于其他组织;管足次之;肠和性腺中总SiHK酶活力最低。

图5 中间球海胆不同组织SiHK基因表达量和总SiHK酶活力Fig.5 Relative expression of SiHK and total SiHK activities in different tissues of Strongylocentrotus intermedius
2.2.2 高温-酸化对中间球海胆肠组织和性腺组织中SiHK基因表达和酶活力的影响 经过60 d高温-酸化胁迫后,中间球海胆性腺与肠组织中SiHK基因在不同处理下的相对表达量和SiHK 酶活力变化如表3和图6所示。
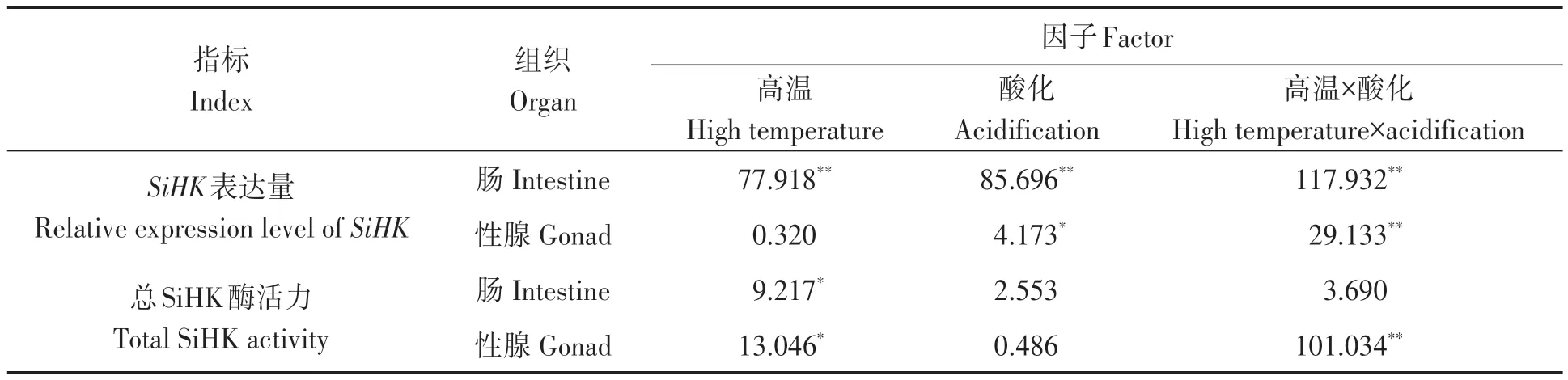
表3 高温和酸化对SiHK基因表达和总SiHK酶活力影响的双因素方差分析Table 3 Two-way ANOVA of effects of high temperature-acidification stress on relative expression and total enzyme activities of SiHK
在肠组织中,海水升温条件下,SiHK基因的相对表达量和总SiHK酶活力较对照显著上升;在海水酸化条件下,SiHK基因的相对表达量较对照显著升高,总SiHK 酶活力于对照差异不显著;在受到高温和海水酸化双因素胁迫后,中间球海胆肠组织中SiHK基因的相对表达量较对照极显著上升,总SiHK酶活力与对照组无显著差异。
在性腺组织中,在海水升温的条件下,SiHK基因的相对表达量与对照差异不显著,总SiHK酶活力较对照显著下降,其中,总SiHK 酶活力呈现显著下降趋势;在海水酸化条件下,与自然海水组相比,中间球海胆性腺组织中SiHK基因的相对表达量和总SiHK酶活力与对照差异不显著;当受到高温和酸化双因素胁迫后,中间球海胆性腺组织中SiHK基因的相对表达量和总SiHK 酶活力与对照组相比呈现极显著下降趋势。
3 讨论
3.1 中间球海胆SiHK基因的序列特征
本研究利用RACE 技术获得了中间球海胆SiHK基因的全长cDNA 序列,对序列进行生物信息学分析发现,该序列的核苷酸序列与紫球海胆SiHK的核苷酸序列相似度较高,达到91.13%,可能是在物种进化过程中,其编码序列在种属特异性进化中发生了不同的碱基替换等,与前人研究结果一致[19-20]。蛋白质二级结构显示,相对于仿刺参HK 的二级结构,中间球海胆和紫球海胆的HK在二级结构上更为相似,由此表明,棘皮动物中的HK 在蛋白结构上存在一定的种属特异性。对蛋白质的三维结构进行预测,结果表明,中间球海胆的SiHK 与人HK 在三维结构上的相似度为43.34%,由此表明,HK 在漫长的进化过程具有较强的保守性。此外,系统进化分析显示,中间球海胆SiHK 与紫球海胆的HK 具有较近的亲缘关系,与仿刺参HK 也具有较高的同源性,表明虽然棘皮动物HK 在蛋白质空间结构上存在一定的种属特异性,但整体而言又具有一定的保守性。
3.2 高温-酸化胁迫下中间球海胆肠和性腺组织SiHK基因和SiHK酶的响应模式
不同种类棘皮动物对海水酸化的响应存在种属差异。研究表明,长期生活于酸化海水(pH 7.03)中的马粪海胆(Hemicentrotus pulcherrimus)生长速度缓慢,发育迟缓,其壳径、肠重、口器重及体质量均受到显著影响[21];Stumpp等[22]发现在酸化海水(pH 7.70±0.02)中培育的紫球海胆,虽然其早期发育阶段的代谢率增强,但是其个体发育却比较缓慢;仿刺参可通过改变能量代谢、降低钙化率以适应海水酸化胁迫[23];海蛇尾(Amphiura filiformis)通过提高肌肉分解速度以适应海水酸化胁迫[24]。
糖酵解是生物体各组织细胞中普遍存在的代谢反应过程[25],己糖激酶(HK)是糖酵解过程中的第1个限速酶。本研究对中间球海胆SiHK基因的表达量及总SiHK 酶活力进行分析,结果表明,SiHK基因表达量及总SiHK 酶活力在中间球海胆管足、围口膜、齿间肌、体腔液、肠和性腺组织中均有表达,但存在明显的组织特异性,与己糖激酶在大鼠不同组织的表达具有相似性[26]。值得注意的是,在同一组织中,SiHK基因的相对表达量与总SiHK 酶活力呈相反趋势,如SiHK基因在肠和性腺组织中的相对高表达量较高,而总SiHK酶活力较低,可能是由于在肠和性腺组织中SiHK主要以尚未激活的酶原形式存在。体腔液是海胆的防御中枢和体液循环中枢,肩负抵御病原微生物、环境刺激及维持渗透压平衡等重任,对于能量的需求较大,而己糖激酶催化的糖酵解活动是机体内糖类产能的共同途径,因此,体腔液中较高的SiHK酶活力在一定程度上反映了中间球海胆体腔液中糖类分解代谢活动活跃。
海水升温和海洋酸化会影响和改变海洋生物的能量代谢水平和分配方式[20,27]。本研究发现,高温-酸化胁迫60 d后,在中间球海胆的肠和性腺组织中,SiHK基因的相对表达量和总SiHK 酶活力也较对照组发生了变化,且这种改变具有一定的组织特异性。
当海水温度上升3 ℃时,中间球海胆肠组织中SiHK基因的相对表达量和总SiHK 酶活力显著升高。研究显示,当外界温度在一定的温度范围内升高时,机体内的酶活力会随着温度的升高而增强,进而提高机体的代谢水平以应对不良环境[28]。中间球海胆的适宜生长温度为18~22 ℃,水温超过23 ℃可造成中间球海胆大量死亡[29]。由此推测,当海水升温时,中间球海胆可能通过上调肠组织中SiHK基因的表达量来提高己糖激酶活力,从而提高糖酵解的效率,转化吸收更多的能量来维持机体内稳态,与沙葱萤叶甲(Galeruca daurica)成虫HK基因上调表达响应高温胁迫一致[30]。当海水pH 较自然海水降低0.5 时,中间球海胆肠组织中SiHK基因的相对表达量和总SiHK酶活力也呈显著上升趋势,推测中间球海胆可能通过加快肠组织中糖代谢来获得大量能量以适应海水酸化胁迫。研究表明,海水酸化胁迫可引起中间球海胆丙酮酸激酶(pyruvate kinase,PK)活力显著提高。己糖激酶和丙酮酸激酶均为糖酵解代谢的关键酶,由此表明,海水酸化对海胆的糖代谢和产能过程产生一定的影响。当受到高温和酸化双因素胁迫后,中间球海胆肠组织中SiHK基因的相对表达量极显著高于对照组。与温度相比,海水pH 可能是影响中间球海胆肠组织中糖代谢关键酶表达的主要因素,且海水升温可在一定程度上缓解海水酸化对海胆代谢酶造成的影响。童欢等[31]的研究显示,在酸化条件下,40 ℃水体中微生物的活力高于35 ℃,表明温度的升高有利于减缓酸化对微生物的影响,与本研究结果相一致。在高温-酸化胁迫下,中间球海胆肠组织中总SiHK酶活力较对照组差异不显著,表明高温和酸化对中间球海胆肠组织中总SiHK 酶活力具有协同抑制作用,与常亚青等[29]和Zhan 等[32]的研究结果相似。综上所述,高温-酸化胁迫会抑制中间球海胆的糖代谢活动。
当海水温度升高3 ℃时,中间球海胆性腺组织中SiHK基因的相对表达量较对照组略有下降,但差异不显著,而总SiHK 酶活力显著降低,说明高温对中间球海胆性腺中糖酵解途径的影响可能不是依靠下调SiHK基因的相对表达量,而是通过降低总SiHK酶活力。值得注意的是,这一结果与肠组织中SiHK基因的表达量和总SiHK 酶活力的检测结果不同,由此表明,即使在同一种生物体内,不同器官对外界胁迫的响应策略也会有所不同。当海水pH 较自然海水降低0.5 时,中间球海胆性腺组织中SiHK基因的相对表达量显著降低,但总SiHK 酶活力较对照组差异不显著。且高温和酸化双因素胁迫下,中间球海胆性腺组织中SiHK基因的相对表达量和总SiHK 酶活力变化趋势与单因素胁迫时略有不同,由此表明,即使是同种生物的同一器官,对不同胁迫因素的响应策略也不尽相同。当受到高温-酸化胁迫后,中间球海胆性腺组织中SiHK基因的相对表达量较对照极显著降低,且SiHK酶活力较对照组也极显著降低,表明升温和酸化对中间球海胆性腺组织中SiHK基因的相对表达量和总SiHK 酶活力具有协同抑制作用,显著降低了中间球海胆性腺中糖酵解代谢的速率。研究显示,海水高温和海水酸化可引起马粪海胆和梅氏长海胆(Echinometra mathaei)性腺发育缓慢[20,33],本研究证实高温-酸化双重胁迫显著抑制了中间球海胆性腺中糖酵解代谢中第1个限速酶的相对表达和酶活力。综上所述,未来在高温-酸化双重压力下,寒温带海胆的发育可能更为迟缓,生存和繁殖可能会面临更大的挑战。
