铁皮石斛多糖水解工艺优化及甘露糖含量的测定
2022-09-27谭善财谭长金邬小兰刘鸿燕
谭善财,谭长金,邬小兰,杨 洋,刘鸿燕
(1.铜仁职业技术学院,贵州铜仁 554300;2.中兽药国家民委重点开放实验室,贵州铜仁 554300;3.新疆医科大学,新疆乌鲁木齐 830000)
铁皮石斛()质量评价的指标为多糖、甘露糖,多糖含量不低于25%,甘露糖为13%~38%,高效液相色谱法测定甘露糖与葡糖糖的峰面积比值应为2.4~8.0。2020 年1 月,国家卫生健康委、国家市场监管总局联合发布贵州、四川、云南等7 个省开展铁皮石斛按照传统食品又是中药材的生产经营试点。研究表明铁皮石斛多糖(polysaccharide,DOP)主要是甘露糖、葡萄糖通过糖苷键形成的葡甘露聚糖,具有保护胃黏膜、调节血糖、保肝、增强免疫力、降血脂等多种活性。甘露糖(Mannose,Man)是铁皮石斛多糖组成的主要单糖,作为一种天然活性单糖,对肿瘤、糖尿病、肥胖病、膀胱炎与尿道炎等疾病有较好的辅助疗效,可见,甘露糖在医药领域治疗各类疾病将会发挥重要的作用。甘露糖在食品、日化等行业也具有广泛的应用前景。
植物多糖糖苷键在酸性溶液中易断裂,形成不同聚合度的水解物,因此酸法催化水解是降解植物多糖较为常用的方法。硫酸、三氟乙酸及盐酸催化辅助沸水浴加热或直接利用加热设备高温加热水解铁皮石斛多糖,耗时长,酸的浓度大,加热设备易损坏、成本高。三氟乙酸、盐酸有毒、极易挥发,并刺激呼吸系统,操作时难以控制浓度,不适合规模化地水解多糖制备甘露糖。笔者以稀硫酸为催化剂,在高压灭菌器中利用水蒸汽辅助一定的温度和压力,优化铁皮石斛多糖水解工艺,提高多糖水解的效率和速率,为从植物多糖中大量制备甘露糖提供参考。
柱前衍生化—高效液相色谱法测定糖类物质是利用衍生化试剂使其带上发色基团,结合高效液相色谱法进行紫外或荧光检测实现对糖类化合物定性定量分析。吡唑啉酮类化合物是糖类物质衍生化反应效果较好的衍生剂,常用的有1-苯基-3-甲基-5 吡唑啉酮(PMP)、1-(2-萘基)-3-甲基-5 吡唑啉酮(NMP)、1-五氘代苯基-3-甲基-5 吡唑啉酮(d5-PMP)、1-(4-异丙苯基)-3-甲基-5 吡唑啉酮(PPMP)等,其中PMP 与醛酮糖类化合物衍生反应活性最高。利用PMP 柱前衍生化-高效液相色谱法是分析铁皮石斛中糖类物质较为常用的方法,具有灵敏、快速、准确等优点,较气相色谱(GC)、气质联用(GCMS)和液质联用(HPLC-MS)方法简单易行,操作方便。
目前针对不同栽培方式的铁皮石斛茎、叶、花中甘露糖的含量分析报道较少。因此笔者利用柱前衍生化-高效液相色谱法测定不同栽培方式的铁皮石斛不同部位甘露糖含量,为非药用部位叶及花的开发利用提供科学依据,同时为铁皮石斛养生茶、石斛酒、食品保健品及添加剂等产品中甘露糖的测定提供切实可行的方法。
1 材料与方法
1.1 材料与仪器
铁皮石斛茎、叶、花 由贵州德江县山顶中药材有限公司赠予,采于2021 年6 月,2.5 年生,铜仁职业技术学院梁玉勇教授鉴定兰科植物石斛属铁皮石斛。大棚栽培以松树皮等为基质添加有机肥种植于苗床上;附树种植以无纺布缠绕松树主干上,并附有青苔保湿;附石种植以无纺布围捆在灰色岩石上,并附有青苔保湿。D-甘露糖对照品、盐酸氨基葡萄糖、D-葡萄糖对照品 纯度≥98%,上海源叶生物科技有限公司;乙腈 色谱纯,Tedia Company;1-苯基-3 甲基-5-吡唑啉酮(PMP)上海凛恩科技发展有限公司;氢氧化钠、苯酚、三氯甲烷、硫酸、甲醇、磷酸二氢钾、盐酸、乙醇 化学纯,贵州铜仁市科仪化玻站;超纯水 自制。
Agilent1260 高效液相色谱仪、Eclipse Plus C(4.6 mm×150 mm,5 μm)色谱柱 美国安捷伦公司;LDZF-75L-I 立体式高压蒸汽灭菌器 上海申安医疗器械厂;T-10 紫外可见分光光度计 北京普析通用仪器有限公司;CPA225D 电子天平 赛多利斯斯泰迪有限公司;TDZ5-WS 低速离心机 东旺化玻仪器有限公司;EXPERT 15K-R 高速冷冻离心机长沙市鑫奥仪器仪表有限公司;DELTA 320 pH 计梅特勒-托利多仪器有限公司;FZG-1 真空干燥箱南京华莎干燥设备有限公司;New Human PowerⅠ超纯水仪 Human Corporation。
1.2 实验方法
1.2.1 铁皮石斛多糖(DOP)样品的制备与多糖含量测定 铁皮石斛茎、叶、花在60 ℃下真空干燥,粉粹,过40 目药筛,分别精密称取粉末0.4 g,按料液比1:20(g/mL)加入石油醚(沸程60~90 ℃),在50 ℃下热回流提取1 h 脱脂脱色。滤渣加超纯水200 mL,70 ℃下回流提取2 h,提取液离心(4000 r/min)20 min,Sevage 法除上清液中蛋白后,定容至250 mL 容量瓶中,得到多糖样品溶液,冷藏备用。
精密量取2 mL 多糖样品溶液于15 mL 的EP管中,按体积1:5 加入无水乙醇,振荡摇匀,置于4 ℃下冷藏2 h 后,以转速8000 r/min 低温离心15 min,用无水乙醇清洗沉淀,加50 ℃热水溶解沉淀,冷却后定容至25 mL。参照苯酚-硫酸法测定不同栽培方式的铁皮石斛茎、叶、花多糖含量。
分别精密量取95 μg/mL 葡萄糖对照品溶液0.2、0.4、0.6、0.8、1.0 mL 于10 mL 具塞试管,加水补足1 mL,精密加入5%苯酚溶液1 mL(现配现用),摇匀,再精密加入硫酸5 mL,摇匀,置沸水中20 min,取出,冷却至室温,利用紫外分光光度计在488 nm 的波长处测量各对照品溶液的吸光值,以照品溶液浓度为横坐标,吸光值为纵坐标,建立线性方程。分别精密量取铁皮石斛茎、叶、花多糖样品溶液1 mL 于10 mL 具塞试管,按上述标曲测定方法测定样品溶液吸光值,并计算多糖含量。
1.2.2 校准品及对照品溶液的配制 精确配制0.505 mg/mL 盐酸氨基葡萄糖内标溶液100 mL,1.20 mg/mL 葡萄糖对照品和1.12 mg/mL 甘露糖对照品溶液各10 mL。分别将2 mL 的内标溶液、1 mL 的甘露糖和1 mL 葡萄糖对照品溶液加入到10 mL 的容量瓶,加水定容,得内标-对照品混合溶液,冷藏备用。
1.2.3 铁皮石斛多糖样品溶液的水解 精密量取4 mL 铁皮石斛多糖样品溶液,按体积1:5 加入无水乙醇,置于4 ℃下冷藏2 h 后,低温离心(8000 r/min)20 min,用无水乙醇清洗沉淀3 次,60 ℃下真空干燥挥去乙醇,称重。将挥干乙醇的多糖样品加入3 mol/L的盐酸3 mL,安瓿瓶封口,混匀,置于高压蒸汽灭菌器中,在110 ℃下(对应压强为0.15 MPa)水解60 min,水解液放冷,加入氢氧化钠溶液调节pH 至中性,加入2 mL 内标液,定容至25 mL。冷藏,用于单糖组成分析。
将2.4 mg 的铁皮石斛多糖样品溶于一定浓度的酸溶液中,安瓿瓶封口,混匀,置于高压蒸汽灭菌器,在一定温度压力下水解,水解液放冷,加入氢氧化钠溶液调节pH 至中性,加入2 mL 内标液,定容至10 mL。优化铁皮石斛多糖水解工艺。
1.2.4 内标-对照品混合溶液及铁皮石斛多糖样品水解液的衍生化 参考文献[1]方法。分别将等体积(400 μL)的内标-对照品混合溶液和铁皮石斛多糖样品水解液中各加入400 μL 0.5 mol/L 的PMP 甲醇溶液和400 μL 0.3 mol/L 的氢氧化钠溶液于4 mL的EP 管中混匀,在69~71 ℃的温度下水浴中加热100 min,冷却后,加入500 μL 的0.3 mol/L 的盐酸溶液,以2 mL 三氯甲烷充分萃取除去衍生剂PMP,冷藏备用。
1.2.5 铁皮石斛多糖样品中单糖组成分析 色谱柱为安捷伦Eclipse Plus C(4.6 mm×150 mm,5 μm),高效液相色谱分析的条件:以0.02 mol/L 磷酸二氢钾溶液(A)-乙腈(B)为流动相,按10%~15%B(0~3.0 min)、15%~25% B(3.0~8.0 min)、25%~35% B(8.0~12.0 min)、35%~10% B(12.0~15.0 min)方法梯度洗脱,流速1.0 mL/min,进样体积10 μL,检测波长250 nm。柱温和进样器的温度维持35 ℃。
对比校准品盐酸氨基葡萄糖和对照品甘露糖及葡萄糖色谱峰保留时间,分析多糖样品水解液中单糖组成,计算不同栽培方式的铁皮石斛不同部位的甘露糖及葡萄糖的峰面积比。
1.2.6 铁皮石斛多糖水解工艺的单因素实验
1.2.6.1 酸的种类及浓度 水解样品质量2.4 mg,按料液比1:1.5 加入相同摩尔浓度盐酸或硫酸溶液,以甘露糖含量为指标,在温度110 ℃(对应压强为0.15 MPa)下,盐酸和硫酸各自浓度为0.5、1.0、1.5、2.0、2.5 mol/L,水解40 min,考察酸种类以及浓度对铁皮石斛多糖水解程度的影响。
1.2.6.2 料液比 水解样品质量2.4 mg,在温度110 ℃(压强为0.15 MPa)下,加入1.0 mol/L 的硫酸溶液,料液比分别为1:0.5、1:1.0、1:1.5、1:2.0、1:2.5,水解40 min,并以甘露糖含量为指标,考察料液比对铁皮石斛多糖水解程度的影响。
1.2.6.3 水解温度 水解样品质量2.4 mg,按1:1.5比例加入1.0 mol/L 的硫酸溶液,置于立体式高压蒸汽灭菌器中,在温度90、100、110、120、130 ℃(对应压强分别为常压、常压、0.15、0.20、0.25 MPa)下,水解40 min,并以甘露糖含量为指标,考察水解温度对铁皮石斛多糖水解程度的影响。
1.2.6.4 水解时间 水解样品质量2.4 mg,按1:1.5比例加入1.0 mol/L 的硫酸溶液,在温度110 ℃(压强为0.15 MPa)下,水解20、40、60、80、100 min,并以甘露糖含量为指标,考察水解时间对铁皮石斛多糖水解程度的影响。
1.2.7 响应面优化试验 根据单因素实验结果,选择1.0 mol/L 硫酸作为催化剂,固定料液比1:1.5,采用两因素五水平的中心组合设计方法(Central Composite Design,CCD),以水解温度(A)和时间(B)两个因素为待优化因素,如表1。以甘露糖含量为指标,利用Design-Expent 8.0 软件进行数据分析,得出铁皮石斛多糖最优水解工艺,并对其验证。

表1 响应面试验的因素和水平Table 1 Factors and levels of response surface test
1.2.8 甘露糖(Man)含量测定方法
1.2.8.1 校准因子的测定 按“1.2.5”的色谱条件,利用高效液相色谱仪测定内标液和对照品峰面积,按以下公式计算校正因子:

其中A:内标物峰面积;A:甘露糖峰面积;m:内标物质量;m:甘露糖质量。
1.2.8.2 甘露糖含量的计算 根据内标物峰面积和质量以及样品中甘露糖的峰面积,甘露糖的含量按下面公式计算:

其中A:内标物峰面积;A:样品中甘露糖峰面积;m:内标物质量;M:样品质量。
1.3 数据处理
采用Design-Expert 8.0 软件对影响甘露糖含量的水解温度和水解时间进行多元回归拟合,利用软件SPSS(SPSS,IBM,version 23)对不同栽培方式、不同部位铁皮石斛多糖、甘露糖含量进行组间差异性分析,<0.05 为显著差异。
2 结果与分析
2.1 3 种栽培方式的铁皮石斛茎、叶、花多糖的含量比较
铁皮石斛茎、叶、花多糖的含量按方程Y=0.0558X+0.1397(=0.9995)计算,线性范围:2.71~13.57 μg/mL。如表2 所示,同一种栽培方式的铁皮石斛茎、叶、花多糖的含量差异极显著(<0.01,茎>叶>花),含量分别在29.32%~33.78%、15.91%~17.31%和8.37%~8.68%之间,茎达到《中国药典》对多糖含量不低于25%的要求。从多糖的含量来总体评价铁皮石斛,大棚栽培方式质量优于附石、附树栽培,附石优于附树栽培。大棚采用苗床栽培,以松树皮和锯木屑为主要基质,表面覆有青苔;附石栽培,石斛生长在青苔之中;附树栽培仅用无纺布捆绑在松树上。这种因栽培方式的不同使多糖含量表现显著的差异,可能与栽培基质的保湿、保存养料有关。大棚、附树和附石三种栽培方式的叶、茎多糖含量较为丰富,叶多糖含量分别为17.31%±0.73%、16.57%±0.84%和15.91%±0.38%,茎分别为8.37%±0.65%、8.67%±0.72%和8.68%±0.57%。可见,不同栽培方式的铁皮石斛茎含有较高的多糖,同时利用保湿、保存养料的基质仿野生栽培铁皮石斛可以提高茎叶多糖的含量。

表2 3 种栽培方式的铁皮石斛茎、叶、花多糖含量比较分析Table 2 The contents compare of polysaccharide in stems,leaves and flowers from D.officinale under three different cultivation methods
2.2 3 种栽培方式的铁皮石斛茎、叶、花单糖组成分析
在“1.2.5”色谱条件下,盐酸氨基葡萄糖、甘露糖和葡萄糖能实现较好的分离,保留时间分别为10.68、11.01 和13.04 min,对比色谱峰保留时间(图1),可知铁皮石斛多糖主要由甘露糖和葡萄糖组成,这与黄俊彬等报道的云南、丹霞、浙江三个不同种源的铁皮石斛多糖中单糖组成主要为甘露糖和葡萄糖是一致的;大棚、附树及附石三种栽培方式中,铁皮石斛的茎、叶、花中甘露糖和葡萄糖色谱峰面积比值分别为5.72、5.24、4.25;5.53、5.13、4.37;5.65、5.34、4.62,都符合中国药典规定的2.4~8.0 的要求。可见,铁皮石斛茎多糖中也含有较多的甘露糖,是甘露糖提取的天然优质资源。
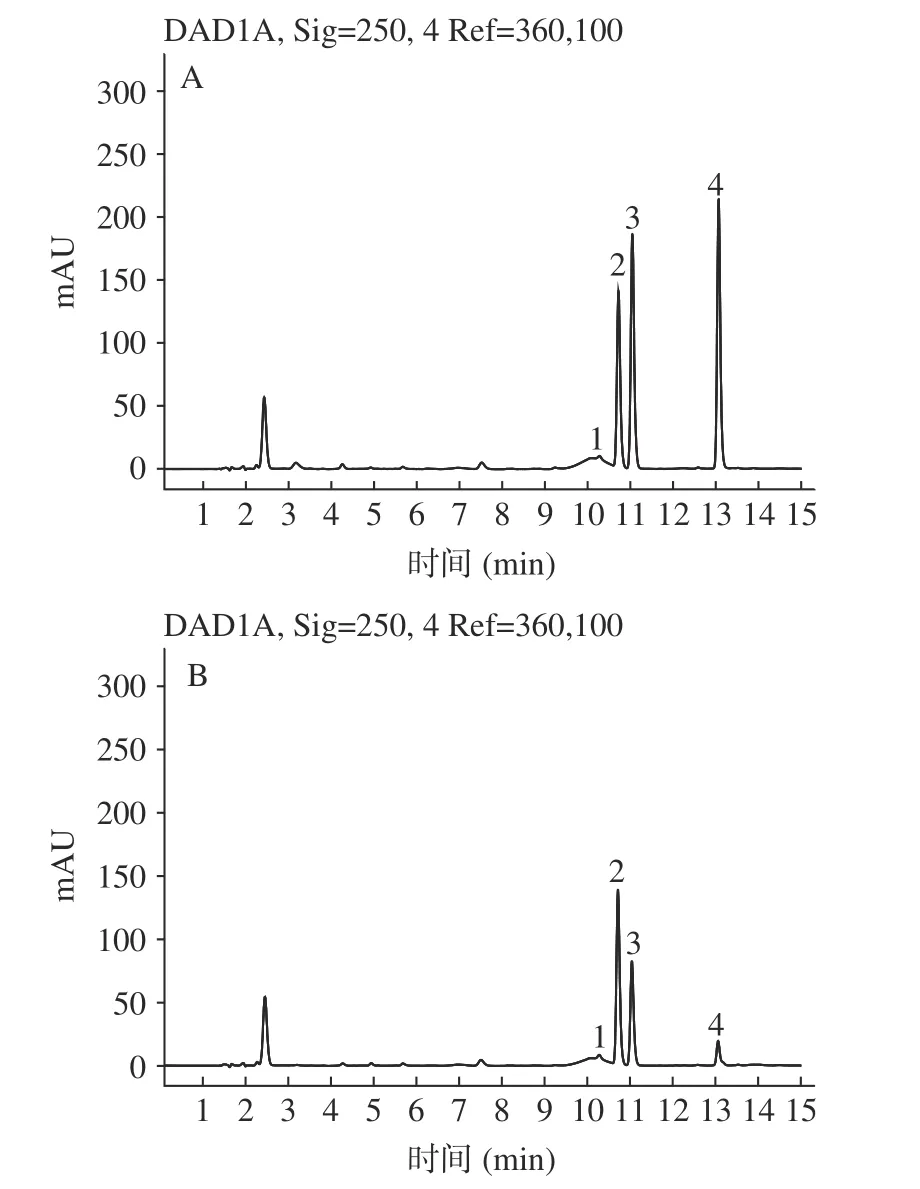
图1 对照品及样品的 HPLC 色谱图(λ=250 nm)Fig.1 HPLC chromatograms of reference standard and sample(λ=250 nm)
2.3 铁皮石斛多糖水解条件的优化
根据不同栽培方式铁皮石斛的茎、叶、花中多糖及其甘露糖和葡糖糖色谱峰面积比值的分析,可知铁皮石斛茎中多糖、甘露糖含量最高,是提取甘露糖的主要来源,叶、花产量低,多糖、甘露糖含量相对茎低得多。因此选择大棚栽培的铁皮石斛茎进行优化试验。
2.3.1 单因素实验
2.3.1.1 不同浓度的盐酸、硫酸对甘露糖含量的影响图2 显示:硫酸浓度在0.5~1.0 mol/L 之间,随浓度的增加,甘露糖含量不断增加,最大含量达62.84%,浓度大于1.0 mol/L,含量不断减少,这可能与浓度过高引起多糖炭化有关;盐酸作为催化剂水解多糖,浓度在0.5~1.5 mol/L 之间,水解程度不断增强,甘露糖最大含量为59.35%,浓度大于1.5 mol/L,含量不断减少,这可能与盐酸在高温高压闭环境中氧化性和强酸性对多糖的破坏有关。盐酸沸点低、易挥发,在水解过程中浓度难以控制,污染环境;因此选择硫酸作为催化剂水解铁皮石斛多糖。

图2 不同浓度盐酸、硫酸对甘露糖含量的影响Fig.2 The effect of different concentrations of hydrochloric acid and sulfuric acid on content of the mannose
当硫酸浓度大于1.0 mol/L 时,甘露糖含量急剧下降,在0.5 mol/L~1.0 mol/L 之间甘露糖含量变化率较小,在1.0 mol/L 时最大。因此,确定硫酸的浓度为1 mol/L 进行后续试验。
2.3.1.2 料液比 在料液比为1:0.5~1:1.5 之间,甘露糖含量随硫酸的用量增加而明显升高,1:1.5 时,含量最高,在1:1.5~1:2.5 之间,甘露糖含量增加不明显(图3),原因可能是绝大部分铁皮石斛多糖已被水解了,再增加料液比,甘露糖的含量不再增加,或料液比增加,在萃取除去衍生剂PMP 时所用的三氯甲烷用量增加,使含甘露糖的上层溶液体积增加导致。
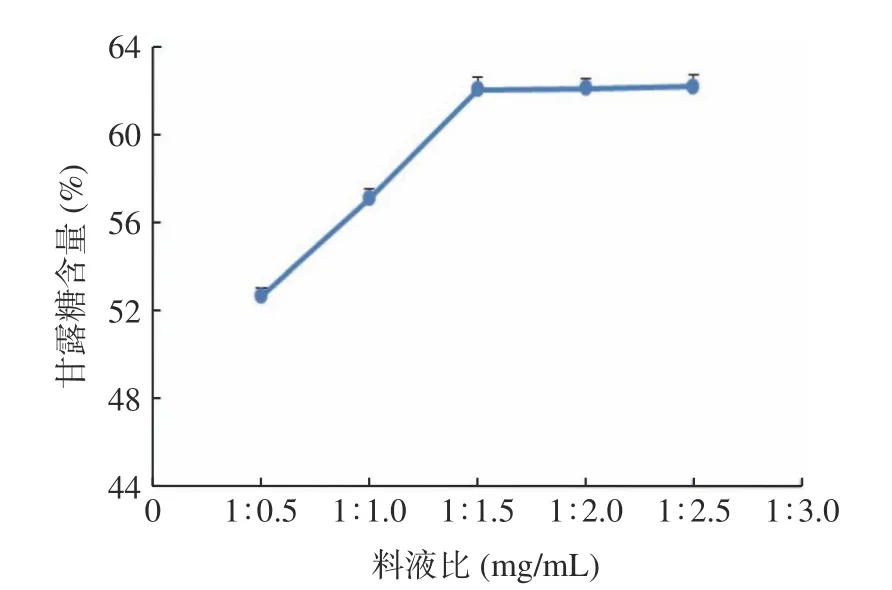
图3 料液比对甘露糖含量的影响Fig.3 The effect of the ratio of solid to liquid on the content of the mannose
在料液比1:0.5~1:1.5 时,甘露糖含量增加明显,在1:1.5 时最大,当硫酸溶液用量再增加时,甘露糖的含量不再增加,考虑到节约成本,在响应面优化试验中,设定料液比1:1.5。
2.3.1.3 水解温度 水解温度在90~110 ℃之间,温度不断升高,甘露糖含量明显增加;从110 ℃增加到120 ℃的过程中,甘露糖含量略有降低的趋势,高于120 ℃时,甘露糖含量明显降低(如图4)。苯酚-硫酸测定多糖的原理为多糖类化合物在硫酸作用下先水解成单糖,然后脱水生成糠醛衍生物,再与苯酚生成有色化合物。可见,在温度升高到110 ℃之前,温度越高,多糖水解越彻底,含量越高;当温度超过110 ℃时,甘露糖可能被氧化为糠醛衍生物,使其含量降低。故选择温度100、110、120 ℃三个梯度进行优化。

图4 水解温度对甘露糖含量的影响Fig.4 The effect of the hydrolysis temperature on the content of the mannose
2.3.1.4 水解时间 图5 表明,水解时间在20~60 min之间,甘露糖含量不断升高,说明多糖在不断水解;在60~80 min 之间,甘露糖含量增加不明显,可能因为多糖水解已完全;而在80~100 min 之间呈减小趋势,可能是甘露糖长时间在高温高压下被氧化成糖醛衍生物导致含量下降。80 min 时,甘露醇含量虽然较高,但是相较于60 min 时,含量开始下降,水解时间较长,考虑到水解效率,以及时间成本,因此选择20、40、60 min 三个水平进行优化。

图5 水解时间对甘露糖含量的影响Fig.5 The effect of the hydrolysis time on the content of the mannose
2.3.2 响应面试验
2.3.2.1 响应面试验设计与结果 以甘露糖含量为响应值,利用Central-Composite Design 法设计水解温度(A)和水解时间(B)两因素五水平的响应面试验,优化铁皮石斛多糖水解工艺,方案与结果如表3所示。
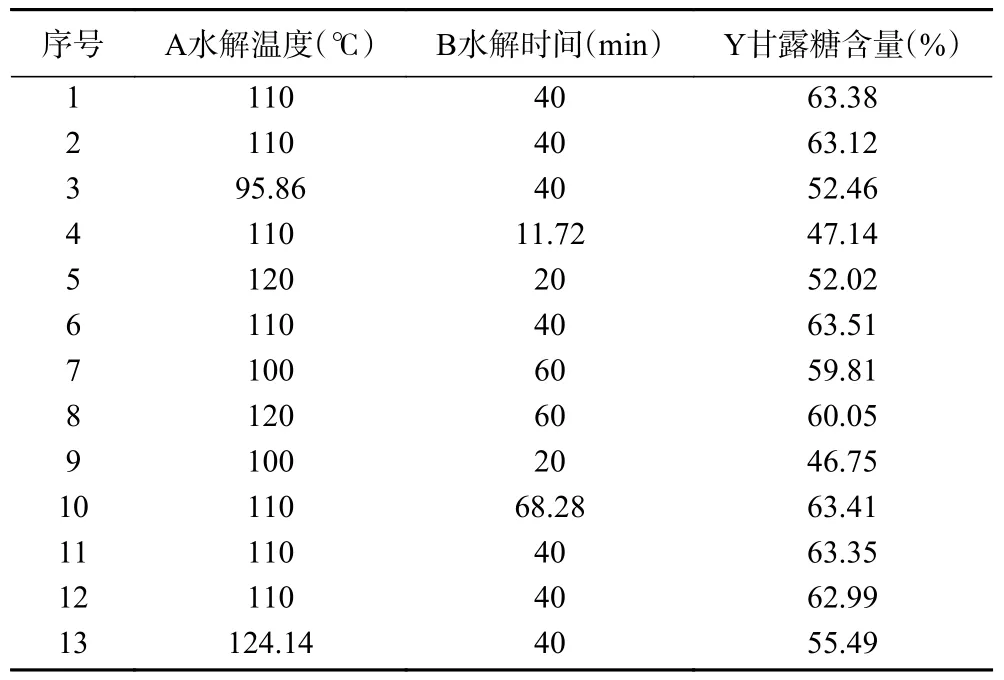
表3 响应面优化设计实验方案和结果Table 3 Experimental scheme and results of response surface optimization experiment
对甘露糖得率回归拟合分析,得方程:
Y=63.27+1.22A+5.51B-1.26AB-4.64A-3.99B,表4 结果显示:该模型0.01,差异极显著性;失拟项=0.0795,大于0.05,没有显著差异,说明该模型适合水解温度和时间对甘露糖得率影响的分析;调整系数=0.9901,变异系数CV 为0.59%,表明方程相关性良好,模型较稳定,能较好地描述实际试验。

表4 响应面回归方程方差分析Table 4 Analysis of variance (ANOVA) of response surface regression equation
2.3.2.2 方差与交互作用 表4 的方差来源A、B、AB、A、B的值分别为<0.0001、<0.0001、0.0002、<0.0001、<0.0001,(2057.34)>(101.50)>(53.53),这表明水解温度、水解时间及其交互作用对铁皮石斛多糖水解有极显著的影响(<0.01),影响大小表现为B>A>AB,在3D 响应面图曲线坡度陡峭程度上得到验证(图6),水解时间的曲面坡度大于水解温度曲面坡度,水解时间的曲面和水解温度曲面等高线都较陡峭,说明两者交互作用对多糖水解有显著影响。

图6 水解温度和水解时间对甘露糖含量交互作用的响应面图Fig.6 Response surface plot showing the effect of the hydrolysis temperature and time on the content of mannose
2.3.2.3 最佳水解工艺的确定与验证 利用该模型分析得到最佳水解工艺为:水解温度112 ℃,水解时间44 min,甘露糖含量理论预测值达到64.22%。以温度112 ℃,时间44 min,重复3 次试验验证,实验值达到64.35%±0.76%,比理论值提高0.13 百分点,可见,该模型预测较好,适于铁皮石斛多糖的水解。
2.4 3 种栽培方式的铁皮石斛茎、叶、花甘露糖含量比较
应用响应面优化的最佳水解多糖工艺,对大棚、附树及附石3 种栽培方式的铁皮石斛不同部位的多糖进行水解,结果如表5 所示,同一种栽培方式的铁皮石斛茎、叶、花甘露糖的含量表现出显著的差异(<0.05,茎>叶>花),与多糖呈现相同变化规律;茎、叶、花甘露糖含量分别在18.17%~21.05%、10.28%~11.11%和5.30%~5.75%之间,茎能达到《中国药典》对甘露糖含量13%~38%的要求;不同栽培方式的铁皮石斛茎甘露糖含量差异显著(<0.05,大棚栽培>附石栽培>附树栽培);大棚栽培的铁皮石斛叶甘露糖含量与附石、附树栽培的叶有显著差异(<0.05),而附石、附树栽培的叶甘露糖含量差异不显著(>0.05);附石、附树栽培的铁皮石斛花甘露糖含量与大棚栽培的花差异显著(<0.05),而附石、附树栽培的花甘露糖含量差异不显著(>0.05)。

表5 3 种栽培方式的铁皮石斛不同部位甘露糖含量比较分析Table 5 Content compare of mamnose in stems,leaves and flowers from D.officinale under three different cultivation methods
从甘露糖的含量总体评价铁皮石斛,大棚栽培方式的质量优于附石、附树栽培,附石优于附树栽培,这与铁皮石斛多糖含量表现出相同变化规律,这说明栽培的基质、养料和水分等外部环境对铁皮石斛多糖和甘露糖含量影响是一致的。
3 结论
利用高温高压水蒸气辅助硫酸水解铁皮石斛多糖,采用响应面法优化水解工艺,以1 mol/L 的硫酸溶液为催化剂,料液比1:1.5、水解温度112 ℃(压强0.15 MPa)、水解44 min,甘露糖含量达64.35%±0.76%。该方法温度、压强可控,操作简单,成本低,同时能杀灭微生物,用于医药、食品等领域大规模不同样品多糖水解生产高效可行。
通过比较分析铁皮石斛茎、叶、花功能性成分多糖、甘露糖的含量,结果表明,不同栽培方式的铁皮石斛茎、叶、花含丰富多糖及甘露糖,单糖主要为差向异构体的甘露糖和葡糖糖,甘露糖质量是葡糖糖的4.2~5.8 倍,可见铁皮石斛茎、叶、花是甘露糖制备的天然优质资源。铁皮石斛茎为《中国药典》规定的药用部位,从多糖、甘露糖的含量来评价,不同栽培方式的铁皮石斛的茎都符合《中国药典》标准;从食品、保健品开发的角度来看,非药用部位叶及花具有广阔的发展潜力和应用价值,可以根据不同需要,充分利用铁皮石斛附加资源叶和花,制作养生茶、食品保健品及添加剂等。
