强直性脊柱炎患者肠道菌群特征与疾病活动度及外周血淋巴细胞亚群的相关性
2022-09-26宋子怡张升校王彩虹李小峰
宋子怡,张升校,赵 蓉,乔 军,宋 珊,程 婷,王彩虹,李小峰
山西医科大学第二医院 1风湿免疫科 2风湿免疫微生态山西省重点实验室,太原 030001 3山西医科大学生理学系细胞生理学教育部重点实验室,太原 030000
强直性脊柱炎(ankylosing spondylitis,AS)是一种以中轴关节慢性炎症为主要特征的风湿免疫性疾病,病变主要累及骶髂关节与脊柱[1]。AS病因复杂,涉及遗传、感染、环境、免疫等多个方面[2],其中肠道微生物与AS发病密切相关[3]。人类白细胞抗原(human leukocyte antigen,HLA)-B27是位于细胞表面的糖蛋白,参与免疫应答调节,绝大多数AS患者呈HLA-B27阳性,其可通过与肠道菌群相互作用进而诱发AS[4]。Costello等[5]对肠道菌群16S rRNA基因测序后发现,AS患者回肠中毛螺菌科、韦荣球菌科、普雷沃氏菌科、紫单胞菌科、拟杆菌科的相对丰度升高,瘤胃球菌科、理研菌科的相对丰度降低。Zhou等[3]通过宏基因组学技术研究发现,AS患者肠道富集的菌属主要为拟杆菌、副杆菌、双歧杆菌、发酵氨基酸球菌和普雷沃氏菌。Dominguez-Lopez等[6]则发现,HLA-B27阳性AS患者肠道耶尔森氏菌、克雷伯氏菌和沙门氏菌水平增高。上述研究提示,AS患者肠道菌群处于失调状态,直接或间接促进AS发生发展,但作为免疫性疾病,AS患者中差异表达的菌群与具有免疫调节作用的淋巴细胞亚群水平的关系尚未明确,肠道菌群通过重塑免疫系统影响疾病活动度的机制相关研究尚无报道。本研究对AS患者与健康人群的16S rRNA基因进行高通量测序,分析AS患者肠道菌群变化,旨在揭示肠道菌群与AS发病的内在联系;同时探究肠道菌群与疾病活动度和外周血淋巴细胞亚群的相关性,以期为临床诊疗提供参考。
1 资料与方法
1.1 研究对象
本研究为回顾性分析。研究对象为2019年12月至2020年6月山西医科大学第二医院住院治疗的AS患者及性别、年龄与之相匹配的健康人群。收集两组的基线资料,包括性别、年龄、体质量指数、临床诊断、病程以及既往用药情况。
AS纳入标准:依据1984年修订的纽约诊断标准均确诊为AS,且处于活动期[7]。排除标准:(1)粪便标本采集前1个月内服用抗生素、益生菌/益生元等微生态调节剂,3个月内服用中药(包括中成药、成分明确的汤剂和成分未知的偏方等)或有灌肠史;(2)处于妊娠期;(3)合并恶性肿瘤、代谢性疾病或其他免疫性疾病。
健康人群来源于山西省人民医院健康体检中心,其纳入标准:自觉无身体不适且体检结果证实无明确的临床疾病。排除标准:(1)粪便标本采集前1个月内服用抗生素、益生菌/益生元等微生态调节剂,3个月内服用中药(包括中成药、成分明确的汤剂和成分未知的偏方等)或有灌肠史;(2)处于妊娠期。
本研究已通过山西医科大学第二医院伦理审查委员会审批(审批号:2017-KY-004),研究对象均签署知情同意书。
1.2 研究方法
1.2.1 标本采集
AS患者于入院第二天收集初次中段粪便标本(约10 g),1 min内称取500 mg置于无菌离心管中,-80 ℃冰箱保存备用。同时采集外周静脉血,2 h内送检实验室测定红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)和淋巴细胞亚群。
1.2.2 16S rRNA基因组DNA提取
采用QIAamp PowerFecal DNA试剂盒提取两组粪便组织肠道菌群16S rRNA基因组DNA。向加有粪便标本的磁珠管中依次加入PowerBead Solution缓冲液750 μL和Solution C1溶液60 μL,轻轻震荡混匀,置于65 ℃水浴中孵育10 min;将磁珠管置于离心机中,13 000×g离心1 min;取上清液(400~500 μL)转移至2 mL离心管中,并加入Solution C2溶液250 μL,涡旋混匀,2~8 ℃孵育5 min;瞬时离心后取600 μL上清液至2 mL离心管中;加入Solution C3溶液200 μL,依次震荡混匀、孵育、离心,取700 μL上清液至新的离心管;加入Solution C4溶液1200 μL,涡旋混匀。取700 μL上清液,加至核酸纯化柱(MB Spin Column)中,13 000×g离心1 min去除滤液;重复上述操作,直至所有上清液均通过纯化柱。加入Solution C5溶液500 μL,13 000×g离心1 min后去除滤液。于离心柱白色滤膜中心处加入Solution C6溶液100 μL洗脱DNA。采用超微量分光光度计测定DNA浓度和纯度,质量合格后-20 ℃冰箱保存。
1.2.3 16S rRNA基因扩增及测序
采用两步法对肠道菌群的16S rRNA基因V3~V4可变区进行PCR扩增。扩增体系主要包括模板DNA、dNTP、缓冲液、高保真DNA聚合酶KAPA HiFi HotStart Ready Mix(美国Roche公司)及引物(上游引物:5′-CCTACGGGNGGCWGCAG-3′;下游引物:5′-GACTACHVGGGTATCTAATCC-3′)。扩增后均采用2%琼脂糖凝胶电泳检测扩增产物的质量,合格后将PCR产物置于DNA片段筛选磁珠试剂盒中纯化并回收。采用Qubit 4.0荧光定量仪将纯化的扩增产物制备为样品混合文库,浓度达4 nmol/L后上机检测,采用Illumina Miseq PE300系统进行高通量测序。
1.2.4 生物信息学分析
将测序获得的paired-end (PE) reads拼接成一条序列。首先对原始数据进行质量控制,去除低质量的测序样本,得到清洁数据。采用Trimmomatic V0.32软件滤除低质量序列和接头序列,采用USEARCH 11.0.1软件去除嵌合序列。采用QIIME2 2021.2软件对样品序列进行质控、去噪。将每个操作分类单元(operational taxonomic unit,OTU)代表性序列与SILVA 16S rDNA数据库对比,得到最终的优化序列,随后对每个OTU进行物种分类注释和OTU聚类分析,得到对应的物种信息和丰度分布情况。后续分析采用R 4.0.1软件进行:(1)菌群多样性:采用Vegan程序包和非参数多元方差分析进行菌群多样性分析,包括α多样性和β多样性。α多样性分析中,以Chao1指数、ACE指数评估菌群丰富度,Shannon指数、Simpson指数评估菌群多样性,以Goods Coverage指数评估测序深度覆盖样本中所有物种的概率,以稀释曲线评估测序深度;β多样性分析中,采用基于Bray curtis距离矩阵的主坐标分析(principal coordinate analysis,PCoA)评估菌落特征,并绘制矩阵样本树树状图。(2)肠道微生态构成:在门、属水平上分析AS患者与健康人群肠道主要组成菌群的组成(相对丰度大于1%的物种)。(3)差异菌群:基于Stamp分析,采用t检验比较两组人群在门、属水平上的差异菌群。
1.2.5 外周血淋巴细胞测定
采用流式细胞术测定外周血淋巴细胞亚群计数。包括T细胞(CD3+CD45+)、B细胞 (CD19+CD45+)、CD4+T细胞(CD3+CD4+CD45+)、CD8+T细胞(CD3+CD8+CD45+)、自然杀伤 (natural killer,NK)细胞 (CD16+CD56+CD45+)、Th1细胞(CD4+IL-2+)、Th2细胞(CD4+IL-4+)、Th17细胞(CD4+IL-17+)、Treg细胞(CD4+CD25+Foxp3+)。
1.2.6 疾病活动度评价
AS患者疾病活动度的评定采用强直性脊柱炎疾病活动度-C反应蛋白评分(ankylosing spondylitis disease activity score-C-reactive protein,ASDAS-CRP)[8],分为临床缓解(ASDAS-CRP<1.3分)、低疾病活动度(1.3分≤ ASDAS-CRP<2.1分)、高疾病活动度(2.1分≤ ASDAS-CRP<3.5分)、极高疾病活动度(ASDAS-CRP≥3.5分)。
1.3 样本量估算
由于表示肠道菌群与疾病关联强度估计值的比值比在文献中缺乏记载,暂未进行样本量估算。查询文献,一般肠道菌群分析相关论文的样本量均较小,甚至有9例患者和9例健康人群的报道[5]。本文拟纳入62例AS患者和62例健康人群,理论上可满足数据分析需求。
1.4 统计学处理
采用R 4.0.1软件进行统计学分析。年龄、体质量指数等计量资料符合正态分布,以均数±标准差表示,组间比较采用t检验;ESR、CRP不符合正态分布,以中位数(四分位数)表示。性别、用药情况等为计数资料,以频数(百分数)表示。肠道差异菌群的比较采用t检验。采用Spearman法分析AS患者肠道差异菌群与疾病活动度、外周血淋巴细胞亚群的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入和排除标准的AS患者62例、健康人群62名。两组体质量指数无显著差异[(24.18±3.40)kg/m2比(24.33±3.52)kg/m2,P=0.810]。健康人群中,男性42例、女性20例;年龄(42.0±13.5)岁。AS患者中,男性42例、女性20例,年龄(42.0±13.7)岁,HLA-B27阳性(83.87%),病程1.8(0,8.0)年,延迟诊断2.0(0,8.5)年,ESR为32.5(14.5,54.0)mm/h,CRP为15.9(5.2,35.9)mg/L,低、高、极高疾病活动度分别11例(17.7%)、26例(41.9%)、25例(40.3%)。既往用药情况:应用激素2例(3.2%)、非甾体抗炎药24例(38.7%)、免疫抑制剂9例(14.5%)、生物制剂10例(16.1%)、其他3例(4.8%)。
2.2 测序结果
124份粪便标本,经测序、筛选共获得1 843 905条优化序列,平均每个样本14 870条序列,经过滤与合并,共获得5 594 217个用于构建OTU的高质量序列。序列共聚类为1051个OTU,其序列相似性为97%。AS患者和健康人群的Goods Coverage指数分别为99.7%、99.8%,提示测序深度已基本覆盖样本中的所有物种,测序结果可反映样本中微生物真实情况。逐步扩大随机抽样的测序深度,可见随测序深度增加,稀释曲线斜率逐渐趋于平坦,提示测序量充足,样本的 α多样性指标已达稳定状态(图1)。

图1 AS患者与健康人群肠道菌群α多样性稀释曲线图
2.3 肠道菌群多样性分析
α多样性分析显示,AS患者肠道菌群Chao1指数和ACE指数均低于健康人群,差异具有统计学意义(P均<0.05),Shannon指数和Simpson指数亦低于健康人群,但差异无统计学意义(P均>0.05)。β多样性分析显示,两组菌群在PCoA1轴与PCoA2轴之间形成两个不同的群落,表明二者的菌群结构存在显著差异(P<0.01),见图2。

图2 AS患者与健康人群肠道菌群多样性比较
AS:强直性脊柱炎
A.α多样性;B.β多样性
AS:同图1
2.4 肠道微生态构成及菌群差异
为了解两组肠道菌群的群落结构差异,本研究在门和属水平上分析了相对丰度大于1%的物种组成。结果发现两组肠道菌群优势菌门均以厚壁菌门、拟杆菌门、变形菌门为主,但在门水平和属水平上多种菌群的相对丰度存在差异。
基于两组物种差异t检验,图3展示了在门水平前10个和属水平前33个差异丰富的菌群。在门水平上,相较于健康人群,AS患者变形菌门、髌骨细菌门、广古菌门和迷踪菌门的相对丰度升高(P均<0.05),厚壁菌门、梭杆菌门、疣微菌门、协同菌门和弯曲杆菌门等菌群的相对丰度均降低(P均<0.05)。在属水平上,AS患者大肠杆菌志贺菌属、活泼瘤胃球菌属、梭状芽胞杆菌属、克雷伯氏菌属、肠球菌属、肠杆菌属、链球菌属、产粪甾醇真杆菌属等菌群的相对丰度升高(P均<0.05),普雷沃氏菌属、粪杆菌属、阿加杆菌属、罗氏菌属、戴阿利斯特杆菌属、挑剔真杆菌属、毛螺菌属、粪球菌属、拟普雷沃
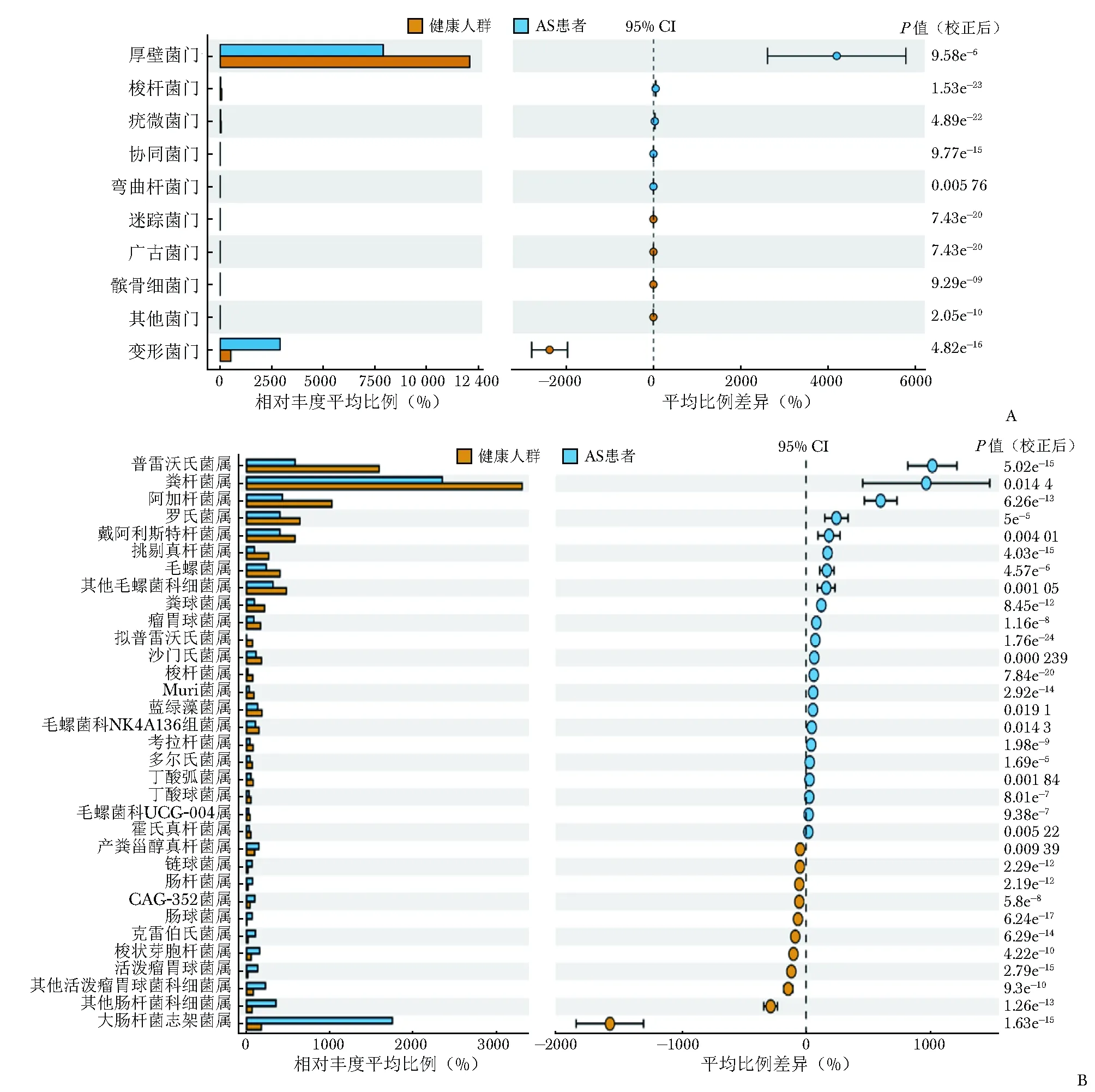
图3 基于Stamp分析和t检验的AS患者与健康人群肠道菌群差异图
A.门水平;B.属水平
AS:同图1
氏菌属、沙门氏菌属、梭杆菌属、Muri菌属、蓝绿藻菌属、毛螺菌科NK4A136组菌属、考拉杆菌属、多尔氏菌属、丁酸弧菌属、丁酸球菌属、毛螺菌科UCG-004属、霍氏真杆菌属等菌群的相对丰度均降低(P均<0.05)。
2.5 肠道菌群与AS疾病活动度、外周血淋巴细胞亚群的相关性
基于Stamp分析结果,选取AS患者中与健康人群相对丰度差异显著的菌群,进一步分析菌群与疾病活动度、外周血淋巴细胞亚群的相关性,结果显示AS患者外周血ESR与克雷伯氏菌属(r=0.309,P=0.015)、丁酸球菌属(r=0.310,P=0.014)、罗氏菌属(r=0.342,P=0.007)的相对丰度,CRP与粪杆菌属(r=0.352,P=0.005)、Muri菌属(r=0.268,P=0.035)的相对丰度,ASDAS-CRP评分与粪杆菌属(r=0.351,P=0.005)、瘤胃球菌属(r=0.274,P=0.031)的相对丰度呈正相关,见图4。
阿加杆菌属的相对丰度与T细胞(r=0.302,P=0.017)、CD4+T细胞(r=0.310,P=0.014)、B细胞(r=0.292,P=0.021)、Th2细胞(r=0.429,P<0.001)、Th17细胞(r=0.288,P=0.023)水平,链球菌属的相对丰度与B细胞水平(r=0.270,P=0.034),普雷沃氏菌属的相对丰度与Th1细胞(r=0.279,P=0.028)、Th17细胞(r=0.262,P=0.040)水平,CAG-352菌属的相对丰度与Th1细胞水平(r=0.283,P=0.030)均呈正相关;大肠杆菌志贺菌属的相对丰度与Th2细胞水平(r=-0.261,P=0.040),其他肠杆菌科细菌属的相对丰度与CD4+T细胞水平(r=-0.255,P=0.046)均呈负相关,见图4。

图4 差异菌群相对丰度与疾病活动度、外周血淋巴细胞亚群的相关性
3 讨论
肠道内微生物数量惊人,约1014个,比人体的细胞还要多,其可将食物成分分解转化为营养物质,并防止病原体通过胃肠道黏膜侵入机体、维持免疫系统稳态,与机体的多种生命活动息息相关,被称为“微生物器官”。病理状态下,肠道菌群多样性、组成和功能会发生变化,即肠道菌群紊乱。此时,致病菌可侵袭黏膜固有层,肠道通透性增加并激活炎症细胞释放促炎因子,诱发AS等多种自身免疫性疾病和炎症性疾病发生发展[9]。本研究以体检健康人群为参照,探究了AS患者肠道微生物变化,并进一步分
ESR:红细胞沉降率;CRP:C反应蛋白;ASDAS:强直性脊柱炎疾病活动度评分;*P<0.05,**P<0.01,***P<0.001
析其与疾病活动度、外周血淋巴细胞亚群的相关性,结果表明AS患者肠道菌群α多样性降低,β多样性亦存在显著差异;其克雷伯氏菌属、大肠杆菌志贺菌属、肠杆菌属等致病菌增多,厚壁菌门、梭杆菌门等有益菌减少,且与ESR、CRP、ASDAS-CRP等疾病活动度指标以及外周血淋巴细胞亚群具有一定相关性,可能促进了AS发病。
16S rRNA是原核生物核糖体中30S亚基的组成部分,根据不同物种间的同源性,其序列分为保守区和可变区,呈交替排列。原核16S rRNA序列的保守区反映了物种间的亲缘关系,而可变区则可体现物种间的差异。因此,16S rDNA可作为微生物系统分类研究中最常用的分子标志物。目前已有众多学者对肠道菌群与AS的关系进行了探索,发现AS患者的肠道菌群呈现为异于健康人群的分布特征,认为紊乱的肠道菌群可通过调节先天和适应性免疫系统促进AS进展,但不同研究对AS患者肠道菌群多样性特征存在争议[3,5,10-11]。Costello等[5]、Breban等[12]通过对AS患者肠道菌群16S rRNA基因进行测序,分别得出AS患者肠道菌群多样性增加和多样性降低两个截然不同的结论。Zhang等[10]、Liu等[13]比较了AS患者与健康人群肠道菌群多样性后发现,Shannon、Simpson、Chao1和ACE指数均无显著差异。Chen等[11]在一项纳入41例AS患者和19名健康人群的研究中发现,二者的Shannon和Simpson指数无显著差异,而β多样性有显著差异,基于差异菌建立的模型区分AS患者和健康人群的曲线下面积高达0.950。本研究首先对AS患者的菌群多样性进行了探索,结果显示相较于健康人群,代表物种丰富度的ACE指数和Chao1指数在AS患者中均降低,表示物种多样性的Shannon指数和Simpson指数无显著变化;在β多样性分析中,AS患者形成了不同于健康人群的群落,表明菌群多样性改变可能并非AS患者肠道菌群变化的最主要特征,相较菌群种类,最主要的变化主要体现为细菌丰富度变化,这可能进一步影响其肠道功能。本研究AS患者肠道菌群多样性变化特征与既往研究不完全一致,分析原因:肠道菌群受等多种因素的影响,如年龄、种族、地理位置、饮食习惯、吸烟情况;此外本研究部分AS患者正在接受药物治疗,亦可能影响其菌群多样性检测结果。
除菌群多样性存在差异外,虽然AS患者与健康人群肠道菌群优势菌门均以厚壁菌门、拟杆菌门、变形菌门为主,但在门水平和属水平上二者多种菌群的丰度存在差异。在门水平上,AS患者变形菌门、髌骨细菌门、广古菌门等表达升高,厚壁菌门、梭杆菌门、疣微菌门、协同菌门和弯曲杆菌门等表达降低;在属水平上,大肠杆菌志贺菌属、克雷伯氏菌属、肠球菌属、链球菌属、肠杆菌属等表达较高,普雷沃氏菌属、粪杆菌属等表达较低。这些差异表达的菌群不仅影响肠道微生物代谢水平,同时可通过增加肠道通透性、分子模拟以及代谢产物等机制刺激机体的免疫系统,促进自身抗体生成,加速AS发展。如AS患者回肠中存在大肠杆菌等侵入性和粘附性细菌,其丰度增加可导致紧密连接蛋白减少和肠道血管屏障受损,进而引起“肠漏”[14]。此时,肠道内的病原体及细菌产物可能随血液到达关节等部位,诱发炎症反应。在HLA-B27阳性的遗传背景下,肠道菌群紊乱可增加AS发病风险[15]。一些研究支持了肠道菌群可通过与HLA-B27相互作用增加AS发病风险的观点。据报道,HLA-B27阳性个体对克雷伯氏菌、耶尔森菌和沙门氏菌热休克蛋白的IgG抗体水平高于HLA-B27阴性人群[6]。
关于AS中肠道微生物组和HLA-B27的作用机制有两种假说。Ebringer等[16]针对肠道菌群与AS的关系提出了“分子模拟”假说,认为肠道克雷伯氏菌的多肽结构与HLA-B27分子中的部分氨基酸序列相似,由此产生的交叉免疫反应可激活CD8+T或B细胞,诱发AS。另一种假说认为由于HLA-B27结构不稳定且在内质网中合成时速度缓慢,易发生折叠错误,诱导内质网发生应激反应,导致Paneth细胞表达过多白细胞介素(interleukin,IL)-23及辅助性Th17细胞产生过量干扰素-β、肿瘤坏死因子-α与IL-17[17],发生持续性炎症反应,该过程与沙门氏菌复制能力增强有关[18]。本研究中沙门氏菌的相对丰度降低,推测可能与大部分患者既往或正在接受治疗有关。据研究表明,延缓病情的抗风湿药[19]、生物制剂[20]可通过维持肠道紧密连接或恢复正常肠道菌群结构延缓AS发展。此外,链球菌属等机会性致病菌可诱导具有机体免疫防御的功能细胞因子和趋化因子快速产生(如干扰素-γ),并介导参与AS发病的促炎细胞因子IL-17和肿瘤坏死因子-α分泌[21-22]。厚壁菌门、梭状芽胞杆菌等益生菌通过分解膳食纤维产生短链脂肪酸(short chain fatty acids,SCFAs),诱导Treg分化,进而产生IL-10等抗炎细胞因子,增强机体免疫耐受功能[23-24]。本研究发现,厚壁菌门、梭杆菌门等益生菌的相对丰度减少,可能促进了AS发病。
ESR、CRP、ASDAS-CRP是评价AS疾病活动度的常用指标,其水平高低与炎性腰背痛、晨僵等症状显著相关。本研究发现,克雷伯氏菌属、丁酸球菌属、罗氏菌属、粪杆菌属、Muri菌属、粪杆菌属和瘤胃球菌属等特定菌群表达水平与疾病活动度呈正相关,表明这些细菌可能参与AS患者病情进展。克雷伯氏菌是一类有荚膜的革兰氏阴性杆菌,其中肺炎克雷伯菌是医源性感染的主要细菌之一。HLA-B27阳性AS患者中,粪便产气克雷伯菌与急性非肉芽肿性前葡萄膜炎和外周滑膜炎具有相关性[25]。Zhang等[26]认为肠道菌群参与了AS发病,并从基因学说、受体学说、分子拟态等方面总结了肺炎克雷伯菌感染促进AS发病的机制。此外,有研究[27]发现肺炎克雷伯菌可与抗HLA-B27单克隆抗体相结合,提示肺炎克雷伯菌可通过交叉免疫反应参与AS发生与发展。在非活动性AS患者中,克雷伯氏菌培养阳性与随后发生的炎症损伤具有相关性,认为克雷伯氏菌是AS的始动因子,进一步证实了该菌在AS进展中的作用[28]。上述研究表明,以克雷伯氏菌增高为代表的肠道菌群紊乱可引起疾病活动度增加,进而促进AS发展[29]。AS患者常合并炎症性肠病(inflammatory bowel disease,IBD),研究表明活泼瘤胃球菌属丰度增加与较高的IBD疾病活动度相关,该菌群可通过影响肠道黏液层的功能而破坏肠道屏障完整性,促进疾病发生[30]。本研究活泼瘤胃球菌属的相对丰度增加,与Breban等[12]观察结果一致,为活泼瘤胃球菌参与AS发病提供了证据。
AS作为一种风湿免疫性疾病,免疫功能异常在其中占据重要地位。外周血淋巴细胞亚群是机体主要的免疫细胞,其与AS的关系逐渐被研究者所关注。为进一步明确肠道菌群在AS进展中的作用,本研究首次对肠道菌群与AS患者外周血淋巴细胞亚群水平的相关性进行了分析。结果显示阿加杆菌属的相对丰度与T细胞、CD4+T细胞、B细胞、Th2细胞、Th17细胞,普雷沃氏菌属的相对丰度与Th1细胞、Th17细胞水平呈正相关。阿加杆菌属数量增加可激发肠道免疫反应,诱导Th17等促炎免疫细胞分化,介导AS进展,但具体机制尚不明确。普雷沃氏菌是一种条件致病菌,与肠道炎症关系密切,在类风湿性关节炎等疾病中,其表达增高可作为机体微生物失调的标志性特征。普雷沃氏菌主要激活Toll样受体2,促进抗原呈递细胞产生IL-23和IL-1等炎症因子,并刺激上皮细胞产生IL-8、IL-6和趋化因子CCL20,诱导肠道黏膜中性粒细胞聚集,发生Th17免疫反应。此外,普雷沃氏菌属介导的黏膜炎症可播散至全身,导致全身性疾病[31]。本研究结果阿加杆菌属与普雷沃氏菌属的相对丰度在AS患者中均显著降低,推测可能与患者入院前接受治疗有关,且其他因素如饮食习惯、地理环境等亦可影响肠道菌群特征。
本研究局限性:(1)部分患者正在接受或入院前已接受药物治疗,可能影响肠道菌群测定结果。(2)因肠道菌群受种族、地理位置、饮食习惯等影响,本研究对象主要来源于山西省内,不能代表全国人群的肠道菌群特征,结果外推需谨慎。
综上所述,随着16S rRNA基因测序和宏基因组学等技术取得突破性进展,肠道菌群和AS的联系陆续被揭示。本研究进一步明确了既往研究结果,提示AS患者肠道菌群多样性降低,处于菌群失调状态,并发现肠道菌群紊乱可能通过调控淋巴细胞亚群的数目和功能进而影响AS疾病活动度、参与AS的发生与发展,为该病的临床诊疗提供了新思路。
作者贡献:宋子怡负责选题设计并撰写论文初稿;张升校、乔军负责实验和数据分析;赵蓉、宋珊、程婷负责数据收集和文献查阅;王彩虹、李小峰负责论文修订。
利益冲突:所有作者均声明不存在利益冲突
