急性胰腺炎患者肠道微生态及其与病情严重程度的相关性:一项前瞻性横断面研究
2022-09-26韩梓莹范正阳胡晓敏
韩梓莹,宋 锴,范正阳,宋 晓,胡晓敏,吴 东,4
中国医学科学院北京协和医院 1消化内科 2急诊科 3医学科学研究中心 4疑难重症及罕见病国家重点实验室,北京 100730
急性胰腺炎(acute pancreatitis,AP)是一种常见的消化系统急症,主要表现为持续性上腹部疼痛,伴恶心呕吐症状,随病情进展可出现胰腺坏死并继发全身症状。AP全球发病率约为34/10万,近年来呈明显增高趋势[1]。重症急性胰腺炎(severe acute pancreatitis,SAP)是AP的加重期,病情危重、进展迅速且并发症多,常需转入ICU治疗,短期死亡率高达10%~25%[2]。AP发病机制涉及胰蛋白酶异常激活、钙超载、线粒体功能受损、自噬受损等多方面因素,全身炎症风暴造成器官功能障碍是病情进展的标志[3-4]。近年来,肠道菌群与AP的关系引起了临床高度重视。Yu等[5]针对AP患者肠道菌群组成进行分析,发现相较健康人群,AP患者肠道菌群中肠球菌、大肠杆菌的比例明显增加。多个纳入不同病情AP患者的研究均发现,轻症急性胰腺炎(mild acute pancreatitis,MAP)、中度重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)和SAP患者的肠道菌群构成存在显著差异[6-7]。研究认为,肠道微生态变化可能参与了AP患者的肠屏障损伤,以致肠黏膜通透性增加和肠道菌群易位,进而加重了AP病情[8-9]。但目前肠道菌群与AP的相关性分析仍较少,尤其缺乏病情严重程度及预后标志物的相关研究。本研究基于肠道菌群 16S rRNA 基因测序及生物信息分析结果,探究AP患者肠道菌群变化及其与病情严重程度的相关性。
1 对象与方法
1.1 研究对象
本研究为前瞻性研究。以2018年6月至2022年1月北京协和医院住院的AP患者和健康志愿者为研究对象。其中AP诊断标准[10]:(1)出现AP特征性腹痛和腹部压痛;(2)血清淀粉酶/脂肪酶值超过正常上限3倍;(3)影像学资料符合AP特征性改变。满足其中任意2条可诊断为AP。其中不伴器官衰竭者为MAP,伴一过性器官衰竭者(≤48 h)为MSAP,伴持续性器官衰竭者(>48 h)为SAP。AP组患者纳入标准:(1)依据临床检查、血液学指标及影像学结果,AP诊断明确;(2)均为首次发病且发病48 h内入院治疗;(3)同意进行肠道菌群检测。排除标准:(1)年龄<16岁;(2)有慢性胰腺炎病史;(3)发病前2个月内有抗生素、益生菌、中草药等药物服用史;(4)中途退出或自行离院者。
健康志愿者来自北京协和医院、北京协和医学院招募人员,并根据性别比例与AP患者进行匹配。健康志愿者纳入标准:(1)自觉体健,无身体不适,体检证实无代谢性、心脑血管和肠道等疾病;(2)年龄18~65岁;(3)非妊娠期/哺乳期女性。排除标准:(1)近期服用益生菌、抗生素、中药等影响肠道功能药物的治疗者;(2)为减重或其他特殊目的而节食者。
本研究已通过北京协和医院伦理审查委员会审批(审批号:JS1826),所有研究对象均签署知情同意书。
1.2 方法
1.2.1 临床资料收集与标本采集
收集健康志愿者和AP患者的性别、年龄、体质量指数(body mass index,BMI)以及AP病因、严重程度评分(入院24 h内)、并发症、器官衰竭情况、住院时间、预后信息等临床资料。通过直肠拭子留取新鲜粪便标本。取样前需禁食12 h,AP患者取样距发病的时间(以腹痛发作为起始)不应超过48 h。标本采集前需以肥皂、清水和75%酒精充分清洁肛门周围,使用无菌拭子插入肛门深处4~5 cm,轻轻旋转以获取粪便标本,立即置于无菌管中[5],-80 ℃冰箱保持。
1.2.2 DNA提取与16S rRNA 基因扩增、测序
采用E.Z.N.A®Soil DNA Kit试剂盒(美国Omega公司)完成基因组DNA提取,并对细菌核糖体16S rRNA的V3~V4区域进行PCR扩增。上游引物:5′-ACTCCTACGGGAGGCAGCAG-3′;下游引物:5′-GGA CTACHVGGGTWTCTAAT-3′。PCR反应体系:FastPfu缓冲液4 μL,dNTP混合物2 μL,BSA 0.2 μL,FastPfu聚合酶0.4 μL,上下游引物各0.8 μL,基因组DNA 10 ng,加ddH2O补至20 μL。扩增条件:95 ℃初始变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,25个循环;72 ℃延伸10 min。采用Illumina Miseq平台进行文库构建并进行高通量测序。
1.2.3 生物信息学分析
采用Fastp软件对原始序列进行质控,采用FLASH软件对序列进行拼接。采用Uparse 7.0.1090对质控合格的序列进行分类操作单元(operational taxonomic unit,OTU)聚类分析。采用RDP classifier贝叶斯算法对97%相似度水平的OTU代表序列进行微生物分类学分析:(1)α多样性(通过Mothur 1.30.2软件完成):以Chao指数评估菌群丰度,Shannon指数评估菌群多样性;(2)β多样性(采用R软件的Vegan程序包完成):采用主坐标分析法(principal coordinates analysis,PCoA)评估菌群β多样性;(3)差异菌群鉴别:以群落Bar图(R软件的Ggplot2程序包)、线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)评估AP患者与健康志愿者的菌群组成差异(设置LDA评分>2为差异具有统计学意义);(4)差异菌群功能分析:对于存在差异的菌群,采用PICRUSt2与BugBase进行功能预测,以评估该菌群的潜在作用;(5)AP患者与转入ICU的AP患者(AP-ICU)识别:通过随机森林算法筛选AP患者与健康志愿者之间肠道菌群差异的重要标记,选取前3个重要标记计算疾病概率(probability of disease,POD)指数。由于AP-ICU患者病情更重、并发症更多、预后更差,早期识别并提前干预,有助于改善此类患者的临床预后。进一步计算AP-ICU与AP非ICU患者(AP-non-ICU)的POD指数,进行亚组分析。采用受试者操作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)评估POD指数识别AP、AP-ICU患者的效果。
1.3 样本量估算
由于目前文献中缺乏AP患者平均OTU数量相关数据,暂无法进行样本量估算。根据研究目的,选取AP患者粪便中OTU值进行效应量计算以评估样本是否满足需求。本研究预计纳入AP患者60例,健康人群20例。AP患者的OTU均值为186.05±61.20,健康人群为204.10±33.52。检验水准α=0.05,把握度 1-β=0.80,经计算效应量为44.8,即假设检验可区分的OTU均数改变的最小差异为24%。参考既往文献,认为该效应量符合要求[11]。效应量分析由PASS 15.0软件分析完成。
1.4 统计学处理
采用SPSS 26.0进行统计学分析。年龄、住院时间、急性生理学及慢性健康状况Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)等正态分布计量资料,以均数±标准差表示,组间比较采用t检验;序贯器官衰竭评分(sequential organ failure assessment,SOFA)不符合正态分布,以中位数(四分位数)表示,组间比较采用Mann-WhitneyU检验。菌群相对丰度的比较采用Mann-WhitneyU检验或Kruskal-WallisH检验。性别、病因、并发症等计数资料以频数(百分数)表示,组间比较采用卡方检验或Fisher精确概率法。采用Spearman法分析肠道菌群相对丰度与临床特征的相关性。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入和排除标准的AP患者60例、健康志愿者20名。AP患者中MAP、MSAP、SAP各20例;病因为胆源性26例、脂源性29例、酒精源性5例;AP-ICU 22例;住院时间为(26.2±9.7)d;ICU住院时间为(9.3±5.4)d;院内死亡1例。
AP患者年龄[(46.3±15.2)岁比(37.2±12.0)岁,P=0.017]、BMI[(26.6±3.3) kg/m2比(22.8±2.9)kg/m2,P<0.001]均高于健康志愿者,男性比例(51.7%比55.0%,P>0.999)与健康志愿者无显著差异。
2.2 肠道菌群多样性分析
α多样性分析显示,AP患者肠道菌群Shannon指数低于健康志愿者,差异具有统计学意义(P<0.05),Chao指数亦低于健康志愿者,但差异无统计学意义(P>0.05),提示AP患者的肠道菌群丰富度降低(图1A,1B)。β多样性分析显示,两组肠道菌群在PCoA1、PCoA2之间分离,形成两个不同的群落,提示两组菌群结构存在差异(图1C)。

图1 AP患者与健康志愿者肠道菌群多样性比较
2.3 菌群组成及其差异
门水平上,厚壁菌门(d_Firmicutes)为AP患者和健康志愿者的主要组成菌门。相较健康志愿者,AP患者厚壁菌门的相对丰度明显减少,拟杆菌门(d_Bacteroidetes)和变形菌门(d_Proteobacteria)的相对丰度明显升高(图2A);科水平上,AP患者毛螺菌科(f_Lachnospiraceae)、双歧杆菌科(f_Bifidobacteriaceae)的相对丰度明显减少,肠球菌科(f_Enterococcaceae)、肠杆菌科(f_Enterobacteria-ceae)、拟杆菌科(f_Bacteroidaceae)的相对丰度明显增加(图2B);属水平上,AP患者大肠志贺菌属(g_Escherichia-Shigella)与肠球菌属(g_Enterococ-cus)的相对丰度明显增加,布劳特氏菌属(g_Blautia)与双歧杆菌属(g_Bifidobacterium)的相对丰度明显降低(图2C);种水平上,AP患者大肠杆菌(Escherichia_coli)与耐久肠球菌(Enterococcus_dur-ans)的相对丰度显著增加(图2D)。

图2 AP患者与健康志愿者群肠道菌群组成比较
LEfSe分析结果显示,包括大肠志贺菌属、肠球菌属和肠球菌科在内的多个菌群在AP患者中呈优势分布,布劳特氏菌属和双歧杆菌属等菌群在健康志愿者中呈优势分布(图3)。
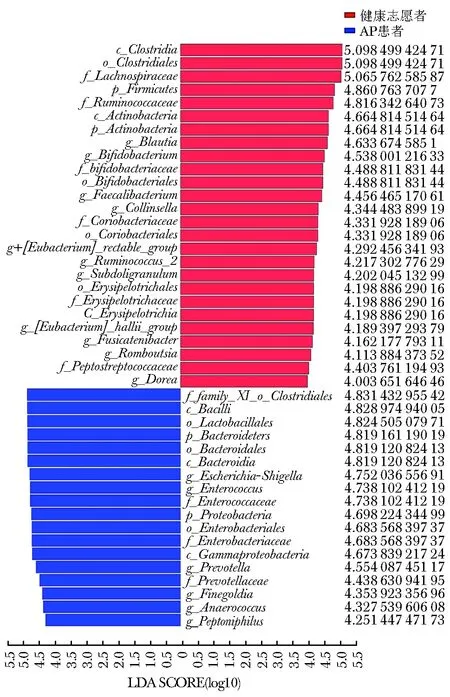
图3 LEfSe分析结果LEfSe:线性判别分析效应大小;AP:同图1
2.4 差异菌群功能分析
PICRUSt2功能分析显示,相较健康志愿者,AP患者肠道菌群的赖氨酸、组氨酸、异亮氨酸、精氨酸、亮氨酸、酪氨酸合成通路明显受阻(图4A)。BugBase表型预测显示,AP患者肠道需氧菌与兼性厌氧菌相对丰度均显著高于健康志愿者,菌群致病潜力、移动元件含量、氧化耐受能力亦明显高于健康志愿者(P均<0.05),提示AP患者肠道菌群可能具备更强的致病性与迁移能力(图4B)。
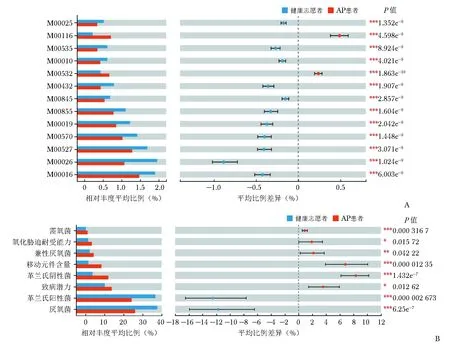
图4 AP患者与健康志愿者差异菌群功能预测
A.α多样性Chao指数分析;B.α多样性Shannon指数分析;C.β多样性分析;AP:急性胰腺炎
A.门水平;B.科水平;C.属水平;D.种水平;AP:同图1
2.5 AP患者识别
经随机森林算法筛选后发现,纳入3个差异菌群的重要标记可达到最优的模型分类效果。前3个重要标记分别为真杆菌属未培养株(uncultured_bacterium_g_Eubacterium_halli)、真杆菌属未分类株(unclassified_g_Eubacterium_hallii)与大芬戈尔德菌未培养株(uncultured_bacterium_g_Finegoldia),基于该标记计算POD指数。与健康志愿者比较,AP患者的POD指数均值显著增加(P<0.001)。ROC曲线显示,POD指数区分AP患者与健康志愿者的AUC为0.996 (95%CI:0.988~1.000),提示粪便微生物标志物POD指数对AP患者具有较高的识别能力(图5)。

图5 肠道菌群对AP患者的识别效果
2.6 肠道菌群与病情严重程度的相关性
与AP-non-ICU患者比较,AP-ICU患者中SAP比例、SOFA评分、APACHE Ⅱ 评分、全身感染、局部并发症与器官衰竭发生率均更高,住院时间更长(P均<0.05),提示AP-ICU患者病情更严重(表1)。

表1 住院期间AP-ICU与AP-non-ICU患者临床资料比较
2.6.1 AP-ICU与AP-non-ICU患者肠道菌群组成与功能比较
属水平上,相较于AP-non-ICU患者,AP-ICU患者肠球菌属的相对丰度显著增加,拟杆菌属的相对丰度明显减少(图6A);种水平上,AP-ICU患者耐久肠球菌的相对丰度明显增加,多氏拟杆菌(Bacteroides_dorei)的相对丰度明显减少(图6B)。
PICRUSt2功能分析显示,相较于AP-non-ICU患者,AP-ICU患者肠道菌群的万古霉素耐药相关通路、多个糖代谢相关通路的功能均明显增强(图6C)。

图6 AP-ICU与AP-non-ICU患者肠道菌群组成及功能比较
2.6.2 AP-ICU患者识别
随机森林算法筛选的前3个重要标记分别为耐久肠球菌、厌氧球菌属未培养株(uncultured_organism_g_Anaerococcus)与厚壁菌门未分类株(unclassified_p_Firmicutes)。基于此标记,进一步计算POD指数。与AP-non-ICU患者比较,AP-ICU患者POD指数均值显著增加(P=0.0019)。ROC曲线分析显示,POD指数区分AP-ICU与AP-non-ICU的AUC为0.743(95% CI:0.605~0.880),提示粪便微生物标志物亦可识别转入ICU的AP患者(图7)。

图7 肠道菌群对转入AP-ICU患者的识别效果
通过对比发现,AP患者与健康志愿者、AP-ICU患者与AP-non-ICU患者存在共同的差异菌群,即肠球菌属、耐久肠球菌,此两个指标的相对丰度在健康志愿者、AP-non-ICU患者、AP-ICU患者中呈逐渐升高的趋势(图8A、8B)。临床特征相关性分析提示,耐久肠球菌与AP患者局部并发症、器官衰竭、全身感染、住院时间、ICU住院时间等均呈正相关,尤其与全身感染发生率的相关性最强(图8C)。
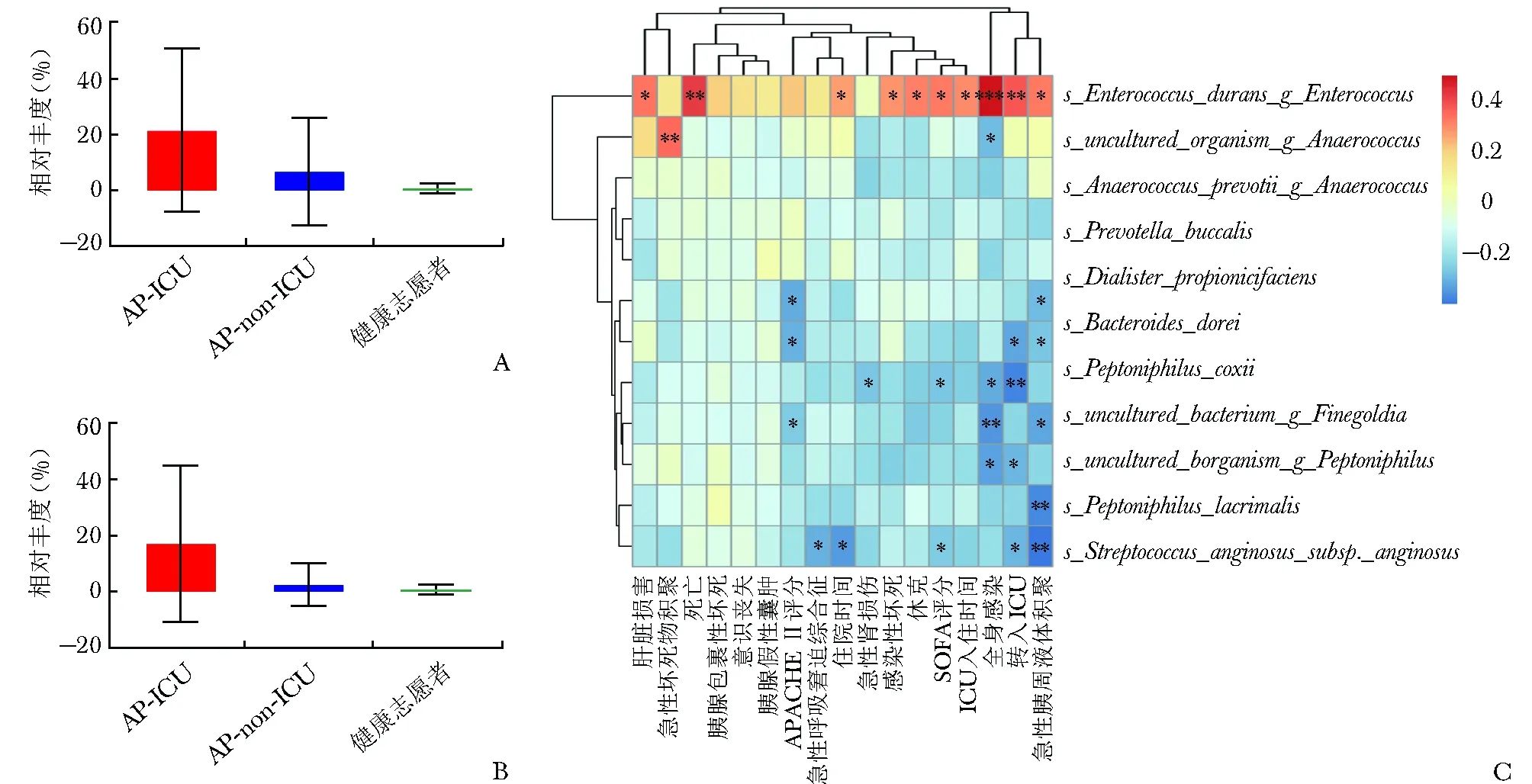
图8 差异菌群水平变化及其与临床特征的相关性分析
AP-ICU:转入ICU的AP患者;AP-non-ICU:未转入ICU的AP患者;BMI:体质量指数;MAP:轻症AP;MSAP:中度重症AP;SAP:重症AP;SOFA:序贯器官衰竭评分;APACHE Ⅱ:急性生理学及慢性健康状况Ⅱ;AP:同图1
A.PICRUSt2功能分析;B.BugBase表型预测
M00016:赖氨酸合成(琥珀酸-二氨基庚二酸通路);M00026:组氨酸合成通路;M00527:赖氨酸合成(二氨基庚二酸转氨酶通路);M00570:异亮氨酸合成通路;M00019:缬氨酸、异亮氨酸合成通路;M00855:糖原降解通路;M00845:精氨酸合成通路;M00432:亮氨酸合成通路;M00532:光呼吸作用;M00010:柠檬酸循环(2-羟戊二酸合成通路);M00535:异亮氨酸合成通路;M00116:半醌合成通路;M00025:酪氨酸合成通路;AP:同图1
A.疾病概率指数均值比较;B.疾病概率指数识别AP患者的受试者操作特征曲线图;AP:同图1
A.属水平;B.种水平;C.PICRUSt2功能分析;AP:同图1;AP-ICU、AP-non-ICU:同表1
M00165:还原磷酸戊糖循环通路(卡尔文循环);M00017:甲硫氨酸生物合成通路:M00126:四氢叶酸生物合成通路;M00144:NADH-醌氧化还原酶通路;M00167:磷酸戊糖还原循环通路;M00854:糖原合成通路;M00345:甲醛同化(核酮糖单磷酸途径);M00549:核苷酸糖生物合成通路;M00844:精氨酸合成通路;M00344:甲醛同化(木酮糖单磷酸通路):M00554:核苷酸糖生物合成通路;M00168:景天酸代谢通路;M00652:万古霉素耐药相关通路
A.疾病概率指数均值比较;B.疾病概率指数识别AP-ICU患者的受试者操作特征曲线图;AP:同图1;AP-ICU、AP-non-ICU:同表1
A.肠球菌属在不同人群中的变化;B.耐久肠球菌在不同人群中的变化;C.差异菌群与临床特征的相关性分析结果(红色为正相关,蓝色为负相关);AP-ICU、AP-non-ICU、APACHE Ⅱ、SOFA:同表1
3 讨论
本研究对健康志愿者与AP患者粪便标本中肠道菌群16S rRNA 进行了基因测序与生物信息学分析,以探究肠道菌群与AP的相关性。结果显示,相较于健康志愿者,AP患者肠道菌群多样性降低,菌群丰度亦存在不同,主要表现为大肠志贺菌属、肠球菌属和肠球菌科等多个菌群的相对丰度增多,布劳特氏菌属与双歧杆菌属等菌群的相对丰度降低;且其多种氨基酸合成通路受阻,菌群致病性增高。在对AP-ICU与AP-non-ICU患者的亚组分析中得到了类似结果,二者的菌群组成亦存在明显差异,且AP-ICU患者肠道菌群对抗生素耐药、糖代谢相关通路的功能增强。基于差异菌群计算的POD指数,区分AP患者与健康志愿者的AUC为0.996,区分AP-ICU与AP-non-ICU患者的AUC为0.743,提示肠道菌群有望作为早期识别AP、病情较重AP的无创性生物标志物,辅助临床决策。
3.1 AP患者肠道菌群变化
本研究菌群多样性分析显示,AP患者肠道菌群多样性明显降低,提示AP患者肠道菌群呈特异性改变。既往研究发现,在门水平上人类肠道菌群的主要组成成分为厚壁菌门和拟杆菌门,其次为放线菌门和变形菌门[12]。本研究健康志愿者肠道菌群分布符合上述特点,但AP患者拟杆菌门与变形菌门的比例明显增加。科水平上,AP患者毛螺菌科、双歧杆菌科的占比明显减少,肠球菌科、肠杆菌科、拟杆菌科的占比明显增加,提示AP患者肠道菌群构成紊乱。属水平与种水平上,大肠志贺菌与肠球菌为AP患者的优势菌群,而布劳特氏菌与双歧杆菌则为健康志愿者的优势菌群,与在AP小鼠模型中的检测结果一致[6-7,13-15]。大肠志贺菌属和肠球菌属被认为是AP的潜在致病菌,与器官衰竭、脓毒症等并发症相关[7]。大肠志贺菌属参与肠上皮侵袭、菌群与内毒素移位等感染相关通路的调节[7]。肠球菌属是肠道条件致病菌,亦被证实与尿路、肠道感染有关。Mei等[16]研究发现,预防性给予SAP小鼠寡糖可改善肠道菌群失调,减轻病情严重程度,其作用机制与给药后大肠志贺菌属和肠球菌属得到清除有关。基于体外培养与分子技术,在半数以上AP患者的胰液引流液和外周血中鉴定出包括大肠志贺菌属与肠球菌属在内的多种易位菌群,提示肠道菌群可通过破坏肠屏障功能加重AP病情[17-19]。
布劳特氏菌属、双歧杆菌属具有益生菌的特性,其中布劳特氏菌属可逆转抗生素耐药,在炎症性肠病、结直肠癌、肠易激综合征、糖尿病等多种炎症和代谢性疾病中其丰度显著减少[20-21]。Zhu等[7]比较了不同病情AP患者的肠道菌群组成差异,发现SAP患者的布劳特氏菌属丰度显著低于MAP和MSAP患者。作为益生菌制剂的主要成分之一,双岐杆菌属有助于维持正常的肠黏膜屏障,对炎症性肠病、肝硬化、幽门螺杆菌感染、抗生素相关腹泻等疾病具有缓解作用[13,22]。丁酸盐是双岐杆菌的分泌物,被证实可逆转高脂饮食造成的小鼠菌群紊乱,减轻SAP相关器官损害[23-25]。此外,炎症因子在AP病情进展中发挥重要作用[26]。肿瘤坏死因子-α、白细胞介素-6等多种炎症因子含量与肠球菌属水平呈正相关,与双岐杆菌属水平呈负相关,提示大肠志贺菌属、肠球菌属增多以及布劳特氏菌属、双岐杆菌属减少可能参与AP发病的调控[7,13-14]。
3.2 差异菌群功能预测
既往研究发现,AP患者血液与骨骼肌中多种氨基酸及总体氨基酸水平均明显降低,尤其合并脓毒症与多器官衰竭的AP患者此现象更为明显[27-28]。动态监测后发现,AP发病初期赖氨酸、组氨酸、酪氨酸呈先升高后降低的趋势,而异亮氨酸、亮氨酸水平则存在先降低后升高的趋势,总体而言AP发病期多种氨基酸水平低于康复期[29]。慢性胰腺炎患者中,赖氨酸、酪氨酸、组氨酸等多种氨基酸亦出现明显减少的现象[30]。AP患者体内氨基酸水平变化除了与发病后禁食导致的摄入不足相关外,亦与肠内菌群变化导致炎症消耗增多以及肠黏膜破坏导致吸收不良相关[30]。
本研究在菌群组成比较结果的基础上,通过PICRUSt2与BugBase对差异菌群的功能进行了预测,结果显示AP患者肠道菌群的赖氨酸、组氨酸、异亮氨酸、精氨酸、亮氨酸、酪氨酸合成通路明显受阻。适当补充肠内营养可降低SAP患者死亡率,预防并发症发生[31]。赖氨酸可减轻炎症反应,对药物诱导的AP具有保护作用[32]。额外补充赖氨酸可降低AP小鼠血淀粉酶水平,改善组织学评分[33]。需注意的是,摄入过量氨基酸亦可能加重AP[34],如大量补充精氨酸、组氨酸可诱发AP,精氨酸注射被应用于AP动物模型诱导[34-36]。因此,氨基酸水平与AP的关系仍需深入研究。
3.3 ICU患者亚组分析
本研究结果显示,与AP-non-ICU患者比较,AP-ICU患者拟杆菌属的相对丰度明显减少,进一步在种水平进行比较,发现AP-ICU患者拟杆菌属中的多氏拟杆菌显著下降。既往多项研究认为,AP患者肠道菌群中拟杆菌属水平更高,且其水平与多种炎症因子呈正相关[6,13-14]。本研究AP患者的拟杆菌属水平亦高于健康志愿者,其在AP-ICU患者中降低的原因尚不清楚。在差异菌群功能性分析中,AP-ICU患者肠道菌群的万古霉素耐药通路功能增强。抗生素耐药可增加治疗难度,影响患者预后[37],亦提示肠道菌群与AP关系密切。
本研究AP-ICU患者肠球菌属,尤其耐久肠球菌丰度显著高于AP-non-ICU患者,与AP患者高于健康志愿者的结果一致。肠球菌属、耐久肠球菌在健康志愿者、AP-non-ICU患者、AP-ICU患者中呈逐渐增加趋势,且耐久肠球菌与AP患者局部并发症、全身感染、器官衰竭、住院时间均具有相关性,提示肠球菌属不仅参与AP发病,亦可能是AP病情加重的驱动因子之一。
3.4 AP患者与AP-ICU患者识别
本研究基于差异菌群计算的POD指数识别AP患者、AP-ICU患者的AUC分别为0.996、0.743。提示肠道菌群不仅识别AP的能力极高,对重症AP患者亦具有良好的识别能力。肠道菌群有望作为早期识别AP、病情较重AP的无创性生物标志物,辅助临床决策。此外,作为预测森林算法筛选出的重要菌群标记,耐久肠球菌亦参与了AP-ICU患者的识别,进一步验证了该菌与AP的相关性,但其作用机制仍有待进一步研究。
本研究创新性:不仅比较了AP与健康人群肠道菌群的差异,且对是否转入ICU进行了亚组分析,并通过随机森林模型筛选了相关差异标记,验证了肠道菌群与AP的相关性。本研究局限性:(1)AP患者与健康志愿者在年龄、BMI方面存在显著差异,且未纳入饮食、生活习惯等因素,可能存在未被平衡的混杂因素,影响分析结果;(2)虽然文献报道,采用直肠拭子替代粪便进行AP菌群研究具有可行性[38],但理论上粪便比直肠拭子标本更有利于菌群分析。本研究以直肠拭子的方式获取粪便标本,原因在于部分AP患者肠道功能较弱,病程初期很难直接获取粪便。(3)虽然AP患者与健康志愿者以及不同严重程度AP患者之间肠道菌群存在差异,但本研究为横断面分析,无法判定肠道菌群与AP发病的因果关系。
综上所述,本研究通过16S rRNA测序及生物信息分析,比较了健康人群与AP患者的肠道菌群差异,结果显示AP患者肠道菌群大肠志贺菌、肠球菌表达增多,而布劳特氏菌与双歧杆菌表达减少。转入ICU的AP患者亦表现出类似的变化,进一步佐证了肠道菌群在AP发病和病情进展中的作用。随着研究的不断深入,肠道菌群有望成为识别重症AP的新型生物标志物。
作者贡献:韩梓莹负责数据采集与论文撰写;宋锴、范正阳、宋晓负责患者入组、数据采集;胡晓敏指导研究设计、数据分析与论文修订;吴东指导研究设计、论文修订。
利益冲突:所有作者均声明不存在利益冲突
