转录因子POU3F2特性及其在肿瘤发生发展中的研究进展
2022-09-26马东江邓成伍吕秉哲
马东江,邓成伍,魏 成,吕秉哲,王 琛
兰州大学第二医院普通外科,兰州 730000
POU3F2参与细胞发育过程的中间调节,同时还是肿瘤发生的生物学参与者,其是POU转录因子家族的一员,POU家族在胚胎发育过程中发挥核心作用。转录因子POU3F2可结合下游特定的基因序列,通过各种信号通路发挥指导效应,以影响肿瘤的发生发展。既往研究多关注POU3F2在恶性黑色素瘤(malignant melanoma,MM)中的异常表达及如何导致肿瘤表型变化,然而近几年研究发现,POU3F2亦影响其他多种恶性肿瘤的生物学行为,如神经系统肿瘤、消化系统肿瘤和乳腺肿瘤等。目前,关于POU3F2在恶性肿瘤中的作用和相关研究进展尚无系统综述,因此探讨其参与肿瘤发生发展的机制及对预后的影响,对于肿瘤防治具有重要意义。本文基于POU3F2的结构和功能,围绕其在常见恶性肿瘤中的表达调控机制进行阐述,为进一步研究其在肿瘤中的作用提供理论基础,也为恶性肿瘤的靶向治疗提供相应理论依据。
1 POU家族及Brn2结构特性
三种哺乳动物蛋白质(Pit-l、Oct-l和Oct-2)和秀丽隐杆线虫Unc-86基因产物中一段具有相似序列、长度约150~160个氨基酸长的区域被称为POU结构域,POU结构域主要包含两个氨基酸区,分别为POU同源结构域和POU特定结构域,两个氨基酸区由一段小的不保守氨基酸序列连接[1]。根据连接区的序列和POU同源结构域的氨基端主要碱性簇,POU家族成员可分为Ⅰ~Ⅵ 6类[2]。其中Ⅱ、Ⅲ和Ⅴ被称为八聚体结合因子(亦称为OCT蛋白),因其可与八聚体DNA基序[共有序列ATGC(A/T)AAT]高度亲和,结合方式包括POU同源结构域(与5′端基序有关)和POU特异结构域(与3′端基序有关)分别与标准八聚体DNA序列结合(图1),或OCT蛋白形成二聚体/高阶结构与DNA基序结合;而Ⅰ、Ⅳ和Ⅵ由于与标准八聚体基序的亲和力不高,被称为非八聚体结合因子[3]。
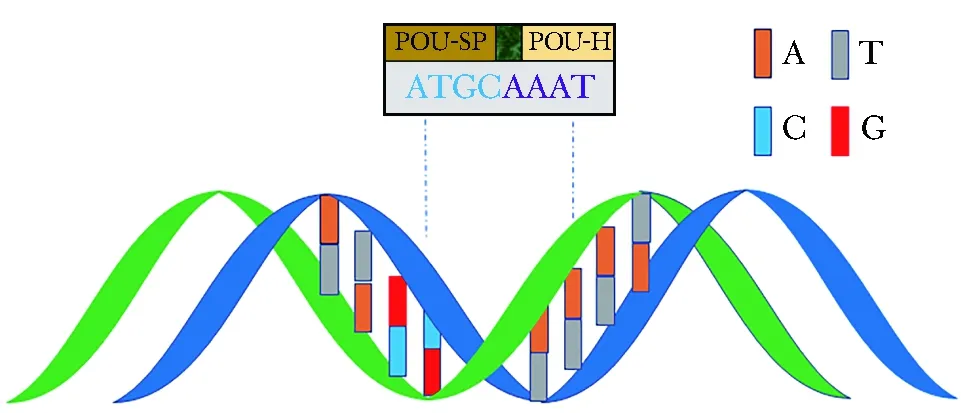
图1 OCT蛋白与八聚体DNA序列直接结合示意图
Brn2属于OCT蛋白中的Ⅲ类,由POU3F2基因编码,该基因定位于人类染色体6q16,其编码的蛋白质以二聚体的形式结合相应的八聚体DNA基序指导基因表达,还可与TATA结合蛋白(TATA binding protein,TBP)、转录辅激活因子p300、Sox-10和Pax-3转录因子(在黑色素细胞形成中起重要作用)相互作用形成转录调节复合物。Brn2对下丘脑和垂体的分化及调节发挥重要作用,其缺失可导致下丘脑的室旁核和视上核无法分化成熟的神经内分泌神经元[4-6]。Nakai等[7]研究发现,Brn2功能缺失的小鼠纯合子突变体在出生后10 d内死亡,杂合子小鼠下丘脑中加压素和催产素的表达水平是野生型小鼠的一半,表明POU3F2确实在下丘脑和垂体的发育分化中扮演重要角色。除调节神经系统的分化等功能外,POU3F2还广泛参与调节多种恶性肿瘤的发生发展。
2 POU3F2在恶性肿瘤发生发展中的作用
2.1 POU3F2与肿瘤细胞干性
POU3F2被认为在肿瘤发生过程中影响肿瘤细胞干性。胶质母细胞瘤(glioblastomas,GBMs)属于原发性中枢神经系统恶性肿瘤[8],肿瘤细胞干性增强对其侵袭能力发挥重要作用,研究发现Brn2作为GBMs干细胞相关转录因子,对于增强或维持GBMs细胞干性相当重要[9]。Brn2可与SOX2、SALL2和OLIG2构成核心神经发育转录因子(transcription factors,TFs),协同作用并激活干细胞样肿瘤增殖细胞(tumor-propagating cells,TPCs)的特异性调控元件,将分化的GBMs细胞重新编程为体内肿瘤增殖的干细胞样细胞[10]。Fujikawa等[9]发现蛋白酪氨酸磷酸酶受体Z型(protein tyrosine phosphatase receptor type Z,PTPRZ)在维持GBMs细胞干性方面发挥重要作用,靶向PTPRZ可抑制GBMs细胞的干性和致瘤性,而编码PTPRZ的基因可能是Brn2的靶点之一,由此推断Brn2维持GBMs细胞干性的机制之一是作用于其靶点基因PTPRZ。
POU3F2还可增强MM的细胞干性。具体机制如下:转录因子NFATc2上调可诱导膜结合肿瘤坏死因子-α(membrane-bound tumor necrosis factor-α,mTNF-α)表达,进而激活c-myc-POU3F2轴,促使POU3F2表达上调,从而抑制小眼症相关转录因子(microphthalmia-associated transcription factor,MITF),以促进MM细胞去分化(干细胞标志物CD271上调为特征)[11]。研究发现,敲除转录因子YB-1基因可降低乳腺癌细胞干性,YB-1基因缺失的乳腺癌干细胞在体外和体内的致瘤能力均显著降低,而4个(SOX2、Brn2、OCT-4和OLIG1)或5个(SOX2、SALL2、OCT-4、Brn2和Bmi-1)转录因子的同时表达可恢复YB-1基因敲除导致的乳腺癌干细胞干性降低[12]。
可以看出,POU3F2与肿瘤细胞干性密切相关,可通过不同机制增强肿瘤细胞干性,但具体信号通路及相关机制有待进一步研究和探索,这将有助于发现新的治疗靶点以优化恶性肿瘤的诊疗策略。
2.2 POU3F2与肿瘤神经内分泌转化
POU3F2还参与某些肿瘤的神经内分泌转化以增强肿瘤恶性程度。前列腺癌(prostate cancer,PCa)主要发生于老年男性,确诊时年龄大多为60~70岁[13],其发生依赖于雄激素受体(androgen receptor,AR),雄激素去除疗法虽可使雄激素水平降低,但AR激活依然可导致去势抵抗型前列腺癌(castration-resistant prostate cancer,CRPC)的发生,虽然恩扎卢胺等AR受体抑制剂疗法可抑制AR的激活,但很快患者会出现耐药,原因是癌细胞进一步发生了神经内分泌分化,导致发生神经内分泌前列腺癌(neuroendocrine prostate cancer,NEPC)[14],其为高抗AR受体抑制剂且为CRPC变体[15]。Bhagirath等[16]研究发现,经恩扎卢胺处理的PCa细胞外小泡释放POU3F2 mRNA和蛋白增加,且POU3F2与AR的表达与活性呈负相关,即AR可直接抑制POU3F2的释放[14],AR受体抑制剂的出现使癌细胞POU3F2表达和释放上调,以致发生神经内分泌分化,可认为Brn2是NEPC的神经内分泌驱动因子[17]。随着对POU3F2研究的深入,发现其通过驱动PCa发生神经内分泌转化,是导致AR受体抑制剂疗法的PCa患者出现耐药的主要因素之一,对POU3F2的靶向抑制可能为治疗或预防前列腺肿瘤神经内分泌分化提供一种策略。
有学者认为小细胞肺癌(small cell lung cancer,SCLC)的神经内分泌特征可能是导致肿瘤恶性的原因之一[18],SCLC细胞系中POU3F2的表达参与其神经内分泌分化[19]。Ishii等[20]研究发现,Brn2对SCLC家族特异性转录因子ASCL1和 NeuroD1,以及神经内分泌标记分子(如神经细胞黏附分子1、突触素和嗜铬粒蛋白A)的表达至关重要,当POU3F2在SCLC细胞中被敲除时,上述因子表达水平显著降低,导致肿瘤细胞生长迟缓,提示Brn2可能参与激活此类因子的转录从而影响SCLC的神经内分泌特性。此外,研究发现甲状腺转录因子(thyroid transciption factor 1,TTF1)经常在SCLC中高水平表达,随着SCLC细胞中的POU3F2被敲除,TTF1表达显著下调,原因是神经细胞谱系特异性转录因子Brn2可结合TTF1启动子并参与其在SCLC中的表达[21]。由此可见,POU3F2参与SCLC的神经内分泌分化以提高癌细胞的恶性程度,抑制POU3F2表达有望成为SCLC的潜在治疗靶点。
胰腺癌(pancreatic cancer,PC)患者往往就诊时疾病已发展至中晚期,手术切除率低,且易复发和转移[22]。研究发现,POU3F2可影响胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的神经内分泌谱系的规范性。研究表明,黏蛋白1 C-末端亚单位(mucin 1 C-terminal subunit,MUC1-C)可与MYC形成复合物以驱动家族特异性转录因子ASCL1、神经转录因子Brn2和干细胞转录因子NOTCH1/2,将干扰素信号转导和多能性与胰腺神经内分泌癌去分化整合在一起,以决定PDAC神经内分泌谱系的规范性[23]。POU3F2可能成为具有神经内分泌谱系去分化PDAC的潜在治疗靶点,但POU3F2如何影响PDAC的神经内分泌特性及作为PC潜在治疗靶标的前景仍需前瞻性研究进一步验证。
2.3 POU3F2与肿瘤侵袭和转移
POU3F2除影响肿瘤细胞干性和神经内分泌分化以增强肿瘤的侵袭性外,还可通过其他机制或信号通路影响肿瘤细胞的侵袭和转移能力。POU3F2可增强MM的侵袭能力,抑癌基因CDKN2A双等位缺失可通过激活POU3F2,促进黑色素瘤的侵袭。研究表明,人类黑色素瘤细胞中CDKN2A的编码产物p16INK4A蛋白的缺失允许转录因子E2F1直接结合POU3F2启动子以激活其转录,继而导致人MM细胞系在小鼠体内的转移扩散[24]。Fane等[25]研究发现,POU3F2过表达可导致核因子1B表达增高,而核因子1B直接增加癌基因EZH2的表达,进而促进MM细胞体外高度侵袭和迁移。研究表明,在人胃癌细胞中,POU3F2高表达介导的NADH氧化酶上调可使细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和丝氨酸/苏氨酸激酶Akt增强[26],从而促进肿瘤细胞侵袭和转移。Li等[27]通过生物信息学研究发现,Brn2为浸润性乳腺癌的风险因子之一。研究证实,整合素α3β1依赖的Akt信号通过诱导转录因子Brn2以增强三阴性乳腺癌(triple negative breast cancer,TNBC)的侵袭和转移特性[28]。由此可见,POU3F2在乳腺癌的发生发展中扮演重要角色,但Brn2影响TNBC侵袭特性的机制尚需进一步研究探索。
POU3F2以不同方式增强肿瘤细胞的侵袭能力,但最新研究表明Brn2也可作为MM细胞的抑制因子发挥作用。Hamm等[29]研究发现,在人皮肤MM细胞中,POU3F2单等位基因的经常缺失导致10 号染色体上缺失的磷酸酶和张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的杂合型缺失(Brn2表达载体共转染后可促进PTEN转录激活),以致PI3K信号转导增强(PTEN为PI3K-AKT通路抑制剂),进而诱导MM细胞的侵袭和转移;反之,Brn2二倍体时MM细胞增长显著降低,可能原因与POU3F2缺失进而降低PTEN水平促进增殖的MM细胞在早期阶段存活有关,具体机制有待进一步研究加以验证。随着对POU3F2与恶性肿瘤发生发展机制的进一步研究,其可能成为肿瘤治疗的新靶点,将为临床诊疗提供更多选择。
2.4 POU3F2与肿瘤损伤修复
Brn2在MM细胞的损伤修复中发挥重要作用。Herbert等[30]研究发现,置于环境高度损伤中的MM细胞存在细胞特异性生存机制,其原因为Brn2与DNA修复酶直接结合,进而快速结合DNA损伤位点促进DNA损伤因子Ku80的募集,以重新编程DNA损伤修复;Brn2还可抑制凋亡相关基因表达程序,且有助于产生高突变负荷的MM细胞,表明其在MM细胞的损伤修复中扮演重要角色。
3 POU3F2在恶性肿瘤的表达调控
POU3F2在不同肿瘤细胞中的表达受到不同方式的调控。Cui等[31]研究发现,在GBMs细胞中,过表达的miR-146a可靶向结合POU3F2,并抑制其表达,从而降低GBMs的细胞干性,即miR-146a-POU3F2通路可抑制GBMs的肿瘤干细胞功能,从而影响GBMs肿瘤组织的侵袭性及耐药性。作为MM的一种新型肿瘤抑制因子,miR-107过表达可结合其下游靶点POU3F2并抑制其表达,进而降低MM细胞的增殖、迁移和侵袭[32];在MM细胞中,两种信号通路可参与调节POU3F2的表达,分别为MM相关丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路和Wnt/β-联蛋白信号通路,活化BRAF下游的MAPK信号通路是POU3F2表达的关键调节因子,MAPK信号通路包括RAS-RAF-MEK-ERK级联[33],其还可通过调控Pax3以调节POU3F2的表达,但MAPK信号通路如何调节Pax3蛋白水平尚需研究进一步验证;此外,PI3K/AKT-Pax3轴亦参与调节部分MM细胞POU3F2的表达[34]。
研究发现,在胃癌细胞中辣椒素可通过抑制转录因子Brn2表达,从而下调肿瘤相关NADH氧化酶以抑制肿瘤侵袭性表型[26]。Chen等[35]发现在结直肠癌细胞中,化疗药物奥沙利铂可增强活性氧ROS的生成和p53的转录激活,二者协同作用下调POU3F2(主要通过ROS-P53-POU3F2轴),从而抑制NADH氧化酶的表达,促进癌细胞凋亡。上述研究提示,POU3F2是奥沙利铂治疗结直肠癌机制的关键基因之一,但POU3F2在结直肠癌中的作用机制仍需进一步研究探索。随着更多相关基础研究的开展,相信POU3F2与结直肠癌发生发展及预后的关系将更加清晰明确。
POU3F2在肝癌细胞中的表达也受到相应调节。有学者发现,LncRNA中脑细胞质RNA 1(LncRNA Brain Cytoplasmic RNA 1,BCYRN1)可直接作用于其靶基因miR-490-3P并抑制其表达,进而使Brn2表达增高(BCYRN1、miR490-3p和POU3F2形成一种ceRNA机制),促进肝癌细胞增殖、克隆形成、侵袭和迁移能力增强[36]。Fan等[37]研究发现,环状RNA circ_0031242可结合下游效应器miR-924并抑制其表达,POU3F2是miR-924的直接靶点,沉默circ_0031242可减少其与miR-924结合,导致miR-924过表达以下调POU3F2,从而降低顺铂的耐药,促进肝癌细胞凋亡。可以看出,POU3F2的上调和下调明显影响肝癌细胞的增殖和凋亡,表明其在肝癌的发生发展中起关键调节作用,可为肝癌的靶向治疗提供研究方向。
4 POU3F2与肿瘤患者预后
POU3F2不仅在肿瘤组织中异常表达,且与肿瘤患者预后密切相关。Ding等[36]依据 TCGA(the cancer genome atlas)数据库比较肝癌患者与正常人的POU3F2表达情况,相较于正常人(n=50),POU3F2在肝癌患者(n=375)中呈高表达,采用Kaplan-Meier法对其中370例临床资料相对完整的肝癌患者进行生存分析,发现POU3F2高表达者预后较差。然而,与Brn2作为促癌因子相反的是,有学者也通过TCGA数据库检索了人皮肤MM转移瘤(Ⅳ期)患者POU3F2的拷贝数,发现一半以上显示其单等位基因缺失,生存分析结果表明POU3F2缺失或低表达与患者的低生存率和不良预后相关[29],表明POU3F2也可作为抑癌基因影响肿瘤患者的生存和预后。
5 小结与展望
综上所述,转录因子POU3F2不仅在胚胎发育过程、中枢神经系统的分化调节中广泛表达并参与调节,还在许多恶性肿瘤细胞中广泛表达。POU3F2在GBMs、MM、NEPC等恶性肿瘤中通过不同途径促进肿瘤的发生发展,调控其生物学行为。转录因子Brn2参与调节GBMs、MM及胰腺神经内分泌癌的细胞干性,与肿瘤发展中的增殖、迁移、侵袭能力和耐药性密切相关;参与PCa、SCLC及PDAC等的神经内分泌转化,与癌细胞损伤修复密切相关。虽然POU3F2在许多恶性肿瘤中广泛参与调节,但相关基础研究仍较少,对其具体作用机制及相关信号通路的认识尚不清楚,仍需更多基础研究深入探索。
POU3F2与许多肿瘤的生物学行为及预后相关,期待未来研发POU3F2相关靶向药物,调节肿瘤细胞的生物学行为,如降低肿瘤细胞干性、抑制肿瘤神经内分泌转化和细胞损伤等,以改善肿瘤患者的预后。
作者贡献:马东江负责论文选题、文献检索、论文构思及撰写;邓成伍、魏成、吕秉哲负责文献查阅;王琛负责论文修订。
利益冲突:所有作者均声明不存在利益冲突
