尿苷胞苷激酶2调控肺腺癌发生发展的机制研究
2022-09-26王李杰杨旭辉
许 杨,刘 黎,王李杰,杨旭辉,霍 苗
1 解放军战略支援部队特色医学中心 呼吸内科,北京 100101;2 解放军总医院第一医学中心 肿瘤内科,北京 100853
肺癌是世界上病死率最高的癌症之一,肺癌患者诊断时大多处于癌症晚期,长期生存率非常低,预后极差[1-3]。肺腺癌(lung adenocarcinoma,LUAD)是肺癌中占比最大的分型。虽然近年来LUAD诊断和预后相关技术不断被报道,但其5年生存率仍只有15%左右[4-5],所以探索新的LUAD早期诊断和预后相关生物标志物十分重要。 尿苷-胞苷激酶(uridine-cytidine kinase,UCK)是嘧啶核苷酸生物合成中的一种重要的限速酶,其中UCK2发挥的催化活性最强[6]。研究在多种肿瘤中发现了UCK2过度表达,包括胰腺肿瘤、肝癌、黑色素瘤、乳腺癌等[7-10]。虽然UCK2在肺癌中的作用已有初步研究,但UCK2在LUAD发生发展中的作用及其调控机制研究未见报道。本研究旨在探索UCK2在LUAD发生发展中的作用及可能调控机制,为LUAD的诊断和治疗提供新的思路。
材料与方法
1实 验 材 料 和 分 组 人LUAD细 胞A549和Calu3、Flag-UCK2质粒由解放军总医院肿瘤医学部研究所保存。RPMI 1640培养基和胎牛血清购自赛默飞世尔公司;Flag-HRP、β-actin、UCK2、p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR抗体购自西格玛奥德里奇贸易有限公司。葡萄糖摄取比色检测试剂盒、乳酸检测试剂盒、ATP比色检测试剂盒购自博爱新开源生物科技有限公司。生长和迁移实验设置两组:对照组(转染Flag);实验组(转染Flag-UCK2)。mTOR通路的相关Western blot验证及糖摄取、ATP和乳酸测定设置四组:1)EV + DMSO组;2)UCK2 + DMSO组;3)EV + 雷帕霉素组;4)UCK2 + 雷帕霉素组。
2TCGA数据下载及分析 从癌症基因组图谱数据库(The Cancer Genome Atlas,TCGA)数据库中获取LUAD的相关数据,包括转录组数据和临床数据。利用Sangerbox中的DECenter插件对LUAD和癌旁组织进行差异分析,得到差异基因制作热图和火山图。用RStudio软件对数据进行分析,利用Survival包进行独立预后分析,P<0.05认为基因与LUAD预后有相关性。利用Survival ROC包进行基因预测准确性分析,AUC>0.7认为基因对LUAD预后预测的准确性更好。利用http://kmplot.com在线分析UCK2基因在LUAD中的总生存时间(overall survival,OS)和无病生存期(disease-free survival,DFS),P<0.05认为有意义。UCK2在LUAD的癌和癌旁表达及各分期表达利用GraphPad Prism 8分析,P<0.05认为有意义。
3细胞转染和Western blot印迹实验 A549和Calu3细胞用含10%胎牛血清和1%双抗的RPMI 1640培养基于37℃、5% CO2孵箱中培养。参照Vigofect转染试剂说明书配置转染液。6 h后更换培养基。24 h后每组收取部分细胞,加入细胞裂解液裂解后,加SDS,煮样后行凝胶电泳。分别孵育Flag抗体和β-actin抗体。发光液压片显影。
4CCK-8实验 分别将待检测的A549和Calu3细胞系的对照组和实验组细胞分别充分吹匀后,以3000/孔的细胞密度接种于96孔板,每个实验分组铺设15个孔。参照CCK-8使用说明分别在第0、1、2、3、4天检测细胞增殖活力。待测细胞加入CCK-8混合液1 h充分作用后,上机测定OD值(波长450 nm)。
5划痕试验 转染的细胞取出吹匀后铺于6孔板中,以200 µL枪头垂直在铺满细胞的培养皿上划痕,加入PBS缓冲液,去除划下的细胞,弃PBS缓冲液,加入无血清培养基。分别于0 h和24 h在显微镜下拍照、标记和记录。
6基因集富集分析(gene set enrichment analysis,GSEA) TCGA数据库中LUAD转录组数据按照UCK2表达数据分为高表达组和低表达组,用GSEA分 析 软 件 对C6:oncogenic signatures基因集进行分析,分析的基因集合排列数为1000个,表型标签为UCK2的表达水平。P<0.05和FDR-q<0.05的基因集被认为是显著富集。
7糖摄取、ATP和乳酸测定 按照葡萄糖摄取比色分析试剂盒说明书,将待测细胞弃培养基后,加入100 µL的KRPH buffer孵育40 min,添加10 mmol/L的2-脱氧-D-葡萄糖(2-DG)孵育20 min,置于85℃ 40 min,冰上5 min,加入中和液12 µL,离心后取上清,酶标仪412 nm检测OD值。按照ATP比色分析试剂盒说明书,待测细胞加入100 µL ATP assay buffer,冰 上 裂解10 min,离心。按说明书操作,最后获得待测终液。酶标仪设定为570 mm检测OD值并记录。按照乳酸分析试剂盒说明书,待测细胞加入50 µL Lactate assay buffer,冰上裂解10 min,按说明书操作,最后获得待测终液。酶标仪设定为450 nm检测并记录。
8统 计 学 方 法 统 计 分 析 使 用SPSS24.0软 件。正态分布的计量数据组间比较采用t检验或单因素方差分析,非正态分布数据比较采用秩和检验。UCK2对细胞增殖和迁移能力的影响分析采用重复测量方差分析。Kaplan-Meier法绘制生存曲线,癌旁基因预测LUAD的能力评估采用ROC曲线。P<0.05为差异有统计学意义。
结 果
1UCK2在LUAD组 织 中 的 表 达 为 了 筛 选 与LUAD生长相关的基因,将TCGA数据库LUAD样本的正常组织与肿瘤组织表达数据进行差异分析。对19 497个编码蛋白的基因进行分析,其中1 830个上调基因,2 725个下调基因(图1A)。对这些差异基因进行单因素独立预后分析,筛选了49个与预后相关的基因。结合临床数据,对这49个基因进行多因素分析,其中与肿瘤的大小、淋巴结转移、远处转移相关的基因共10个(表1)。利用受试者工作特征(receiver operating characteristic curve,ROC)曲线进一步进行筛选对LUAD预后有较好预测水平的基因,其中AUC值大于0.7的只有UCK2(表2)。
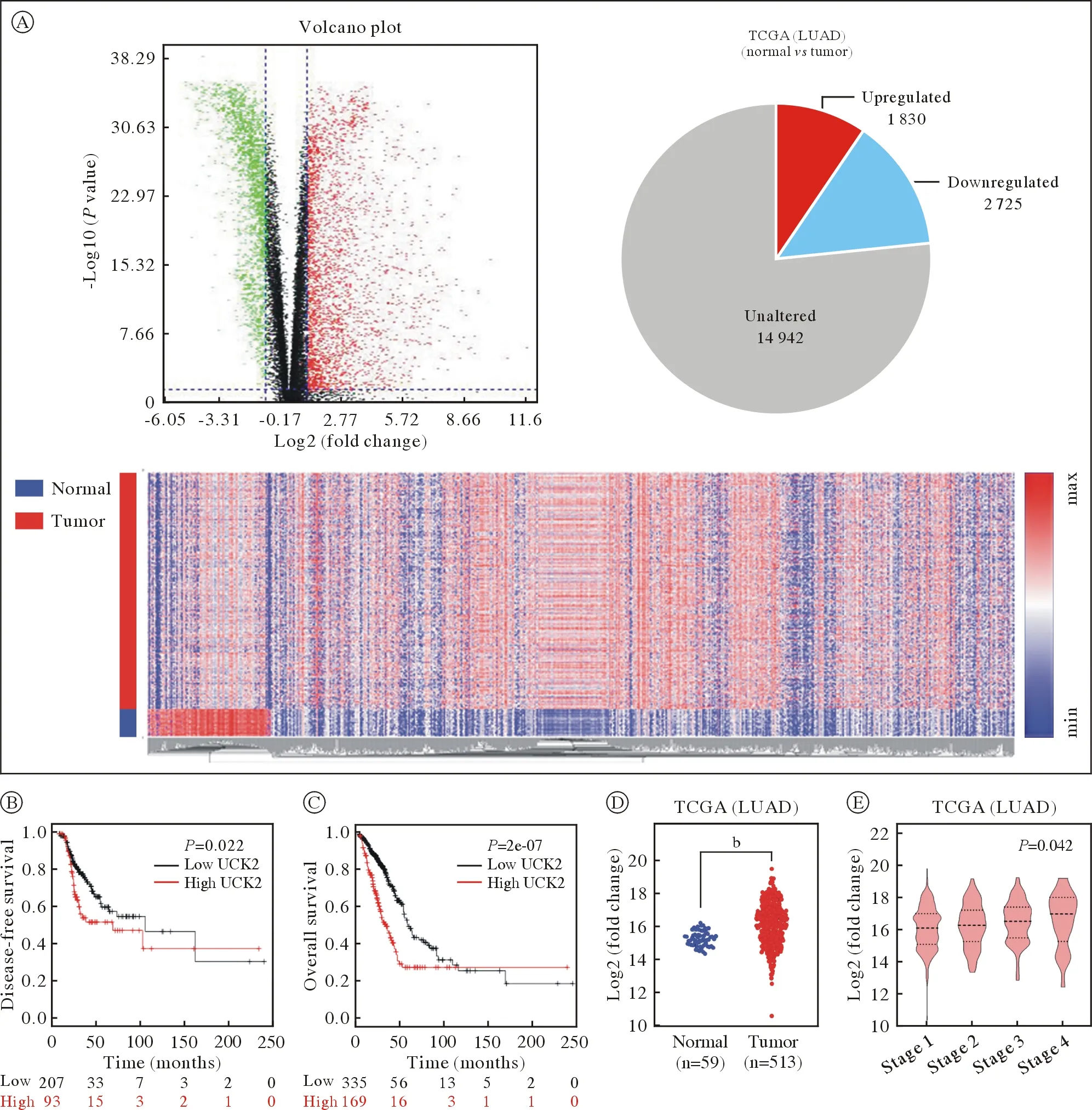
图1 UCK2促进LUAD的发展,与较差的预后呈正相关(bP<0.01)A:火山图显示正常组织与肿瘤组织之间RNA-seq分析的差异调节基因表达。上调和下调的基因分别以红色和绿色显示。饼图显示共有19 497个基因表达,其中1 830个基因上调,2 725个基因下调;B ~ C:乘积极限法(Kaplan-Meier)分析TCGA中LUAD患者的DFS和OS;D:UCK2在正常组织与肿瘤组织之间的表达差异;E:小提琴图显示了UCK2在LUAD 1 ~ 4期表达水平,并使用单因素方差分析进行比较Fig.1 UCK2 was screened out as a promoter in LUAD and positively correlated with poorer prognosis (bP<0.01)A: The volcano plot illustrating differentially regulated gene expression from RNA-seq analysis between the normal and tumor tissues.Genes upregulated and downregulated are shown in red and green, respectively. Values are presented as the log10 of tag counts. The pie chart revealed a total of 19 497 genes expressed, of which 1 830 genes were upregulated and 2 725 genes were downregulated; B, C:Kaplan–Meier estimates of disease-free survival (DFS) and overall survival (OS) of LUAD patients from TCGA; D, E: UCK2 expression scores between normal and tumor tissues, stage 1-4 were displayed in violin plot and compared using one-way Anova
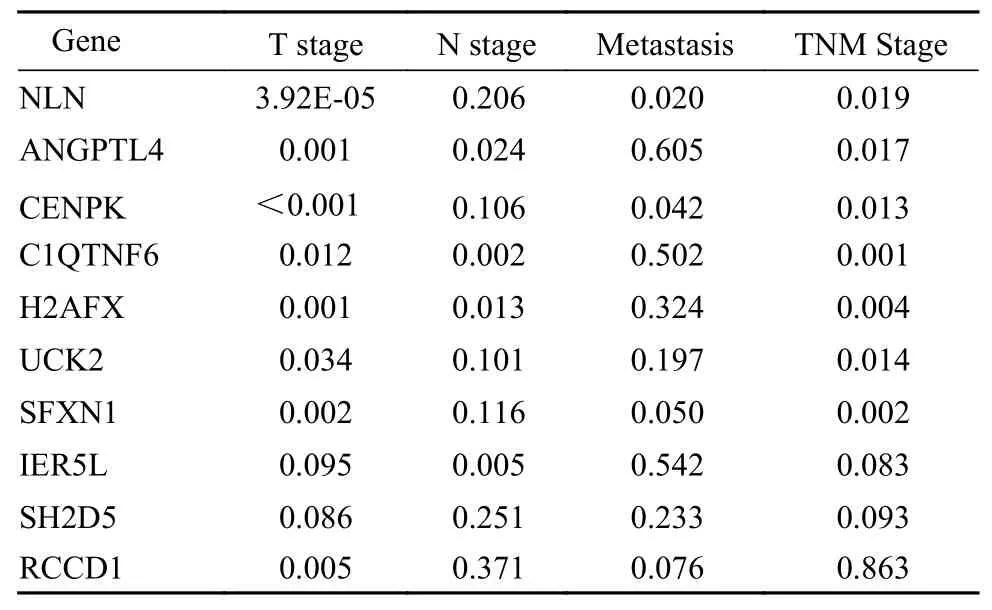
表1 LUAD癌与癌旁的差异基因与临床性状的关系(P)Tab. 1 Relationship between DEGs and clinical traits in LUAD (P)

表2 LUAD癌与癌旁差异基因的AUC值Tab. 2 AUC values of DEGs in LUAD
TCGA数据库中LUAD的相关数据分析结果显示,UCK2的高表达与不良的DFS(P=0.022)和OS(P<0.01)相关(图1B ~ 图1C)。UCK2的表达量在LUAD组织中高于癌旁组织(P<0.01;图1D),且随着分期的上升,UCK2表达水平也上调(P<0.01;图1E)。综上,UCK2可能作为一个正调控基因参与LUAD的发生发展。
2UCK2促进A549和Calu3细胞的生长 Western blot实验结果显示,在A549和Calu3细胞中转染Flag和Flag-UCK2,内参β-actin表达水平一致,转染Flag-UCK2的细胞样品在29 kU检测到特异性条带。CCK-8实验结果显示,与Flag组相比,A549细胞中Flag-UCK2组从第2天起增殖能力显著增加(t=3.733、5.856、7.421,P=0.02、0.004、0.002,n=3;图2A),Calu3细胞系中,Flag-UCK2组从第3天起增殖能力显著增加(t=4.788、9.941,P=0.009、0.001,n=3;图2B)。
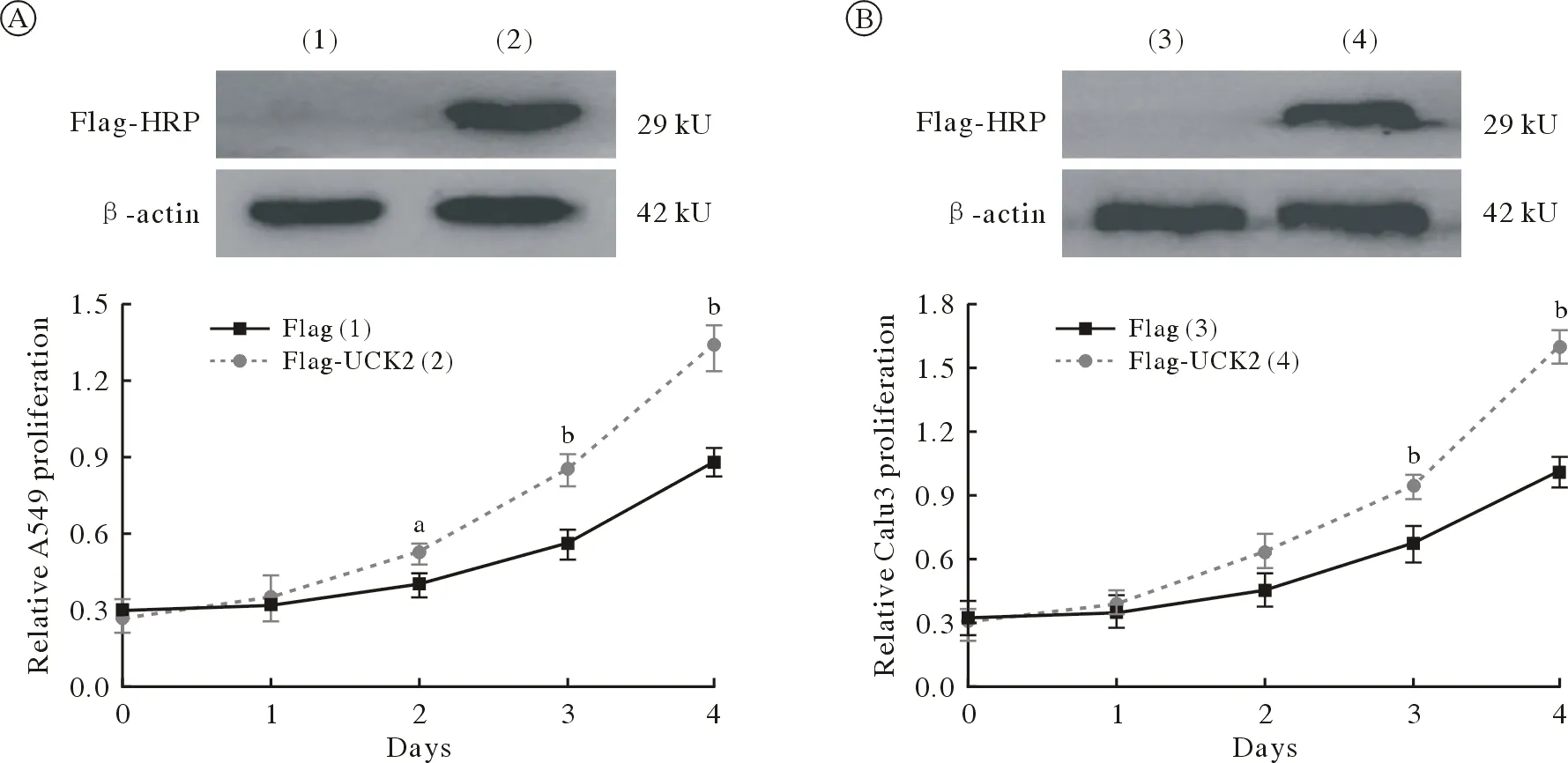
图2 UCK2促进A549(A)和Calu3(B)细胞的生长能力[aP<0.05, bP<0.01, vs Flag (1)组]Fig.2 UCK2 promotes the growth of A549 (A) and Calu3 (B) cells (aP<0.05, bP<0.01, vs Flag [1] group)
3UCK2促进A549和Calu3细胞的迁移能力和Flag组比,Flag-UCK2组的A549细胞24 h迁移能力明显增加(t=8.947,P=0.001,n=3;图3A)。同样,Calu3细胞系中,Flag-UCK2组24 h迁移能力亦明显增加(t=20.102,P<0.001,n=3;图3B)。以上结果表明,UCK2对A549和Calu3细胞的迁移能力正向调控。
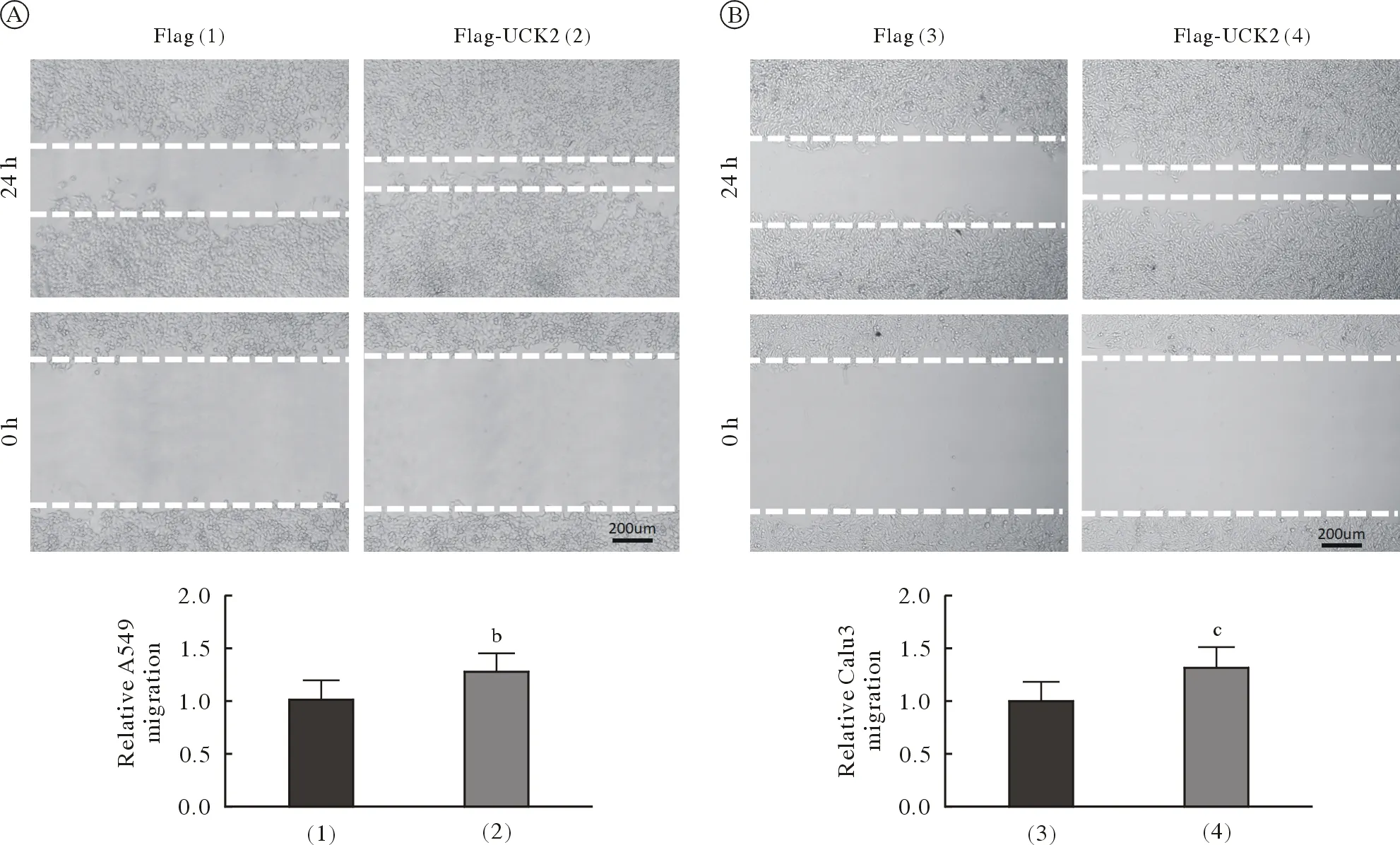
图3 UCK2促进A549(A)和Calu3(B)细胞的迁移能力[bP<0.01, cP<0.001, vs Flag (1)组]Fig.3 UCK2 promotes the migration of A549 (A) and Calu3 (B) cells (bP<0.01, cP<0.001, vs Flag [1] group)
4UCK2在LUAD中正向调控mTOR通路 为进一步深入研究UCK2的分子调控机制,利用GSEA分析发现,低表达的UCK2与LUAD良好预后相关(P<0.001;图4A),高表达的UCK2与mTOR上调基因集呈正相关(P=0.002;图4B),低表达的UCK2与mTOR下调基因集呈正相关(P=0.004;图4C)。这些结果提示在LUAD中UCK2与mTOR通路关系密切。
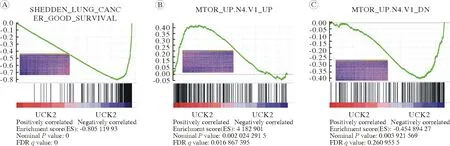
图4 UCK2在LUAD中正向调控mTOR通路A:GSEA分析显示UCK2的低表达与LUAD患者的良好预后相关;B、C:UCK2表达与LUAD数据集中的mTOR通路呈正相关Fig.4 UCK2 positively regulates mTOR pathway in human lung adenocarcinoma A: GSEA plot showed that low expression of UCK2 was associated with good prognosis in LUAD patients; B, C: UCK2 expression was positively correlated with mTOR signaling in the LUAD dataset
5UCK2促进A549细胞中mTOR通路的激活为了研究UCK2与mTOR通路的关系,我们使用了mTOR通路特异性抑制剂—雷帕霉素来进一步验 证。Western blot实 验 证 明,UCK2过 表 达 组(2)与EV + DMSO组(1)比较,mTOR通路中的关键蛋白p-PI3K(P<0.001)、p-AKT(P<0.001)、pmTOR(P<0.001)上调。雷帕霉素组(3)降低了这些蛋白的表达(P<0.001),而UCK2 + 雷帕霉素组(4)显示,UCK2对mTOR通路中关键蛋白的上调作用被逆转(P<0.001)。以上结果证明UCK2正调控LUAD中mTOR通路(图5)。

图5 UCK2促进A549细胞中mTOR通路的激活[cP<0.001, vs EV + DMSO (1)组]Fig.5 UCK2 activates the mTOR pathway in A549 cells (cP<0.001, vs EV + DMSO [1] group)
6UCK2促进A549细胞中糖摄取、乳酸和ATP Warburg效应是肿瘤细胞的生长重要的现象,我们通过测定LUAD细胞的糖摄取、乳酸和ATP,以验证UCK2对LUAD细胞的生长调控作用。结果显示与EV + DMSO组(1)比较,过表达UCK2组(2)的糖摄取(P<0.001)、乳酸(P<0.001)和ATP(P=0.004)均上调,这与前期UCK2促进肿瘤细胞生长的结果一致。雷帕霉素组(3)降低了糖摄取(P<0.001)、乳酸(P<0.001)和ATP(P= 0.003)水平,UCK2 + 雷帕霉素组(4)结果显示,雷帕霉素逆转了UCK2对糖摄取(P<0.001)、乳酸(P<0.001)和ATP(P<0.001)的上调作用(图6A ~ 图6C)。
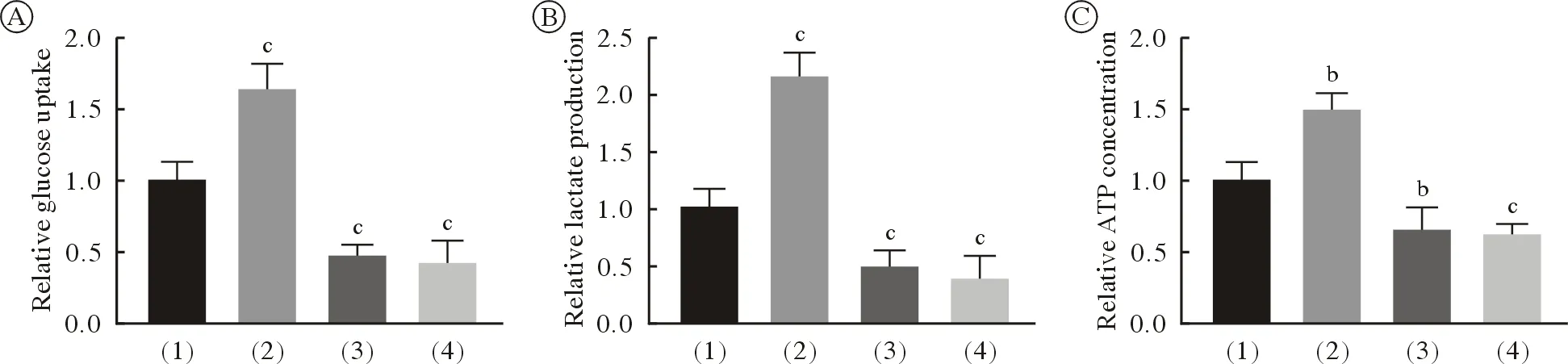
图6 UCK2促进A549细胞中糖摄取、乳酸和ATP [bP<0.01, cP<0.001, vs EV + DMSO (1)组]Fig.6 UCK2 activates the mTOR pathway in A549 cells (bP<0.01, cP<0.001, vs EV + DMSO [1] group)
讨 论
LUAD在非小细胞肺癌中是最常见的组织学亚型,尽管外科手术、放化疗、靶向治疗及免疫治疗近年来取得了一定进展,但患者的存活率仍不高。新治疗靶点的寻找和机制研究仍是LUAD的研究重点。
UCK在核苷类似物的磷酸化中发挥着重要作用。UCK2 催化尿苷和胞苷核苷酸的磷酸化。同时还催化某些细胞毒性核糖核苷类似物的磷酸化[11]。以往的研究表明UCK2在多种肿瘤中过度表达,其表达水平对于肿瘤发生发展具有一定的预测价值。然而,UCK2在LUAD中的作用尚不清楚。本研究中,我们通过对TCGA数据库中LUAD的相关数据进行分析发现,UCK2是LUAD癌和癌旁的差异基因,并且对LUAD患者的DFS和OS具有良好的预测特性。我们进一步发现分期较晚患者的样本中UCK2表达水平更高。我们在A549和Calu3两种LUAD细胞中进行了细胞增殖和划痕实验,结果证实过表达UCK2明显增加LUAD细胞的增殖和迁移能力。这些结果提示UCK2在调节LUAD的生长和进展中可能发挥着促癌作用。UCK2可能是LUAD的生物标志物和潜在治疗靶点。
mTOR信号通路在肿瘤发展过程中起着重要作用[12-14]。该通路的激活与肿瘤的发生、进展及转归密切相关。mTOR通路抑制剂不断地被开发应用于肿瘤的治疗中[15-18]。而且,mTOR通路抑制剂对于改善免疫治疗相关不良事件也发挥了重要作用[19-20]。在本研究中,我们首先利用TCGA数据库中LUAD的RNA-seq数据进行GSEA富集分析,发现UCK2与mTOR通路密切相关。在细胞水平,与空白组比较,过表达UCK2组p-PI3K、p-AKT、p-mTOR均显著上调。表明过表达UCK2可能通过上调PI3K/AKT/mTOR信号通路促进A549细胞增殖和迁移。为了验证这一结果,我们设置了mTOR通路的抑制剂—雷帕霉素进行干预。结果表明,雷帕霉素组降低了p-PI3K、p-AKT、p-mTOR蛋白的表达,而UCK2和雷帕霉素共同干预组结果表明,UCK2对mTOR通路中关键蛋白的上调作用被雷帕霉素逆转。糖摄取、乳酸和ATP测定也得到了同样的结果。再次证明过表达UCK2可能通过激活PI3K/AKT/mTOR信号通路促进LUAD的生长和侵袭。
综上所述,我们的研究结果表明过表达UCK2在LUAD生长和迁移中发挥重要作用,这可能是通过激活mTOR通路来实现的。UCK2在LUAD中的具体作用机制值得进一步深入研究。
