甲状腺结节超声恶性危险分层中国指南(C-TIRADS)对甲状腺乳头状癌的诊断价值
2022-09-26吴秀艳蔡雪珍陈潇洁赵大威廖瑞真刘舜辉
田 猛,吴秀艳,蔡雪珍,陈潇洁,赵大威,廖瑞真,刘舜辉
1 联勤保障部队第九〇九医院(厦门大学附属东南医院) 超声诊断科,福建漳州 363000;2 重庆三博长安医院 神经外科,重庆 400023
由于超声检查的普及和其他影像检查手段的增加,甲状腺癌越来越容易被检出,其发病率也呈逐年上升趋势。2020年全球癌症统计数据显示,甲状腺癌在全球范围内发病约58.6万例,发病率排名第9位,其中占比最高的是甲状腺乳头状癌(papillary carcinoma of thyroid,PTC)[1]。王冰等[2]统计了2014 - 2019年共9 662例甲状腺癌的流行病学特征,发现甲状腺癌发病例数呈逐年上升趋势,尤其是2017 - 2019年的增速明显高于前3年,且甲状腺乳头状癌是最常见的病理类型(占98.5%)。因此,对甲状腺癌,尤其是甲状腺乳头状癌的准确诊断一直是临床医生关注的重点。甲状腺影像报告和数据系统(thyroid imaging reporting and data system,TI-RADS)被用于甲状腺超声检查诊断报告,现已有多个国家制定了自己的规范,仅国内各医院使用的TI-RADS分类就多达10余种[3]。分类方法的不统一给甲状腺超声报告的解读带来了很多困难,也对甲状腺恶性结节的诊治非常不利。为改变这一现状,中华医学会超声医学分会浅表器官和血管学组专家委员会于2020年制定了更符合我国实际的《2020甲状腺结节超声恶性危险分层的中国指南:C-TIRADS》[4]。由于该指南是我国的最新版本,目前尚少见相关的研究报道。本研究以病理结果为金标准,通过用CTIRADS分类对病理诊断为甲状腺乳头状癌的结节进行分类,并与甲状腺良性结节(benign thyroid nodule,BTN)进行对照,探讨C-TIRADS分类指南对甲状腺乳头状癌的诊断价值,为该指南在临床的推广和应用提供依据。
资料与方法
1资料 选择2017年1月 - 2021年6月于联勤
保障部队第九〇九医院行手术切除的甲状腺良性结节和乳头状癌患者共450例(共609个结节)。纳入标准:1)行甲状腺结节手术切除治疗并具备详细的术后病理资料;2)术前的甲状腺超声检查资料完整。排除标准:1)既往有甲状腺手术病史;2)甲状腺术前超声图像质量不佳。
2样本量估算 根据最近预研究结果,得知CTIRADS敏感度为92.7%、特异性为71.2%[5]。设第一类错误的概率α=0.05,Zα/2=1.96,根据敏感度计算样本量时V=敏感度 × (1-敏感度),根据特异性计算样本量时V=特异性 × (1-特异性),根据最近预研究得到的敏感度和特异性,设定研究精度d=0.08,通过诊断试验的样本量估算公式n=
3甲状腺结节声像图判定 声像图判定: 图像由GE Logiq E9、Philips EPIQ7彩色多普勒超声诊断仪(线阵探头ML6-15、L12-5,频率9 ~ 15 MHz)采集。由2名具有10年以上临床经验的超声医师共同学习C-TIRADS分类指南并统一分类标准,按照C-TIRADS分类指南对入选的甲状腺结节声像图特征(包括结构、边缘、方位、回声、局灶性强回声)进行独立分析并分类。遇到分类结果不一致时,由1名具有20年以上超声检查经验的上级医师会诊并确定最终分类结果。以上3名医师均不知晓入选甲状腺结节的临床资料和病理结果。分类标准:1个阴性指标(良性征象),点状强回声伴彗星尾伪像赋予-1分;5个阳性指标(恶性征象),实性、垂直位、极低回声、点状强回声(可疑微钙化)、边缘模糊/不规则或甲状腺外侵犯各赋予+1分;计数甲状腺结节的良恶性征象并进行累计积分,用总分值来确定该甲状腺结节的类别[4]。见表1。
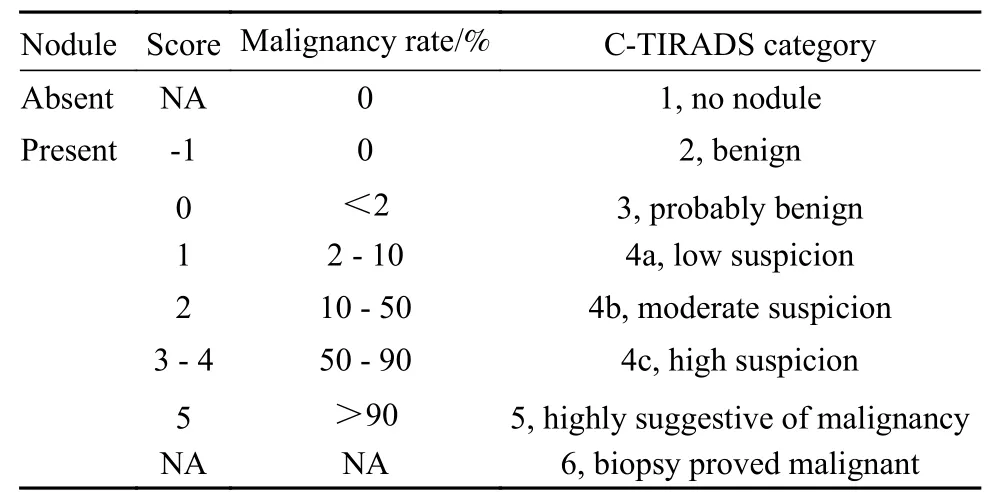
表1 基于计数法的C-TIRADS分类一览Tab. 1 Classification criteria and malignancy rate of C-TIRADS
4分析指标 1)两组声像图特征比较:分析有明确病理结果的甲状腺结节声像图特征,单侧叶有多个结节时,分析最大者。主要指标:结构(囊性、囊实性、实性);边缘(光整、模糊/不规则或甲状腺外侵犯);方位(垂直位、水平位);回声(无回声、极低回声、低回声、中等回声、高回声);局灶性强回声(无局灶性强回声、粗钙化、微钙化、彗星尾伪像)。2)分类与病理的符合率:对两组的分类结果与病理结果进行对照,比较两组的分类结果,并对比PTC组与C-TIRADS分类的指南恶性率。3)诊断效能评价:建立ROC曲线,计算曲线下面积,得出诊断的最佳截断值,并计算其敏感度、特异性和准确性。
5统计学分析 采用SPSS22.0统计学软件进行统计分析。计数资料以例数(百分比)表示,进行χ2检验。计量资料先进行Shapiro-Wilk正态分布检验,正态分布计量资料以±s表示,非正态分布计量资料以Md(IQR)表示,符合正态分布的组间比较采用成组t检验,不符合正态分布的计量资料组间比较用两个独立样本比较的Mann-WhitneyU秩检验;以病理结果为金标准计算C-TIRADS各分类的恶性率,构建ROC曲线,得出曲线下面积和最佳截断值,并计算敏感度、特异性、准确性和Youden指数。P<0.05为差异有统计学意义。
结 果
1一般资料 纳入研究的450例患者分为甲状腺良性结节组和乳头状癌组。其中,BTN组患者225例(共333个结节),男性69例,女性156例,女性∶男性约为2.26∶1.00;年龄16 ~ 77岁,中位年龄50(IQR: 44 ~ 58)岁;PTC组患者225例(共276个结节),男性49例,女性176例,女性∶男性约为3.59∶1.00,年龄16 ~ 77岁,中位年龄46(IQR: 36 ~ 54)岁。两组患者的一般资料比较见表2。PTC组女性患者比例明显高于BTN组[78.22%(176/225)vs69.33%(156/225)];PTC组的患病年龄明显小于BTN组[Md(IQR):46(36 ~54)岁vs50(44 ~ 58)岁],且PTC的发病年龄以30 ~ 59岁最多见;PTC组结节单发的比例明显高于BTN组[60.44%(136/225)vs39.11%(88/225)];两组患者结节出现的部位差异明显;BTN多见于双侧[45.78%(103/225)],PTC多见于右侧[46.67%(105/225)]。以上差异经检验均有统计学意义(P<0.05)。
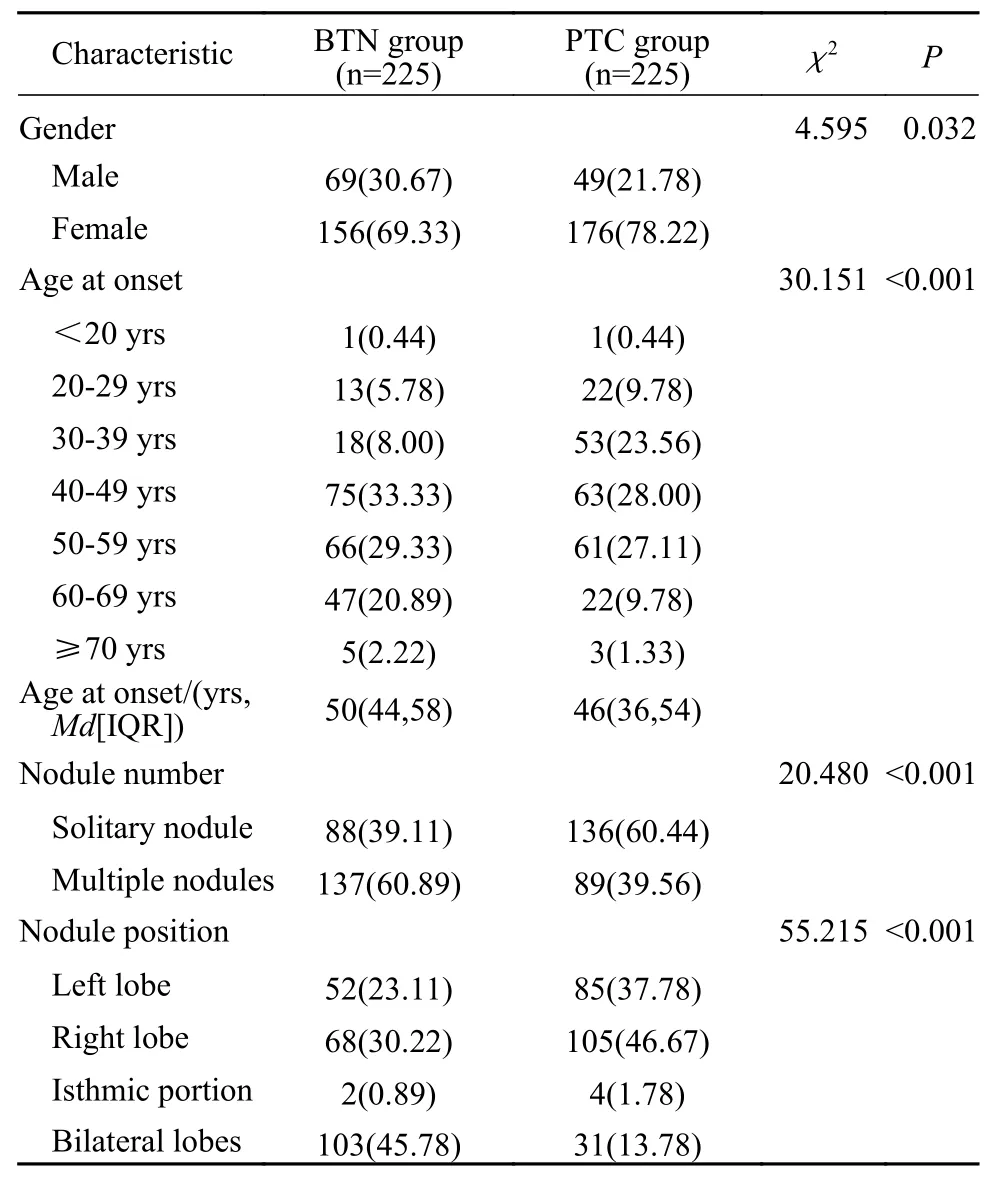
表2 两组甲状腺手术患者一般资料比较(n, %)Tab. 2 Comparison of general data of patients undergoing thyroid surgery between the two groups (n, %)
2两组患者甲状腺结节声像图特征比较 甲状腺良性结节多为囊性、囊实性结构,边缘光整,水平位,多呈低或中等回声,多无局灶性强回声,当囊性结节内出现局灶性强回声伴彗星尾伪像时提示良性(图1A、图1B、图1C);而甲状腺乳头状癌的结节多为实性结构,边缘模糊、不规则或向甲状腺外侵犯、垂直位、极低回声、微钙化多提示恶性(图1E、图1F、图1G、图1H);当囊实性结节出现阳性指标时也可能提示恶性(图1D)。PTC组出现实性、模糊/不规则或甲状腺外侵犯、垂直位、极低回声、微钙化声像图征象的比例显著高于BTN组;而彗星尾伪像均见于BTN组;以上差异均有统计学意义(P<0.05),见表3。对两组的实性结构、边缘模糊/不规则或甲状腺外侵犯、垂直位、极低回声和微钙化5个阳性指标病例数的比例进行组间比较,发现PTC组分别为BTN组的2.66倍、7.67倍、19.15倍、14.50倍和10.33倍,PTC组垂直位的比例最高、实性结构的比例最低。
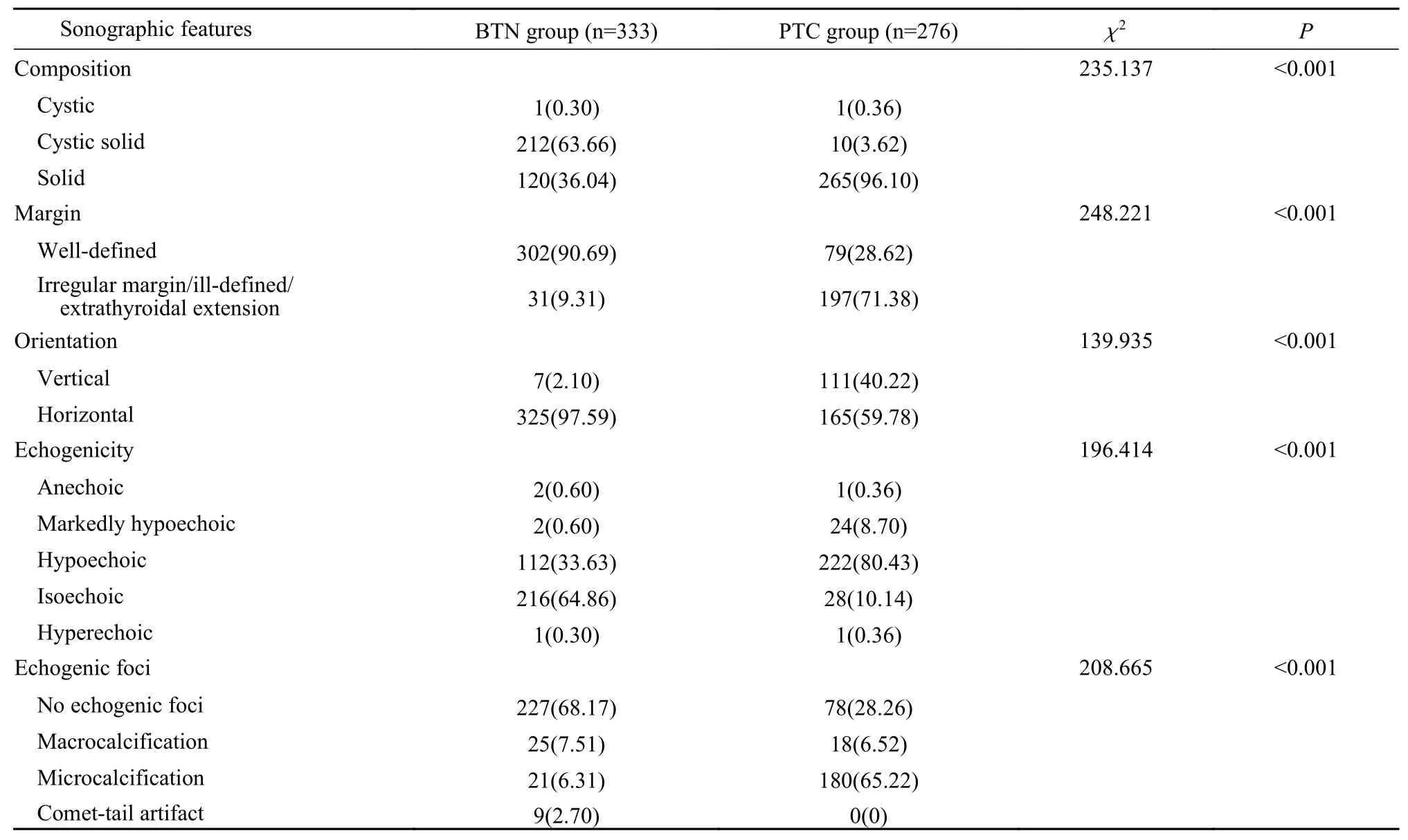
表3 两组甲状腺结节声像图特征比较(n, %)Tab. 3 Comparison of sonographic features of thyroid nodules between the two groups (n, %)
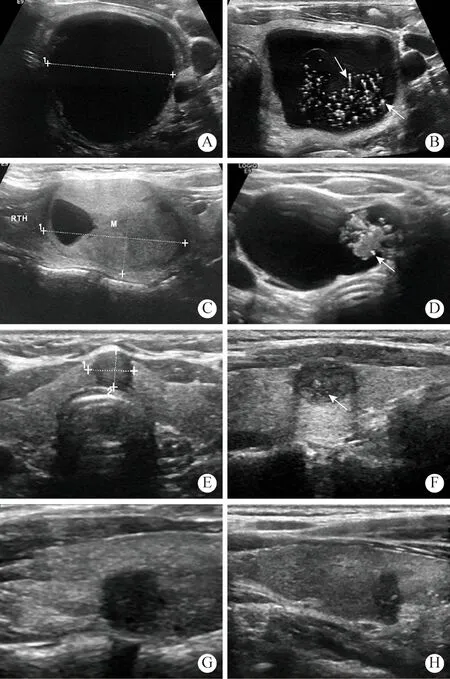
图1 甲状腺良恶性结节声像图特征A:囊性结节,边缘清晰、规则,内部为无回声,分类为CTIRADS 3,病理为结节性甲状腺肿;B:囊性结节,边缘清晰、规则,内部见点状强回声伴“彗星尾”征(箭头),分类为CTIRADS 2,病理结节性甲状腺肿;C:囊实性结节,边缘清晰、规则,内部呈囊实性回声,分类为C-TIRADS 3,病理为结节性甲状腺肿;D:囊实性结节,边缘清楚,实性部分见点状强回声(箭头),分类为C-TIRADS 4a,病理为甲状腺乳头状癌;E:实性结节,边缘不规则、毛刺,内部呈低回声,分类为C-TIRADS 4b,病理为甲状腺乳头状癌;F:实性结节,边缘不规则,内部呈低回声、可见点状强回声(箭头),分类为CTIRADS 4c,病理为甲状腺乳头状癌;G:实性结节,边缘模糊、不规则,垂直位,内部呈极低回声,分类为C-TIRADS 4c,病理为甲状腺乳头状癌;H:实性结节,边缘模糊、不规则,垂直位、内部呈极低回声、可见点状强回声(箭头),分类为CTIRADS 5,病理为甲状腺乳头状癌Fig.1 Sonographic features of benign and malignant thyroid nodules A: Cystic nodule with clear and regular margin and no echo inside, classified as C-TIRADS 3, and definitely diagnosed as nodular goiter; B: Cystic nodule with clear and regular margin,punctate echogenic foci with Comet-tail artifacts (arrow), CTIRADS 2, nodular goiter; C: Cystic solid nodule with clear and regular margin, and the internal part is cystic solid echo,C-TIRADS 3, nodular goiter; D: Cystic solid nodule with clear margin, and the solid part has high-echo dots (arrow), CTIRADS 4a, papillary thyroid carcinoma; E: Solid nodule with irregular edges and burrs, and the internal part is hypoechoic, C-TIRADS 4b, papillary thyroid carcinoma; F: Solid nodule with irregular edges, and the internal part is hypoechoic with high-echo dots, C-TIRADS 4c, papillary thyroid carcinoma;G: Solid nodule with irregular edges, it showed vertical orientation and markedly hypoechoic, C-TIRADS 4c, papillary thyroid carcinoma; H: Solid nodule with irregular edges, it showed vertical orientation and markedly hypoechoic with high-echo dots, C-TIRADS 5, papillary thyroid carcinoma
3两 组 甲 状 腺 结 节C-TIRADS分 类 比 较 CTIRADS 4b类、C-TIRADS 4c类 和C-TIRADS 5类的实际恶性率与指南基本相符,而C-TIRADS 3类和C-TIRADS 4a类的实际恶性率略高于指南推荐的恶性率。PTC组4a、4b、4c和5类的占比明显高于BTN组,而2、3类的占比明显低于BTN组(P<0.05)。见表4。
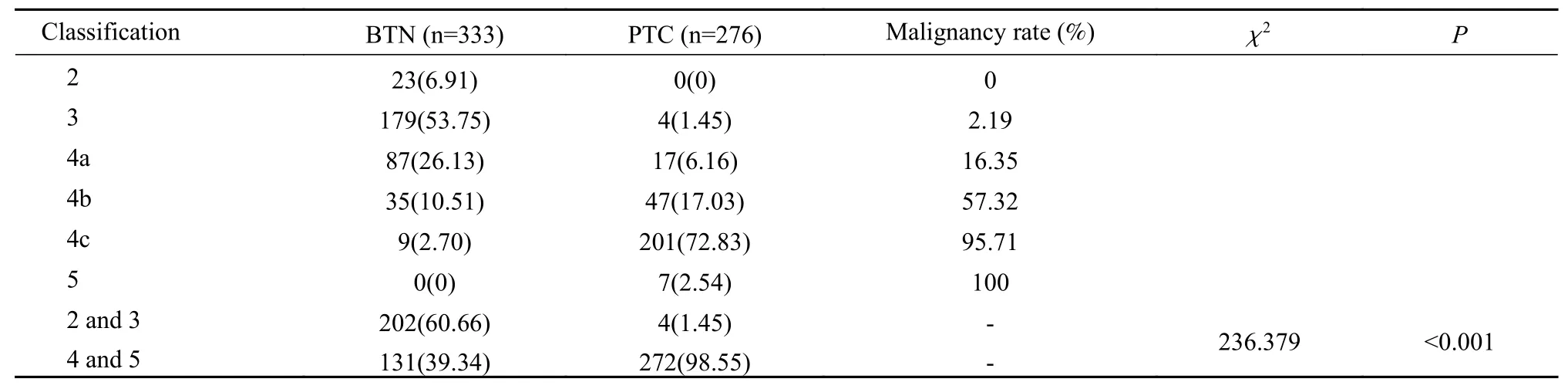
表4 两组甲状腺结节C-TIRADS分类结果(n, %)Tab. 4 C-TIRADS classification results of thyroid nodules in the two groups (n, %)
4C-TIRADS分类对甲状腺乳头状癌的诊断效能进一步探讨C-TIRADS分类对甲状腺乳头状癌的诊断效能:以乳头状癌组(PTC,n=276)为阳性样本,以甲状腺良性结节组(BTN,n=333)为阴性样本, 建立ROC诊断评估模型。C-TIRADS分类资料为6个组段数据(2、3、4a、4b、4c、5),以软件绘制ROC曲线读取约登指数最大值点,对应计算理论阈值和各项参数。并按实测样本计算敏感度、特异性、准确性。ROC分析结果显示,CTIRADS分类的曲线下面积AUC(0.95CI)为0.937(0.926 ~ 0.949)。分别以4a、4b、4c和5类为良恶性分界点时,Youden指数分别为0.59、0.79、0.73、0.03,对应C-TIRADS的最佳截断值为4b类,其敏感度、特异性、准确性分别为0.924(255/276)、0.868(289/333)、0.893(544/609)。见表5、图2。

图2 C-TIRADS分类诊断甲状腺乳头状癌的ROC曲线Fig.2 ROC curve of C-TIRADS classification for PTC

表5 C-TIRADS分类对甲状腺乳头状癌诊断效能的ROC分析结果Tab. 5 ROC analysis results of diagnostic efficacy of C-TIRADS classification for thyroid papillary carcinoma
讨 论
甲状腺癌主要包括乳头状癌、滤泡状癌、髓样癌和未分化癌四种病理类型,其中以乳头状癌最为多见[2]。研究表明,甲状腺癌的发病率与性别、年龄、地区(城乡)等因素密切相关,女性患者约为男性的3倍,30 ~ 60岁的人群高发,城市地区发病率约为农村地区的2.57倍[7]。最近的研究结果显示,肥胖与甲状腺乳头状癌风险呈显著正相关,体质量指数与肿瘤大小、多灶性肿瘤显著相关[8]。本研究结果与文献报道的结果类似,甲状腺乳头状癌女性患者数量约为男性的3.59倍,30 ~ 59岁年龄段的患者最多,且发病年龄明显小于甲状腺良性结节患者。
本研究发现甲状腺乳头状癌多为单发病灶,且多见于甲状腺右侧叶;而甲状腺良性结节以多发病灶居多、多见于双侧叶。尽管甲状腺癌以单发病灶多见,但近年来多灶癌的占比也在上升,且多灶癌更易发生颈部淋巴结转移[2],多灶癌比例上升可能与目前人群肥胖率上升有关[8-9]。
超声检查具有方便、经济、安全的优点,目前已成为甲状腺结节的首选影像学检查方法。甲状腺乳头状癌在结构、边缘、方位、回声、局灶性强回声等方面明显区别于甲状腺良性结节的声像图特征,被超声准确诊断的概率较高。本研究中,PTC组出现实性结构、边缘模糊/不规则或甲状腺外侵犯、垂直位、极低回声、微钙化声像图征象的比例显著高于BTN组,而彗星尾伪像均见于BTN组。这说明甲状腺乳头状癌与甲状腺良性结节在C-TIRADS分类指南规定的5个阳性指标和1个阴性指标上有明显的差异。
对两组的实性结构、边缘模糊/不规则或甲状腺外侵犯、垂直位、极低回声和微钙化5个阳性指标病例数的比例进行组间比较发现,PTC组分别为BTN组的2.66倍、7.67倍、19.15倍、14.50倍和10.33倍,说明5个阳性指标对PTC都具有一定的特异性,以垂直位的特异性最高。相对于以往指南把低回声也作为一个阳性指标[10],极低回声的特异性更高,前者在PTC组内的比例仅 为BTN组 的2.39倍(80.43%vs33.63%)。在5个阳性指标中,实性结构的特异性最低,但其在组内的比例高达96.01%,具有很高的敏感度。而局灶性强回声后伴彗星尾伪像这个阴性指标在BTN组内的占比为2.70%,但在PTC组内的比例为0,同样也是具有很高的特异性。由此可见,与以往分类方法相比,C-TIRADS分类的阳性指标舍弃了低回声,但保留了实性结构和极低回声,很大程度上提高了特异性且保证了敏感度,有助于降低误诊率,更利于减少过度诊疗,减轻患者的心理压力,最近的研究结果也证实了这一点[11]。
在对甲状腺结节分类上,由于本研究选取的均为甲状腺结节术后且既往无甲状腺手术病史的病例,故无C-TIRADS 1类和C-TIRADS 6类。另外,C-TIRADS 3类和C-TIRADS 4a类的实际恶性率略高于指南推荐的恶性率,这可能是因为本研究选取的良性病例数偏少,导致恶性病例数和结节数占比较高所致。本研究发现,PTC组和BTN组的甲状腺结节C-TIRADS分类存在明显差异。PTC组4a、4b、4c和5类的比例明显高于BTN组,而2、3类的比例明显低于BTN组。CTIRADS分类的ROC曲线下面积为0.937,Youden指数最大值对应的最佳截断值为4b类,其敏感度、特异性、准确性分别为0.924、0.868、0.893,与目前常用的Kwak TIRADS、ACR TIRADS、ATA风险分层相比,C-TIRADS的诊断效能更优,敏感度和特异性也更高[12-14]。值得一提的是,CTIRADS分类指南首次提出了甲状腺结节超声成像质量控制,全面规范了检查中的参数调节和扫查方法[15],有助于在一定程度上降低成像不一致导致的甲状腺结节分类误差。
C-TIRADS分类指南也存在不足之处。该指南把囊实性界定为良性征象,但有13% ~ 26%囊实性改变出现在甲状腺癌中[16],容易导致漏诊、误诊。对于这类囊实性甲状腺癌,联合应用超声造影检查有助于提高其诊断准确率[17-18]。另外,对于部分体积较小的结节,尤其是最大径<1 cm的甲状腺结节,常规超声难以鉴别其良恶性时,超声造影的联合应用可提高其诊断准确性[19]。
本研究的局限:1)回顾性研究,收集的图像质量不一致,可能会使结节分析出现误差;2)纳入研究的病例来自单中心,样本量代表性不够。
总之,C-TIRADS分类对甲状腺乳头状癌有较高的诊断效能,且该方法对阴性指标和阳性指标的定义更明确,操作更简便,受超声医师的临床经验影响更小[20]。在临床实践中有很高的应用价值,尤其是对于没有开展甲状腺结节细针穿刺活检的医疗机构和临床经验不是很丰富的基层医疗机构,该指南的分类结果对甲状腺结节良恶性的鉴别和决定是否手术都具有较高的参考价值。
