‘灿烂’蓝莓的组培快繁技术
2022-09-24李子杰曹受金
李子杰,曹受金,周 围
(中南林业科技大学 林学院,湖南 长沙 410004)
蓝莓Vaccinium spp.是杜鹃花科Ericaceae 越橘属Vaccinium的多年生落叶灌木[1]。蓝莓果实中含有花青素、黄酮等物质,具有抗溃疡、增强心脏功能及抗衰老等多种生理功能,同时是一种经济价值非常高的新兴水果,国际粮农组织将其列为人类五大健康食品之一[2]。蓝莓春季观花、夏季观果,还可制作果树盆景[3]。蓝莓‘灿烂’属兔眼蓝莓品种,果实品质佳,口感好,耐储藏,深受人们青睐,该品种适合我国南方地区种植,特别适合鲜果销售或观光采摘[4]。
组织培养是蓝莓扩大繁殖系数的重要方法,目前有关兔眼蓝莓组织培养研究较多,如很多学者总结了外植体褐化[5-6]、诱导增殖[7]、试管苗生根[8]及移栽驯化等[9]。不同消毒方式对蓝莓外植体污染及褐化影响较大。以兔眼蓝莓的茎段为外植体,先用1.5%抗坏血酸浸泡外植体30 min,再用70%~75%酒精消毒15~30 s 及0.1%氯化汞消毒8~10 min,外植体污染率及褐化率低,成活率高[10]。在培养基中添加抗氧化剂及增加琼脂质量浓度(10~15 g·L-1),或加入200 mg·L-1Vc液且活性炭含量为200~500 mg·L-1时,能有效防止愈伤组织褐化发生[11]。不同的生长调节剂对兔眼蓝莓腋芽诱导效果影响较大,使用ZT 的效果要好于2iP 或6-BA 等[12],但ZT 使用质量浓度过高会导致丛芽节间短、长势弱且部分玻璃化[13]。因此,如何提高兔眼蓝莓的诱导率,同时又能保持较好的生长势一直是亟待解决的关键问题之一。兔眼蓝莓组培苗生根相对困难,王大平[14]报道兔眼蓝莓‘园蓝’采用1/2 WPS 基本培养基添加0.5 mg·L-1IBA 和0.3%活性炭,瓶内生根率达78.7%,而兔眼蓝莓‘粉蓝’瓶内生根率仅为63.3%[11],兔眼蓝莓品种较多,不同基因型瓶内生根对培养基和生长调节剂的种类及质量浓度要求均不同[15]。生根组培苗在不同基质中移栽成活率不一样[16],因此,兔眼蓝莓能否诱导出数量众多、根系健壮的生根苗是工厂化组培快繁技术研究的关键环节。本研究以‘灿烂’蓝莓为研究对象,研究外植体的灭菌方法,筛选出适合的诱导、增殖及生根培养基,为生产优质种苗提供理论指导。
1 材料和方法
1.1 试验材料
试验材料为兔眼蓝莓‘灿烂’,来自长沙智博生物科技有限公司种植园。外植体选取生长健壮、无病害的当年生半木质化枝条,将其组织培养后获得的蓝莓试管苗作为试验材料。
1.2 试验设计
1.2.1 外植体消毒处理
将兔眼蓝莓‘灿烂’带芽茎段剪成长2.0~3.0 cm 的小段,在洗衣粉溶液中浸泡1 h,流水冲洗干净,剪去叶片后,先后采用75%乙醇、0.1% HgCl2和2%次氯酸钠处理茎段,设置6 组实验方法进行灭菌(表1)。将灭菌后的带芽茎段用无菌水冲洗3 次,接种至改良WPM 培养基(以水合硝酸钙684.00 mg·L-1、硝酸钾190.00 mg·L-1和盐酸硫胺素0.10 mg·L-1代替原WPM 培养基中的硫酸钾、氯化钙和硫酸亚铁)上。每组接种30 个茎段,3 次重复,2 周后观察外植体存活以及感染情况。

表1 蓝莓带芽茎段的灭菌处理Table 1 Sterilization of Vaccinium ashei stem segments with buds
1.2.2 初代培养的筛选
将1.0~1.5 cm 的带芽茎段接种于添加玉米素ZT(0.1、0.5、1.0、1.5、2.0 mg·L-1) 的 改 良WPM 培养基上,设置5 组,每组接种30 个茎段,3 次重复,接种后20 d 观测记录芽苗诱导情况。
1.2.3 继代培养基的筛选
将组培苗切去下端愈伤组织和上端嫩芽部分,再切成1.0~1.5 cm 的单芽茎段,转接于不同激素质量浓度的WPM(改良)培养基(表2)上进行增殖培养,每瓶接种6 株,每个处理接种30 株,3 次重复。培养 40 d 后观察芽的生长状况。
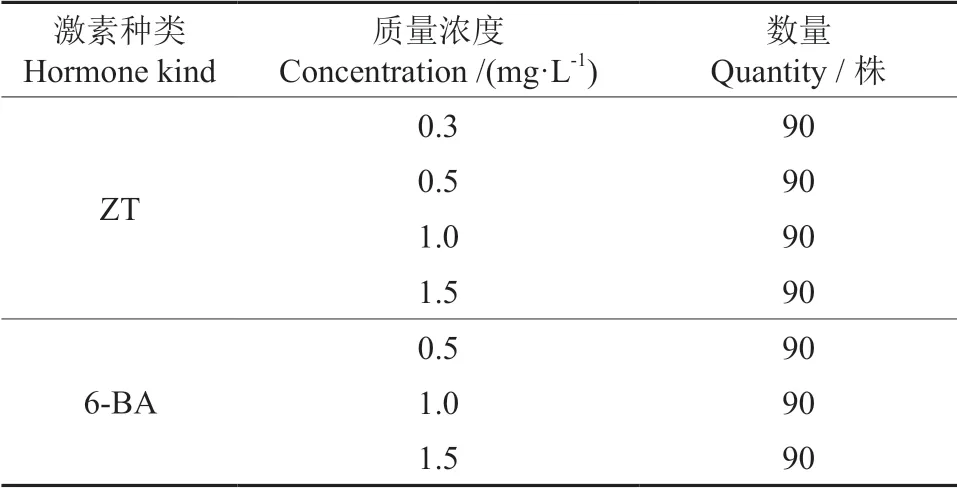
表2 诱导蓝莓不定芽的激素质量浓度Table 2 Hormone mass concentration of inducing Vaccinium ashei adventitious buds
1.2.4 生根培养基的筛选
剪取2.0 cm 左右的兔眼蓝莓试管苗,转接到生根培养基上。以1/2 WPM(改良)培养基为基本培养基,添加活性炭(200 mg·L-1)+IBA(0.5、0.8、1.0、1.2 mg·L-1)。设置4 个组,每组接种30 个单芽茎段,3 次重复,60 d 后调查生根情况。
1.3 培养条件
本试验在长沙智博生物科技有限公司组培实验室中进行,培养温度 25±2 ℃,光强2 000~2 500 Lx,光照时间12 h·d-1。基本培养基为:WPM培养基,10.5 g·L-1卡拉胶,20 g·L-1蔗糖,pH 值为5.5~6.5。
1.4 数据分析
培养30~60 d 后统计外植体污染率、存活率、腋芽诱导率、生长状况、增殖系数、生根率、诱导的根长度、根条数和根重等。使用SPSS22.0 和EXCEL2010 软件进行数据统计分析。
2 结果与分析
2.1 兔眼蓝莓外植体表面的消毒方法
不同灭菌剂和处理时间不同,外植体的污染率和存活率也不同。由方差分析结果表明(表3),不同处理方式对兔眼蓝莓茎段污染率的影响有显著差异,第3 组污染率最低为5.66%;第2 组次之为12.22%,但其试管苗愈伤组织良好,腋芽生长旺盛,为最适宜的消毒方法。实验第1 组、第4 组、第5 组灭菌不充分,污染率高达60%以上,其中第4 组外植体全部污染;第3 组实验组灭菌时间过长,影响腋芽生长,长势缓慢且细弱。综上所述,第2 组,即先用75%乙醇浸泡20 s、再用0.1%HgCl2浸泡10 min,再用无菌水冲洗3 次为最适宜的消毒方法。图1为外植体消毒后的生长状况。
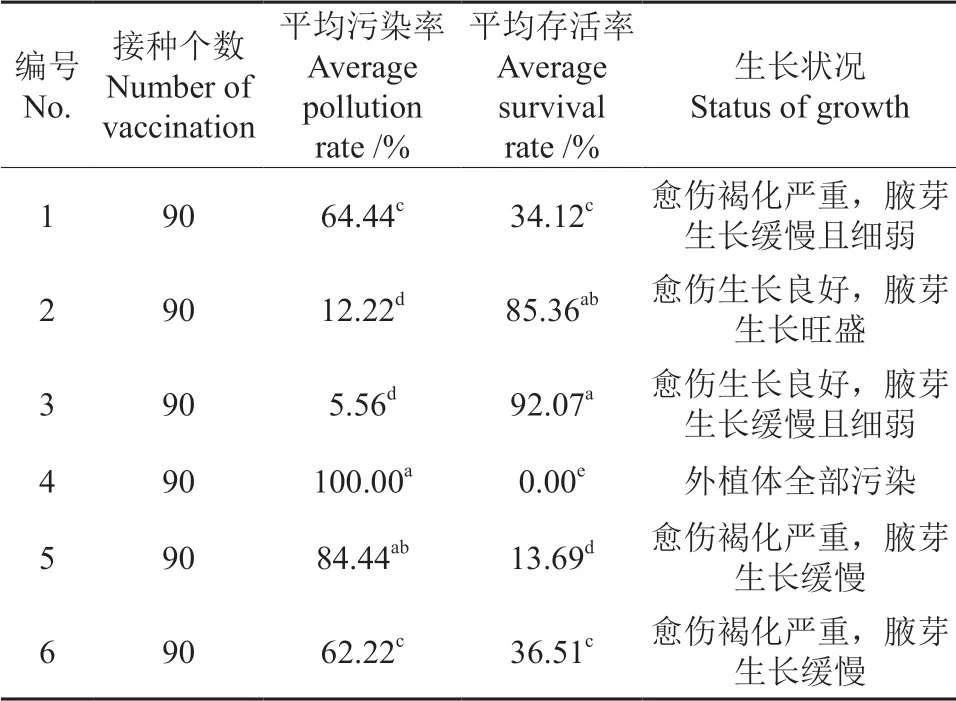
表3 不同灭菌剂和方法对外植体生长的影响†Table 3 The effect of different sterilizing agents and methods on explant browning

图1 外植体消毒后的生长状况Fig.1 The growth condition of the ex-plant after disinfection
2.2 不同ZT 质量浓度对初代培养的影响
在初代培养中不同ZT 质量浓度对兔眼蓝莓初代培养的影响见图2。由表4可以看出,ZT(1.0 mg·L-1)的激素质量浓度能有效促进蓝莓腋芽的诱导分化,腋芽分化快且粗壮,生长旺盛,叶片浓绿有活力,诱导率达64.66%。方差分析结果表明:1.0 mg·L-1的ZT 质量浓度与其他实验组相比有显著的差异,因此,改良WPM+ZT(1.0 mg·L-1)培养基为最适宜的初代诱导配方。其他高质量浓度或低质量浓度的激素配方,都会导致试管苗的生长缓慢或植株细弱,不适宜做培养基配方。

图2 不同ZT 质量浓度对兔眼蓝莓芽诱导情况Fig.2 Induction of blueberry buds by different ZT mass concentrations
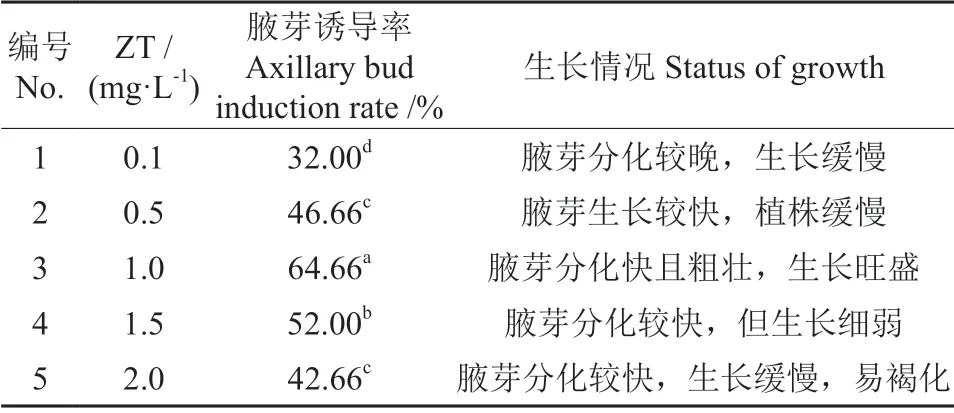
表4 不同激素质量浓度对兔眼蓝莓芽诱导的影响Table 4 Effects of different mass concentration on bud induction of Vaccinium ashei
2.3 植物激素及配比对继代增殖培养的影响
以WPM(改良)培养基为基本培养基,添加两种植物生长调节剂进行继代增殖培养,对7 种培养基的增殖系数进行方差分析(表5),试验结果表明 ZT(0.5 mg·L-1)对试管苗的影响差异显著,增殖系数较高,为3.57,此时愈伤组织较多,芽分化较快且粗壮,生长旺盛;1.0 mg·L-1的ZT 浓度时也可以达到同样的效果,但此时试管苗不健康,容易褐化或玻璃化;ZT 质量浓度为1.5 mg·L-1时,增殖系数最高为4.43,此时试管苗的增殖达到最大,分化的不定芽最多,但枝条细弱,叶片稀疏,易发生褐化,不适合做继代培养。低质量浓度的6-BA,增殖效果不明显,未产生愈伤组织及芽的分化,1.5 mg·L-1时,植株少量分化,但枝条细弱。综上所述,0.5 mg·L-1的ZT 质量浓度,为最适宜的继代培养配方。图3为ZT 和3-BA 对兔眼蓝莓愈伤组织诱导情况。
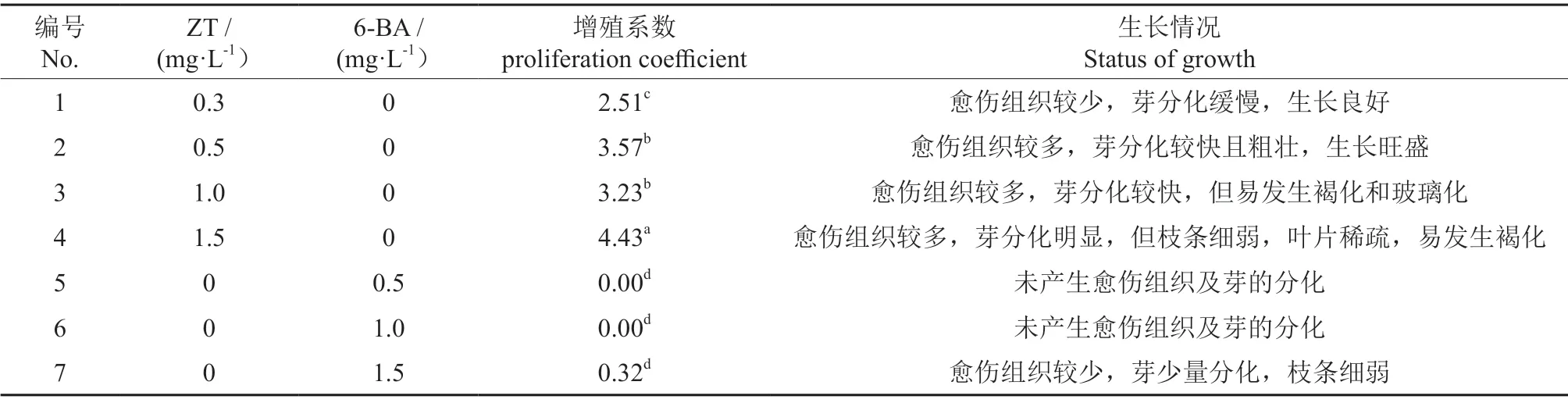
表5 不同激素种类对兔眼蓝莓芽和愈伤组织诱导的影响Table 5 Effects of different hommones on bud and callus induction of Vaccinium ashei

图3 ZT 和6-BA 对兔眼蓝莓愈伤组织诱导情况Fig.3 Induction of ZT and 6-BA on callus of blueberry
2.4 IBA 不同浓度对组培苗生根的影响
以1/2 WPM(改良)培养基为基本培养基,添加不同质量浓度的IBA进行生根培苗,研究表明,由表6可以看出,兔眼蓝莓‘灿烂’在1/2 WPM(改良)培养基外加激素IBA(1.0 mg·L-1)中生根较为理想,根系丰富有活力,根系从茎基部或皮部长出,长度粗细均匀。在IBA 质量浓度为1.2 mg·L-1时,平均根长最高,但根系较细弱(图4)。

图4 IBA 不同质量浓度对组培生根的影响情况Fig.4 Effects of IBA mass concentration on rooting in tissue culture
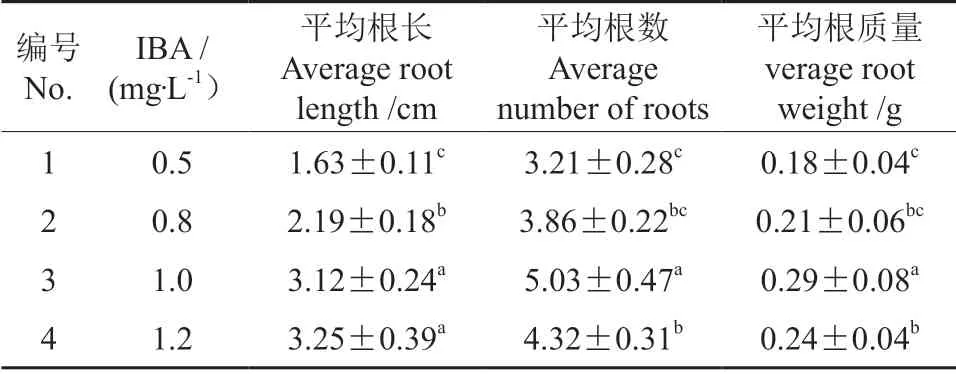
表6 IBA 不同质量浓度对组培生根的影响Table 6 Effects of IBA mass concentration on rooting in tissue culture
3 讨 论
3.1 外植体表面消毒方法对蓝莓茎段的影响
本实验中最佳外植体处理方法为,将蓝莓茎段在洗衣粉溶液中浸泡1 h,流水冲洗3~5 次,剪去叶片后,再用75%乙醇浸泡20 s、0.1%HgCl2浸泡10 min,由于渗透性较强,必须反复用无菌水冲洗,防止升汞残留,接种时还需剪去外植体两端,更有利于吸收和防止褐化。本次实验于冬季采集枝条,冬季温度低,病菌较少,因此枝条采集季节也是影响污染率的一个重要因素。
3.2 玉米素ZT 对蓝莓初代组织培养的影响
在初代诱导阶段,加入玉米素ZT(1.0 mg·L-1)的改良WPM 培养基的效果最好,与孙淼淼[17]探究蓝莓‘盛世’的外植体诱导结果一致。玉米素ZT 是植物体内天然存在的一种细胞分裂素,它是从甜玉米灌浆期的籽粒中提取并结晶出的第1 个天然细胞分裂素,植物自身产生微量的植物激素并直接或间接作用于靶器官或靶组织,影响植物根系的分裂、生长和分化[18]。植物激素被吸收后可促进植物体内的各类活性酶类物质的联动作用,从而影响植物的理化进程[19]。实验表明蓝莓茎段对玉米素ZT 的敏感度较高,各组合间分化率显著,因此实验中仍需不断微调以确定更适宜的质量浓度范围。
3.3 不同激素种类和质量浓度对蓝莓继代培养的影响
蓝莓继代培养中,加入玉米素ZT(0.5 mg·L-1)的培养基,增殖系数较高为3.57,此时植株生长健壮,叶片浓绿有活力,ZT 质量浓度为1.5 mg·L-1时,增殖系数达到最高为4.43,但此时增殖芽苗茎秆细弱,叶片稀疏短小,侧枝过多,褐化玻璃化严重,可能是玉米素浓度过高导致,也可能因为多次的继代培养所引起的退化,这与宋斯妤[20]研究的华中樱多次继代引起植株矮小瘦弱的现象相似。另外,组培苗的褐化、玻璃化现象,除了培养基的配方原因外,人工接种的不当操作也可能导致褐化,剪去茎段时截面粗糙不平整或者剪刀划破叶片都可能导致褐化、玻璃化的现象,因此规范操作是组培人员的基础素质和技能。
在试管苗的继代培养中,茎段下切口产生愈伤组织,引起组织的脱分化和再分化,另外还观察到植株的叶柄处以及接触培养基表面的叶片,也会产生愈伤组织,增殖出芽,这与陈冰心等[21]研究的‘奥尼尔’蓝莓叶片组培快繁的结果一致。叶柄处存在芽原基,生命活动旺盛,通过表皮细胞吸收到玉米素时易发生脱分化产生愈伤组织,而叶片可能通过气孔和表皮细胞吸收到激素而增殖分化。
3.4 吲哚丁酸IBA 质量浓度对蓝莓生根培养的影响
生根培养是蓝莓组培中较难的阶段,王升等[22]研究蓝莓的组培中,直接用继代培养的蓝莓植株,剪除愈伤组织再短截2~3 cm 后扦插于水苔中。本次试验中,以1/2 WPM(改良)培养基为基本培养基,添加活性炭(200 mg·L-1)、IBA(1.0 mg·L-1)的培养基效果最佳,生根率可达84%,但时间跨度较长,需要2 个月才能够炼苗移栽,改良激素配方可能会达到更好的效果。
但本研究只局限于在瓶内生根研究,没有进行驯化炼苗方面的研究,瓶内生根苗如何适应大田环境,如何在大田存活下来是下一步研究方向。
4 结 论
通过一系列的试验,该研究最终确立了‘灿烂’蓝莓茎段的最适消毒方法是:75%乙醇浸泡20 s,0.1%升汞浸泡12 min。最适诱导培养基为WPM(改良)+ZT 1.0 mg·L-1。最适增殖培养基为WPM(改良)+ZT 0.5 mg·L-1,增殖系数为3.57,丛生苗生长迅速且健壮。最适生根培养基为1/2 WPM+IBA 1.0 mg·L-1。通过该技术体系进行大规模的组培快繁,不仅在很大程度上缩短了组培生产周期,更重要的是,繁殖系数高,得到的组培苗后代品质较高,并为其他物种利用器官组织直接诱导不定芽进行大规模扩繁提供了一定的研究基础和技术参考。
