左旋咪唑对柔嫩艾美耳球虫活疫苗免疫增强效果的评价
2022-09-23余水兰赵其平朱顺海韩红玉梁珊珊王青杰王海霞
余水兰,赵其平,朱顺海,黄 兵,韩红玉,于 钰,2,梁珊珊,2,王青杰,王海霞,董 辉
(1.中国农业科学院上海兽医研究所 农业农村部动物寄生虫学重点实验室,上海 200241;2.上海师范大学生命与环境科学学院,上海 200234)
球虫病是一种由艾美耳球虫(Eimeriaspp.)寄生在肠道所引起的传染性疾病,严重损害全球养鸡业的经济利益[1-2]。抗球虫药物的使用是当前球虫病的防治主要途径之一[3-4]。但由于球虫耐药性的产生以及人们对药物残留和环境保护等公共卫生安全问题的日益关注,迫切需要免疫预防替代药物成为球虫病控制的主导途径[5]。实践证明,球虫卵囊具有良好的免疫原性,能够刺激机体产生细胞免疫反应和体液免疫反应[6],可制成活疫苗免疫预防球虫病,减少死亡率[7]。目前,由早熟株卵囊组成的减毒活疫苗是应用最广泛的球虫病疫苗[8]。但球虫病活疫苗也存在明显的不足:活疫苗通常接种3~7日龄雏鸡,依靠产生的卵囊后代经2~3次重复感染而获得良好的免疫力,在此过程中鸡可能会出现生长减缓、增重减少等不良反应,影响生产性能[9]。而已有研究发现免疫增强剂与球虫活疫苗联用不但可以增强雏鸡的免疫效果,同时也可以降低接种疫苗带来的不良影响[10-11]。据文献报道,通过口服或腹腔注射左旋咪唑均可明显增强鸡球虫疫苗的免疫效果[10-12]。然而已有的研究中左旋咪唑的使用方法较为复杂或使用周期长,成本较高。本文拟研究单次口服化学合成小分子免疫增强剂——左旋咪唑(Levamisole)对柔嫩艾美耳球虫(E.tenella)免疫增强效果和免疫鸡增重的影响,为评估左旋咪唑作为球虫病活疫苗的免疫增强剂提供理论基础。
1 材料与方法
1.1 试验试剂和虫株 盐酸左旋咪唑(Levamisole hydrochloride)由南京鲸轮制药有限公司惠赠,规格:25 kg/桶,产品批号:LV19007。分别按照每公斤体重1、2、4 mg盐酸左旋咪唑来设置低、中、高三个剂量组,按3日龄雏鸡体重约为50 g计算,低、中、高剂量分别为每只鸡0.05、0.1 mg和0.2 mg。称取适量盐酸左旋咪唑样品溶于水中,制成浓度分别0.1、0.20、0.40 mg/mL,每只鸡经口灌服0.5 mL。
免疫用虫株为柔嫩艾美耳球虫上海株早熟系,攻虫用虫株为柔嫩艾美耳球虫上海株,均由中国农业科学院上海兽医研究动物原虫创新团队保存。所用卵囊的保存期不长于3个月。
1.2 笼养试验评价左旋咪唑的效果
1.2.1 试验方法 选取60只体重相近的3日龄三黄鸡,随机均分为6组,饲养于单独的笼子内,其中第1、2、3组每只鸡分别先经口灌服0.05、0.10、0.20 mg的盐酸左旋咪唑,再接种1000个柔嫩艾美耳球虫早熟株卵囊;第4组每只鸡接种1000个柔嫩艾美耳球虫早熟株卵囊(无佐剂免疫组);第5、6组为不免疫组。10日龄第1~4组进行第二次免疫,每只鸡接种1000个柔嫩艾美耳球虫早熟株卵囊。二免后7 d,除了第6组(健康组)之外,其余各组每只鸡灌服5×104个柔嫩艾美耳球虫上海株(强毒株)卵囊。攻虫后7 d,称重、剖杀。
1.2.2 主要观测指标 包括:①临床症状:记录试验期间各组鸡的血便、死亡情况。②体重:一免疫后7 d、二免后7 d以及攻虫后7 d分别对所有的鸡进行称重,算出各组免疫期间的体重和攻虫期间增重。③卵囊产量:攻虫后第6~7 d,收集各组粪便,进行卵囊OPG计数,算出各组平均每只鸡的卵囊产量。④肠道病变记分:攻虫后7 d,取各组盲肠,参照Johnson等[13]的方法进行病变记分。⑤抗球虫指数(Anticoccidial index, ACI):根据公式ACI=(相对存活率+相对增重率)-(病变值+卵囊值)计算各组的ACI,评判标准参考文献[14],即ACI>160、160≤ ACI ≥ 120、ACI<120分别表示高效、部分、无抗球虫效果。⑥血清抗体效价:一免疫后7 d、二免后7 d以及攻虫后7 d,分别从每组中随机挑选3只鸡采血,利用ELISA方法检血清抗体效价。方法为:将5 μg/mL的柔嫩艾美耳球虫孢子化卵囊抗原包被于96孔板上,与鸡血清孵育(1∶200)后,以Anti-Chicken IgY(IgG)(whole molecule)-Peroxidase antibody produced in rabbit(Sigma)作为二抗进行孵育,以TMB为底物进行显色,在450 nm处读取OD值。
1.3 平养试验评价左旋咪唑的效果 根据笼养试验的结果,选取具有较好免疫增强和促生长作用的2个左旋咪唑剂量(0.05 mg和0.10 mg)进行平养试验,以进一步确认其效果。
1.3.1 试验方法 150只刚出壳三黄鸡,随机分为5组,每组30只,平养于垫有木屑的房间里,饲喂无抗球虫药物的饲料,自由采食和饮水。3日龄时,第1、2组每只鸡分别先经口灌服0.05、0.10 mg的盐酸左旋咪唑,再接种600个柔嫩艾美耳球虫早熟株卵囊,即左旋咪唑处理组(分别记为LEV1、LEV2);第3组每只鸡接种600个柔嫩艾美耳球虫早熟株卵囊,即无佐剂免疫组(VAC);第4、5组为不免疫组,分别为不免疫感染组(INF)和健康组(CON)。免疫后第21 d,各组随机选取12只鸡,除了第5组之外,其余各组每只鸡灌服5×104个柔嫩艾美耳球虫上海株(强毒株)卵囊。攻虫后7 d,称重、剖杀。
1.3.2 主要观测指标 包括:①体重:免疫后第7、14、21 d以及攻虫后7 d分别对所有的鸡进行称重,计算出各组免疫期间的体重和攻虫期间增重。②临床症状、卵囊产量、肠道病变记分、抗球虫指数等指标的方法参照1.2.2。③血清细胞因子水平:免疫后第7、14、21 d以及攻虫后7 d,分别从每组中随机选取3只鸡采血,利用ELISA检测鸡血清中的CD4、CD8分子及细胞因子TNF-α水平,所用试剂盒为Chicken Cluster of Differentiation 4(CD4)或8(CD8)ELISA Kit和 Chicken tumor Necrosis Factor α(TNF-α)ELISA Kit,均购自mlBio公司,检测方法根据说明书进行。数据结果以各试验组平均OD值与同时段健康组平均OD值之间的比值来表示。
1.4 数据统计分析 采用GraphPad Prism 5.0进行数据分析,并使用SPPS17.0统计软件对数据进行单因素方差分析(ANOVA)。当方差分析发现显著性差异(P<0.05)时,采用Dunnettt检验分析处理组和对照组的均数差异。体重、OD值及肠道平均病变记分表示为“均值±标准误”。
2 结果
2.1 笼养试验结果
2.1.1 左旋咪唑对免疫期间鸡体重的影响 由结果可知,各免疫组在免疫期间的平均体重均与健康组无差异显著。但在一免后7 d,第3组(0.20 mg左旋咪唑组)体重稍差,相对体重率仅为94.09%;而在二免后7 d,第4组(无佐剂免疫组)体重稍差,相对体重率仅为94.62%(表1)。

表1 笼养试验中免疫期间体重(g)和相对体重率(%)结果Table 1 Body weights (g) and relative weight rate (%) during immunization in battery test
2.1.2 左旋咪唑对攻虫后鸡免疫效果的影响 结果见表2。从表可知,各免疫组攻虫期间的增重均与健康组的差异不显著(P>0.05),且0.05 mg(第1组)和0.10 mg(第2组)左旋咪唑组的增重明显高于不免疫攻虫组(第5组)(P<0.05)。各免疫组的病变记分相当,均明显低于不免疫攻虫组(P<0.05)。除了0.20 mg左旋咪唑组(第3组)的卵囊产量与不免疫攻虫组的相当之外,其余免疫组的均明显减少。从综合指标ACI来看,0.10 mg左旋咪唑组的ACI最高,达到192,具有极其高效效果,0.05 mg左旋咪唑组和无佐剂免疫组(第4组)具有高效效果,而0.20 mg左旋咪唑组的效果不佳。

表2 笼养试验中攻虫后的ACI结果Table 2 Result of ACI after challenge in battery test
2.1.3 左旋咪唑对抗体水平的影响 结果见表3。从表可知,各免疫组的抗体水平均在二免后7天最高,但除了0.20 mg左旋咪唑组(第3组)明显高于不免疫组之外(P<0.05),其余组均差异不显著(P>0.05)。在试验期间,三个左旋咪唑组的抗体水平均与无佐剂免疫组(第4组)的相当(P>0.05)。

表3 笼养试验中的血清抗体效价结果Table 3 Result of serum antibody titer in battery test
2.2 平养试验结果
2.2.1 左旋咪唑对免疫期间鸡体重的影响 结果见表4。由表可知,在免疫期间,各免疫组之间的体重相当,均与健康组(CON)无显著差异(P>0.05),但左旋咪唑组(LEV1、LEV2)的体重稍高于无佐剂免疫组(VAC)。
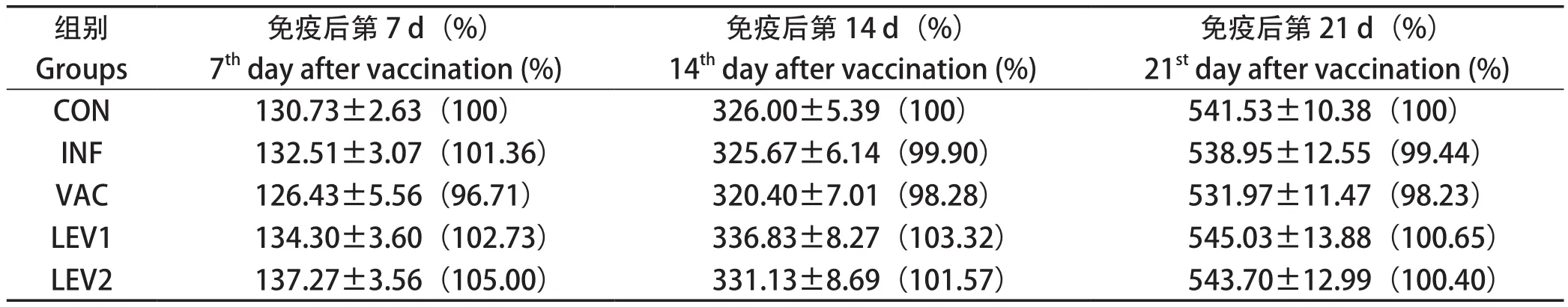
表4 平养试验中免疫期间的体重(g)和相对体重率(%)结果Table 4 Body weight (g) and relative weight rate (%) during immunization in floor-pen assay
2.2.2 左旋咪唑对攻虫后鸡免疫效果的影响 结果见表5。由表可知,各免疫组没有出现死亡,而不免疫感染组存活率为91%。各免疫组的增重均与健康组的相当,肠道病变轻微或无病变,仅排出少量的卵囊。从综合指标ACI来看,各免疫组的ACI均大于160,具有高效的效果;但相对来讲,0.10 mg左旋咪唑组(LEV2)的ACI达到212,优于0.05 mg左旋咪唑组(LEV1)和无佐剂免疫组(VAC)。
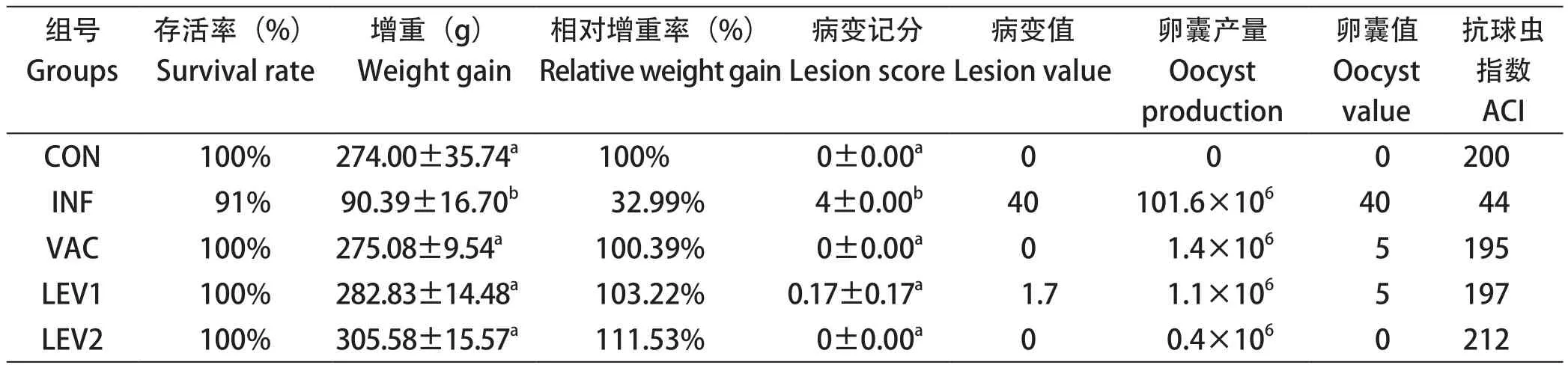
表5 平养试验中攻虫后的ACI结果Table 5 Result of ACI after challenge in floor-pen assay
2.2.3 左旋咪唑对细胞因子的影响 对免疫期间和攻虫后血清中的CD4、CD8分子及细胞因子TNF-α水平进行检测,以各试验组平均OD值与同时段的健康组平均OD值之间比值来表示试验结果。
CD8分子检测结果见表6,从表可知,各免疫组的CD8分子水平在免疫后第14 d明显高于不免疫组(CON)(P<0.05),0.10 mg左旋咪唑组(LEV2)明显高于无佐剂免疫组(VAC)(P<0.05);其余时间各组之间无显著性差异(P>0.05)。
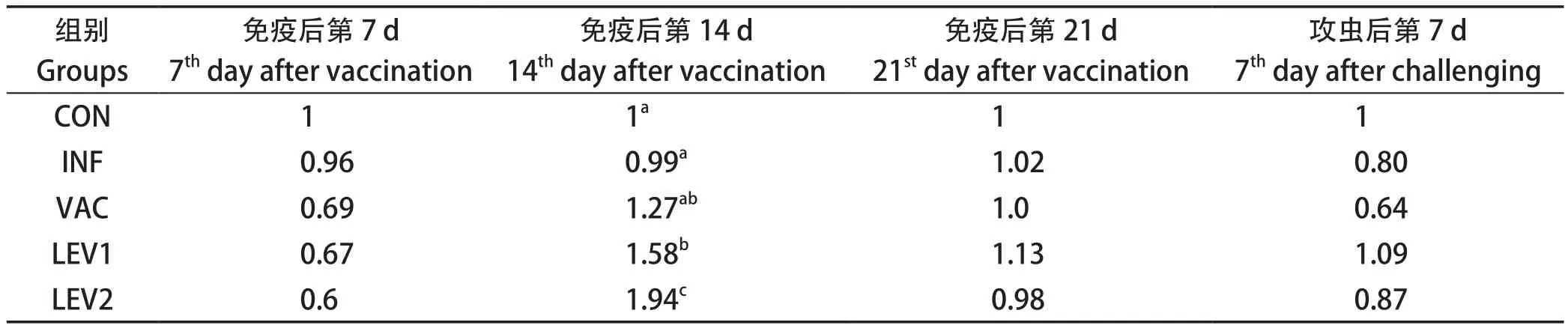
表6 平养试验中CD8分子检测结果Table 6 Result of CD8 detection in floor-pen assay
CD4分子检测结果见表7,从表可知,各免疫组的CD4分子水平在免疫后第7 d明显高于不免疫组(CON)(P<0.05),左旋咪唑组与无佐剂免疫组(VAC)之间相当(P>0.05);其余时间各组之间无显著性差异(P>0.05)。
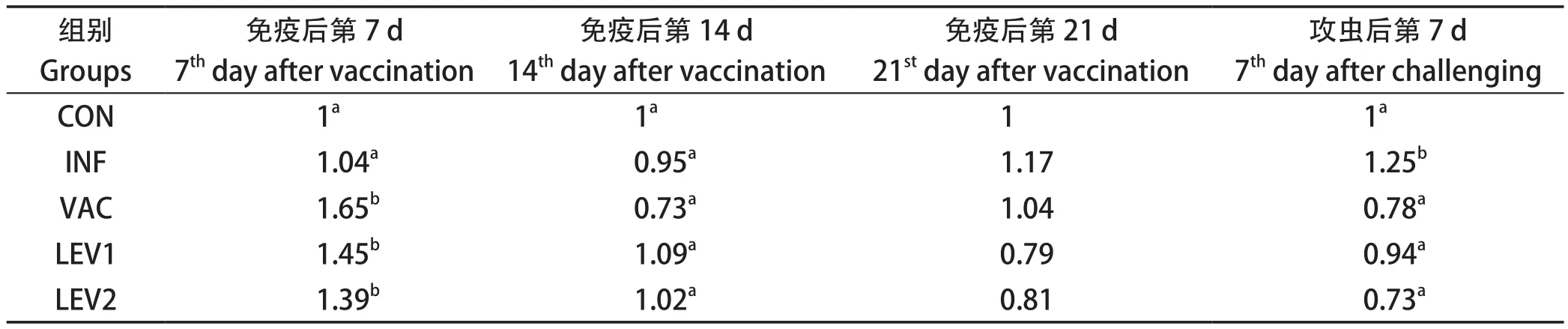
表7 平养试验中CD4分子检测结果Table 7 Result of CD4 detection in floor-pen assay
TNF-α分子检测结果见表8,从表可知,各免疫组的TNF-α分子水平在免疫后(第7、14、21 d和攻虫后7 d均明显高于不免疫组CON)(P<0.05),2个左旋咪唑组在免疫后第21 d和攻虫后7 d均明显高于无佐剂免疫组(VAC)(P<0.05),而免疫后7、14 d时差异不显著(P>0.05)。

表8 平养试验中TNF-α分子检测结果Table 8 Result of TNF-α detection in floor-pen assay
3 讨论
左旋咪唑为咪唑衍生物,对寄生于消化道和呼吸道的线虫均有高效的驱除效果,且毒副作用低,是被广泛应用的兽用抗蠕虫药物[15-16]。1971年,Renoux等[17]发现左旋咪唑能增强小鼠布氏杆菌菌苗免疫效果,进一步研究表明,左旋咪唑具有免疫刺激作用,可以通过促进免疫细胞的增殖和成熟,或通过增强巨噬细胞的功能来刺激产生免疫[18-19]。同时,左旋咪唑对脾脏、法氏囊等免疫器官的发育具有促进作用,对鸡具有显著的增重效果[15],可减轻疫苗对免疫鸡生长的不良影响。由于具有免疫增强和促生长的双重作用,左旋咪唑是一种良好的免疫增强剂,被应用于新城疫[20-24]、禽流感[25]、鸡传染性法氏囊[26]等疫苗研制中。本文研究左旋咪唑对柔嫩艾美耳球虫免疫增强效果,首先在笼养试验中对左旋咪唑的剂量进行筛选,再通过平养试验对筛选获得的有效剂量进行验证。
本研究首先在笼养试验中对左旋咪唑的剂量进行筛选,首次免疫所用鸡为3日龄,是为了与球虫病活疫苗推荐使用的日龄一致,由于免疫鸡一般需要2~3次重复感染后才可获得较好的免疫保护力,而笼养鸡无法进行二次感染,所以首免后7 d进行了二次免疫以增强免疫力。现有商品化球虫病活疫苗都仅需免疫一次,所以本研究中仅是在首次免疫时将左旋咪唑与柔嫩艾美耳球虫联合使用,是为了尽可能与疫苗临床使用方法相符合。最小剂量主要参考乔彦良等[24]、杨晶晶等[25]人的报道,按每公斤体重免疫1 mg左旋咪唑来计算,3日龄鸡的体重约为50 g,所以每只鸡的剂量为1 mg/kg×0.05 kg=0.05 mg,在此基础上设置了0.1 mg和0.2 mg剂量组,即分别是按每公斤体重免疫2 mg和4 mg左旋咪唑来计算。在试验中,我们观测了鸡的免疫期间体重、ACI以及血清抗体水平等指标,结果发现0.1 mg和0.05 mg组鸡在免疫期间的增重均稍好于无佐剂免疫组,免疫保护力分别高于或相当于无佐剂免疫组,而0.2 mg组在免疫初期对鸡有不良影响,抗球虫效果明显低于无佐剂免疫组。结果表明左旋咪唑对柔嫩艾美耳球虫感染鸡具有免疫增强和促生长双重作用,但其发挥作用的强度与剂量有关,这与王书全等[27]研究结果一致。基于笼养试验的结果,我们选择剂量为0.05 mg和0.10 mg左旋咪唑进行散养试验以进一步验证其效果。结果也发现这两个剂量组免疫期间的增重均稍好于无佐剂免疫组,0.10 mg组的ACI明显高于0.05 mg组,而后者与无佐剂免疫组相当。两次试验结果均表明0.1 mg左旋咪唑对柔嫩艾美耳球虫感染鸡的免疫增强和促生长的效果最好。
球虫感染后可诱发宿主产生保护性免疫反应,其中体液免疫在抗球虫免疫中发挥着不可忽视的作用,尤其特异性抗体 IgG在抵抗球虫感染时具有重要的作用[28-29]。在笼养试验中,我们发现各免疫组的IgG抗体水平在二免后7 d(即一免后14 d)明显高于不免疫组,其余时间均与不免疫组的相当,这与已有研究一致。田文霞等[29]发现鸡特异性IgG可在初次感染柔嫩艾美耳球虫后第6 d的血清中检测出,随后抗体水平逐渐升高于第18 d达到峰值,持续一段时间后下降。但本试验中,各左旋咪唑组与无佐剂免疫组之间的抗体水平无显著性差异,不同于已有研究。已有研究发现左旋咪唑与新城疫疫苗联用[20-24]、与鸡传染性法氏囊疫苗联用[26]均可明显升高血清特异性抗体滴度。
在鸡球虫保护性免疫机制中,细胞免疫居于主导地位,而T细胞免疫反应在抵抗球虫病过程起重要作用。鸡CD4和CD8分子是T细胞表面重要的表面标志。在平养试验中,我们发现免疫组的CD4和CD8分子水平分别在免疫后第7 d和14 d明显升高,这与已有研究一致。当感染球虫后,鸡CD4+和CD8+T淋巴细胞都参与细胞免疫过程,CD4+T淋巴细胞作为调节细胞,主要是启动免疫应答和抵抗初次感染;而CD8+T淋巴细胞作为一种效应细胞,是抵抗再感染的主力[30-32]。但左旋咪唑处理组的CD4与无佐剂免疫组之间无显著性差异,而0.1 mg组CD8分子水平免疫后第14 d明显高于无佐剂免疫组,而0.05 mg组与无佐剂免疫组相当,均明显高于不免疫组,说明左旋咪唑无促进CD4增殖作用,而0.1 mg左旋咪唑可以明显促进CD8分子的增殖。
鸡感染球虫后,在细胞介导的免疫应答中,激活的CD4+和CD8+T细胞释放的多种细胞因子在抗球虫中发挥重要作用,主要包括5种细胞因子:IFN-γ、IL-2、IL-5、TGF和肿瘤坏死因子(tumor necrosis factor, TNF)[33]。其中肿瘤坏死因子-α(TNF-α)是由自然杀伤细胞和巨噬细胞分泌,对球虫感染可产生保护作用。在本试验中,我们发现各免疫组的TNF-α水平明显高于不免疫组,这与已有研究一致。王彩霞等[34]研究结果表明,首免柔嫩艾美球虫后第9 d鸡TNF-α水平明显升高。同时也发现,左旋咪唑处理组在免疫后第21 d和攻虫后第7 d均明显高于无佐剂免疫组,说明左旋咪唑可明显刺激机体产生TNF-α,利于抵抗球虫的感染,这与Zhang等[35]发现脂多糖或柔嫩艾美球虫子孢子、裂殖子可刺激鸡巨噬细胞产生TNF的结果一致。
综上,本研究发现0.1 mg左旋咪唑处理组可明显促进鸡CD8因子的增殖和TNF-α的分泌,明显提高柔嫩艾美耳球虫的免疫效果,且有促生长的作用,可以消除球虫免疫对生长的不良影响,即左旋咪唑与柔嫩艾美耳球虫联合使用的最佳剂量为:按每公斤体重免疫2 mg左旋咪唑来使用。本研究结果为进一步评估左旋咪唑作为球虫病活疫苗的免疫增强剂提供理论基础。
