IFN-β启动子分泌性荧光素酶稳定表达细胞系的构建及鉴定
2022-09-23孟春春仇旭升宋翠萍刘炜玮孙英杰
王 飒,屈 阳,孟春春,仇旭升,廖 瑛,谭 磊,宋翠萍,刘炜玮,孙英杰,丁 铲
(1.福建农林大学动物科学学院,福州 350002;2.中国农业科学院上海兽医研究所,上海 200241;3.西北农林科技大学动物医学院,杨凌 712100)
先天性免疫是细胞抵御病毒感染的第一道防线,病毒感染细胞后,模式识别受体(RIG-I、TLR3、cGAS等)识别病毒的病原相关分子模式,通过接头蛋白(MAVS、STING等)、信号传递蛋白(TBK1、IKK等)、转录因子(NF-κB、IRF-3等)转录出促炎细胞因子和干扰素(Type I interferon, IFN),其中IFN通过自分泌或旁分泌途径与细胞表面IFN受体(IFN receptor, IFNR)结合,激活下游JAK-STAT途径,促使大量干扰素刺激基因的表达,发挥抗病毒作用[1-2]。IFN是一种分泌性的糖蛋白,家族成员分为三类,即I型、Ⅱ型及Ⅲ型IFN[3],其中I型干扰素IFN-β是机体重要的细胞因子,在抗病毒天然免疫中发挥重要作用[4-5]。IFN-β作为通路激活的效应蛋白和指征蛋白,IFN-β启动子活性则是通路是否激活的重要指标,因此含IFN-β启动子的报告基因系统成为不可或缺的工具。目前普遍采用的报告基因系统是Promega公司的PGL3萤火虫荧光素酶系统[6],以此载体为骨架,插入IFN-β启动子,获得可用于检测IFN-β启动子活性的质粒,用于瞬时转染[7]。但这一过程繁琐,每次实验都需转染步骤,并且需要裂解细胞后才能对荧光素酶进行检测。
Gaussia luciferase(Gluc)是近年来发现的荧光素酶家族中最小的成员,能够催化氧化腔肠素,该酶的发射光谱宽,能够发出波长为480 nm的蓝色荧光[8-9]。与萤火虫荧光素酶(firefly luciferase,fluc)和海肾荧光素酶(renilla luciferase, Rluc)相比,Gluc的发光强度更高[9],检测灵敏度更好,稳定性高,最重要的是Gluc可分泌到细胞外,无需裂解细胞,可直接利用上清液进行检测,操作更为简便,使Gluc得到广泛的应用,如哺乳动物细胞培养中的支原体污染的检测[10]、研究蛋白互作和定位、siRNA沉默技术、启动子活性的监测、评价肿瘤模型药物的疗效、实时监测肿瘤发生发展情况和高通量药物筛选等[11-12]。为了建立一种新型、简易、稳定的IFN-β启动子活性检测方法,本研究将人IFN-β基因启动子以及下游Gluc克隆至慢病毒载体中,构建稳定表达IFN-β-Gluc的A549细胞株,进一步通过筛选和功能鉴定获得IFN-β-Gluc稳定诱导性表达的单克隆细胞株。该细胞系提供了检测IFN通路激活的简易方法,为进一步研究病毒诱导IFN-β基因的转录、调控,动态监测IFN-β启动子活性,高通量筛选等研究奠定了基础。
1 材料与方法
1.1 质粒、细胞、病毒和细胞 pHAGE-bsd慢病毒载体购自苏州金唯智生物科技有限公司;根据公布的人源IFN-β基因启动子序列(GenBank登录号:V00534)起始密码子上游209 bp的启动子序列与Gluc基因序列(Genbank登录号:LC006266.1),将两者耦联序列IFN-β-Gluc交由苏州金唯智生物科技有限公司合成;质粒:p3ⅹFlag-CMV-14、pCMV-HA质粒为Clontech公司产品,Flag-V、HAMAVS和HA-TBK1由本实验室构建并保存,pMD2.G、psPAX2为Addgene公司产品。A549、HEK-293T细胞系购自美国ATCC生物标准品资源中心,用DMEM培养基(Thermo Fisher Scientific)(含10%胎牛血清),在37℃、5%CO2条件下培养。新城疫病毒(Newcastle disease virus, NDV)Herts/33毒株购自中国兽医药品监察所;大肠杆菌DH5α、DNA凝胶回收试剂盒、质粒DNA小提中量试剂盒、无内毒素质粒大提试剂盒及血液/细胞/组织基因组DNA提取试剂盒(离心柱型)购自购自天根生化科技(北京)有限公司。
1.2 主要试剂SpeI和XbaI内切酶为美国NEB公司产品;同源重组试剂盒为苏州金唯智生物科技有限公司产品;PCR Mix为广州东盛生物公司产品;Gaussia Luciferase Cellular Assay Kit购自美国Abcam公司;杀稻瘟菌素(Blastincidin, BSD)、Lipofectamine 2000、氨苄青霉素、Opti-MEM培养基购自美国Thermo公司产品;聚凝胺(polybrene)购自美国Sigma公司;胎牛血清购自以色列BI公司。
1.3 重组表达载体pHAGE-IFN-β-Gluc的构建 分别用限制性核酸内切酶SpeI和XbaI对载体pHAGE-bsd和合成的IFN-β-Gluc片段双酶切,将酶切后线性载体与IFN-β-Gluc片段通过同源重组进行连接,转化感受态细胞,经菌液PCR检测阳性菌落,扩大培养并提取质粒。用限制性核酸内切酶SpeI和XbaI酶切鉴定并送测序,测序比对成功后,根据无内毒素质粒大提试剂盒说明书提取质粒备用。
1.4 慢病毒包装 取对数生长期HEK-293T细胞接种于10 cm培养皿,细胞密度约为2×105cells/mL。24 h后待细胞密度为80%时,替换为Opti-MEM。使用Lipo2000转染构建好的慢病毒重组质粒(pHAGEIFN-β-Gluc)及辅助质粒,转染量为pMD2.G为12 μg、psPAX2为10 μg、pHAGE-IFN-β-Gluc为22 μg,培养8 h,换为10% FBS DMEM,继续培养24 h,观察细胞状态,分别于48、72 h各收取上清液一次,将两次所得上清液混匀,1000×g离心5 min,使用0.22 μm微孔滤膜过滤后,-80℃保存备用。
1.5 稳定表达IFN-β-Gluc细胞株的筛选 将A549细胞接种于6孔板,待第2 d感染时,使细胞长至60%。感染前弃上清液,使用无菌PBS,清洗1~2遍,换为慢病毒液培养,并加入8 μg/mL的polybrene辅助感染;24 h后更换含10%FBS的完全培养基。感染72 h后,加BSD筛选培养,约3 d后未经感染的对照组细胞全部死亡,感染组细胞有阳性克隆长出;利用96孔板有限稀释法将多克隆细胞进行梯度稀释至每孔含有0.5~1个细胞,连续观察培养7~10 d,挑选单克隆细胞,扩大培养后得到稳定表达IFN-β-Gluc的A549细胞系。
1.6 IFN-β-Gluc单克隆细胞株的PCR鉴定 收集经亚克隆后的IFN-β-Gluc细胞,使用血液/组织/细胞基因组DNA提取试剂盒提取单克隆细胞基因组DNA。根据NCBI核酸数据库报道的Gluc(GenBank登录号:LC006266.1)全长序列,设计以对引物,正向引物5'-ATGGGAGTCAAAGTTCTG-3',反向引物为5'-TTAGTCACCACCGGCCCC-3'。进行PCR扩增。PCR扩增程序:95℃预变性3 min;95℃变性30 s,58℃退火1 min,72℃延伸1 min,共循环35次;最后72℃延伸5 min。反应结束后PCR产物用琼脂糖凝胶电泳分析。
1.7 IFN-β-Gluc单克隆细胞株荧光素酶活性验证 将待检的细胞按1.5×105cells/mL铺板,18~24 h后,使用poly(I:C) 处理、NDV感染或转染MAVS等先天性免疫分子。24 h后收集细胞上清液,离心去除细胞碎片,根据Gluc分析试剂盒,用发光检测仪测定其相对光强度(relative light unit, RLU)。
1.8 单克隆细胞株稳定性的验证 复苏筛选所得的IFN-β-Gluc阳性克隆细胞株,进行连续传代,利用PCR检测第3、5、10、15、20代细胞中Gluc基因,使用NDV感染及poly(I:C) 刺激传代细胞,利用Gluc分析试剂盒,检测细胞上清液中Gluc酶活性的变化。
1.9 数据分析 采用GraphPad Prism 5软件的one-way ANOVA方法进行统计学分析,以P<0.05,差异显著,具有统计学意义。
2 结果
2.1 pHAGE -IFN-β-Gluc慢病毒质粒构建结果 为了获得稳定表达IFN-β-Gluc的慢病毒质粒,通过SpeI和XbaI两个酶切位点,将pHAGE-ISRE质粒中的EF-1α启动子和下游CDS插入位点与IFN-β-Gluc序列同源重组,获得重组慢病毒质粒(图1A)。经SpeI和XbaI双酶切后得到约6800 bp和800 bp两条条带(图1B),与预期结果一致,阳性克隆送至生工生物工程(上海)有限公司测序,测序正确的质粒扩大保存,并命名为pHAGE-IFN-β-Gluc。

图1 pHAGE-IFN-β-Gluc慢病毒质粒构建及PCR鉴定Fig.1 Construction and PCR identification of pHAGE-IFN-β-Gluc lentivirus plasmid
2.2 稳定表达IFN-β-Gluc的A549单克隆细胞筛选 将pHAGE-IFN-β-Gluc重组表达载体与辅助质粒共转293T细胞包装成慢病毒,感染目标细胞A549,经杀稻瘟菌素筛选后得到多克隆细胞;通过有限稀释法获得单克隆细胞;利用试剂盒提取单克隆细胞的基因组DNA,根据Gluc序列设计引物检测所得单克隆细胞中Gluc基因片段,PCR结果显示筛选到15个疑似阳性克隆,Gluc片段整合到细胞基因组中(图2A)。将转染空载的A549细胞和PCR检测阳性单克隆细胞计数,使用1 MOI的NDV病毒感染或poly(I:C)(2 μg/mL)刺激细胞30 h后,使用Gluc检测试剂盒检测上清液中Gluc活性。从所获得的15株单克隆细胞中检测获得两株单克隆细胞(#13、#14)经NDV及poly(I:C) 刺激后与空白组相比,Gluc的表达均显著上调(图2B),相比较之下,尽管其他疑似阳性克隆中有较高水平的Gluc表达,但与对照组相比,病毒和poly(I:C)刺激后未出现显著上调,因此将其舍弃。提取#13和#14克隆提取细胞基因组进一步测序鉴定,设计引物上游:5'-GGCGACACTGTTCGTGTTGT-3';下游:5'-TTAGTCACCACCGGCCCCCT-3'。测序结果与Gluc序列一致性100%,说明外源Gluc序列整合到#13和#14单克隆细胞基因组中。#13细胞空白处理组与#14细胞相比,其空白组Gluc的表达水平相对较低,且与空白组相比,处理组Gluc表达量极显著升高,因此选择#13细胞进行后续试验。

图2 稳定表达IFN-β-Gluc的A549单克隆细胞筛选Fig.2 Screening of monoclonal cells stably expressing IFN-β-Gluc
2.3 稳定表达IFN-β-Gluc的A549单克隆细胞功能验证 为进一步验证筛选得到的稳定表达IFN-β-Gluc单克隆细胞的功能,将细胞经传3代后,首先通过正向诱导实验验证:MAVS和TBK1是RIG-I信号通路中重要的信号分子,直接转染MAVS和TBK1能够显著诱导下游信号通路的活化,激活IFN-β的表达(图3A)。因此,首先转染HA-MAVS、HA-TBK1质粒后,对Gluc荧光酶活性进行检测,HA空载体(HA-vec)作为阴性对照。结果显示:与对照组相比,MAVS和TBK1均显著上调Gluc活性(图3B)。进一步通过反向抑制实验验证:NDV的V蛋白能够通过降解MAVS抑制下游信号通路的活化。因此,首先转染HA-MAVS刺激干扰素通路激活,同时转染不同浓度Flag-V(0、200、400 ng),对Gluc荧光酶活性进行检测,结果显示,上清液中Gluc酶活性与Flag-V的转染剂量呈负相关且具有浓度梯度依赖性(图3C)。

图3 稳定表达IFN-β-Gluc的A549单克隆细胞功能验证Fig.3 Functional verification of A549 monoclonal cells stably expressing IFN-β-Gluc
2.4 表达IFN-β-Gluc的A549细胞系稳定性验证 为验证筛选所得的阳性单克隆细胞能否稳定表达IFN-β-Gluc,复苏筛选所得的#13阳性克隆细胞,进行连续传代,并对第3、5、10、15和20代细胞分别从基因和蛋白的水平检测Gluc,以野生型A549细胞为阴性对照,利用PCR检测阳性克隆细胞中Gluc基因,结果显示阳性克隆细胞中Gluc基因在传代过程中未发生明显改变(图4A);使用NDV或poly(I:C)作为刺激物,诱导IFN-β的表达,检测上清液中Gluc荧光酶活性,结果显示,连续传代细胞经NDV或poly(I:C)刺激后,细胞上清液中Gluc荧光酶活性未发生显著变化(图4B)。
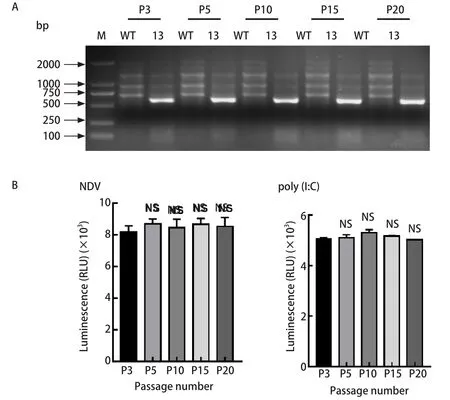
图4 稳定表达IFN-β-Gluc的A549细胞系的稳定性验证Fig.4 Verified of the A549 cell line stably expressing IFN-β-Gluc
3 讨论
报告基因是指表达产物容易被鉴定的基因,其工作原理是把报告基因与调控序列或其他目的基因融合形成嵌合基因,通过检测分析报告基因的表达产物来标定目标基因的表达。常用的报告基因有显示定位的荧光蛋白,例如绿色荧光蛋白(green fluorescent protein, GFP),红色荧光蛋白(red fluorescent protein, RFP)等[13],以及能用于定量的荧光素酶基因,例如Fluc,Rluc等[14]。与常用的定量报告基因Fluc、Rluc相比,Gluc属于分泌型荧光素酶,具有诸多优点如:测量酶活性时不需要裂解细胞,能够实现对实验对象的连续观察;基因片段小,仅有185个氨基酸残基的单链多肽[8],不影响载体的转化效率;无细胞毒性,与其他目的片段融合转化细胞,对细胞和动物无影响,可进行活细胞或生物体内实时监测;具有较高的敏感性,培养基中稳定性可达6 d[15]。利用Gluc的自然分泌性,使用慢病毒载体系统将Gluc转入293T细胞,根据培养基中Gluc的释放情况,能够监测内质网应激的分泌功能[16]。
NDV感染和外源poly(I:C)处理能够强烈诱导天然免疫应答,通常作为研究IFN-β信号通路的阳性对照[17-19],因此本研究中使用NDV和poly(I:C)处理IFN-β-Gluc稳转细胞,筛选阳性单克隆细胞。两株单克隆细胞(#13、#14)经NDV及poly(I:C)处理后,细胞培养上清液中分泌型荧光素酶活性均显著高于对照组,其中#13呈现极显著,因此,后续实验选择#13细胞株进行。值得注意的是,虽然其他IFN-β-Gluc单克隆细胞能够诱导更高水平的Gluc活性,但空白组Gluc活性过高,且空白组与处理组无统计学差异,不能进行后续功能实验。
MAVS作为重要的接头蛋白与IRF激酶TBK1在激活天然免疫信号通路中不可或缺[20-21],在通路中激活的受体通过招募接头蛋白,触发一系列的信号级联反应,最终激活转录因子NF-κB和干扰素调节因子产生I型干扰素。NDV的V蛋白能够募集E3泛素连接酶RNF5降解MAVS,抑制干扰素信号通路[22]。此次研究中,多次传代的IFN-β-Gluc细胞经转染MAVS、TBK1,细胞上清液中Gluc的活性显著高于空载组,而转染NDV V蛋白,则显著的抑制细胞上清液中Gluc的活性,说明通过转染正向调控或负向调控I型干扰素信号通路的外源质粒,IFN-β-Gluc细胞系均能做出正确应答,稳定表达IFN-β-Gluc的细胞系构建成功。该细胞系为深入研究病毒调控IFN-β信号通路提供技术支持。
通过连续传代阳性克隆细胞,分别在基因和蛋白水平对细胞系中IFN-β-Gluc表达的稳定性进行验证。利用PCR检测不同代次细胞中Gluc基因,待细胞传至20代,Gluc基因仍稳定存在,利用NDV和poly(I:C)外源刺激检测Gluc活性,显示不同代次间细胞上清液中Gluc活性未发生显著变化,由此说明筛选所得的阳性克隆细胞系在连续培养20代IFN-β-Gluc基因能够稳定表达。因此,本文成功构建稳定表达IFN-β-Gluc的A549细胞系,该细胞系提供了检测IFN通路激活的简易方法,为进一步研究病毒调控IFN-β信号通路、动态监测IFN-β启动子活性以及高通量筛选研究奠定细胞基础。
