响应面法优化山楂叶多酚微波-超声辅助提取工艺及其降糖活性研究
2022-09-23陈旭卢静静王涵驰李延华
陈旭,卢静静,王涵驰,李延华
(1.武汉设计工程学院食品与生物科技学院,武汉 430205;2.浙江工商大学食品与生物工程学院,杭州 310018)
山楂在我国有两千多年食用和药用历史。山楂叶中富含黄酮、多酚及三萜类化合物等活性成分,具有预防心血管疾病、降糖、降脂、抗氧化、抑菌等功效。目前对山楂叶中活性物质研究主要集中在黄酮类化合物提取、功能特性等,对多酚类物质研究较少。
多酚类化合物广泛存在于植物中,具有抗菌、消炎、抗癌、抗氧化等生理功能,近年研究表明,天然多酚还具有降血糖功效。Prathapan等研究发现木橘果肉多酚提取物可剂量依赖性抑制α-淀粉酶和α-葡糖苷酶活性,有效降低血糖,预防糖尿病[1]。目前,α-葡萄糖苷酶和α-淀粉酶合成抑制剂药物,如阿卡波糖、二甲双胍等是糖尿病患者常用药物,但对人体有副作用,寻找天然降血糖物质成为研究重点,具有降糖活性的山楂叶多酚高效制备受到学界关注。
多酚传统提取方法主要为有机溶剂、索氏提取法等。刘继攀等采用水溶剂提取真姬菇多酚,提取4 h时,多酚得率最高[2]。多酚具有一定抗氧化能力,但这类方法耗时长、效率低、提取物活性低。近年来,在溶剂提取基础上辅以微波和超声等现代技术,可有效提高多酚提取率并保护其生物活性。杨立风等采用微波辅助提取黑枸杞多酚,结果显示,微波时间6 s时,多酚提取得率可达(3.58±0.07)%,对DPPH自由基清除率可达(85.76±1.40)%[3]。郝霄鹏研究指出,微波辅助提取效率高,可有效保护活性成分[4]。李映新等优化超声波辅助提取黑老虎果皮多酚工艺条件,超声提取50 min,总多酚得率为(2.03±0.04)%,且该多酚对DPPH和ABTS+自由基清除率均在90%以上[5]。D'Alessandro等研究发现,相同条件下,超声波提取野樱莓多酚提取率显著高于未使用超声波[6]。可见,微波和超声处理可有效促进多酚物质溶出,提高多酚提取效率,较好保持其生物活性。
本研究将两种提取方法相结合,以山楂叶为原料,采用微波预处理和超声波辅助提取法,探讨乙醇浓度、超声温度、超声时间、液料比对山楂叶多酚得率的影响,通过Box-Behnken优化山楂叶多酚提取工艺,在此基础上检测多酚对α-葡萄糖苷酶和α-淀粉酶抑制效果,测定小鼠血糖、胰岛素含量、脏器指数和相关代谢酶等指标探讨其降糖作用。研究可为山楂叶多酚高效制备及降糖功能性食品、低糖食品添加剂开发提供理论依据。
1 材料与方法
1.1 试验材料
山楂叶,购自山东临沂爱康药业有限公司;没食子酸标准品、无水乙醇、福林酚、NKA-9大孔树脂、α-淀粉酶(活力≥250 U·mg-1)、α-葡萄糖苷酶(活力≥50U·mg-1Protein),购自武汉华玖医药科技有限公司;链脲佐菌素(STZ),购自北京索莱宝生物工程有限公司;盐酸二甲双胍缓释片,购自山东司邦得制药有限公司;葡萄糖(YX-CB500)、胰岛素(KLC9037)、糖原(BC0345)、糖化血红蛋白(YB-E12235)、谷丙转氨酶(C009-1)、谷草转氨酶(C010-1)测定试剂盒,购自南京建成生物技术有限公司。
1.2 实验动物
实验动物为昆明小鼠,体重(20±2)g,标准环境下喂养1周,试验过程中对小鼠所有处置均按《实验动物管理条例》规定执行。
1.3 试验设备
HHA-4数显恒温水浴锅,购自杭州聚同电子有限公司;TU-1810紫外可见分光光度计,购自北京普析通用仪器有限公司;ES120A电子天平,购自厦门莱斯德科学仪器有限公司;R206B旋转蒸发器,购自上海旦鼎国际贸易有限公司;G80F23CN3L-Q6(P0)型微波炉,购自广东格兰仕微波炉电器制造有限公司;NYUC-150NP型数控超声波清洗器,购自无锡诺源仪器设备有限公司;WD2102型自动酶标仪,购自北京市六一仪器厂。
1.4 试验方法
1.4.1 山楂叶微波预处理
山楂叶,60℃干燥24 h,粉碎,过50目筛。取山楂叶粉,加入5倍石油醚,室温搅拌24 h,脱脂处理,烘干备用[7]。精确称取脱脂后山楂叶粉2 g放入直径90 mm培养皿中,加入蒸馏水,使之均匀润湿,静置一段时间,将充分润湿山楂叶粉放入微波炉,在微波功率为350 W条件下,微波90 s预处理,收集预处理后样品,备用[8]。
1.4.2 山楂叶多酚超声辅助提取工艺研究
1.4.2.1单因素试验
以多酚得率为测定指标,分别研究乙醇浓度(40%、50%、60%、70%、80%)、液料比(30∶1、40∶1、50∶1、60∶1、70∶1(mL·g-1))、超声温度(50、55、60、65、70℃)和超声时间(10、15、20、25、30 min)对山楂叶多酚得率的影响。
1.4.2.2响应面试验设计
根据单因素试验结果进行Box-Behnken试验设计[9],因素水平设计见表1。
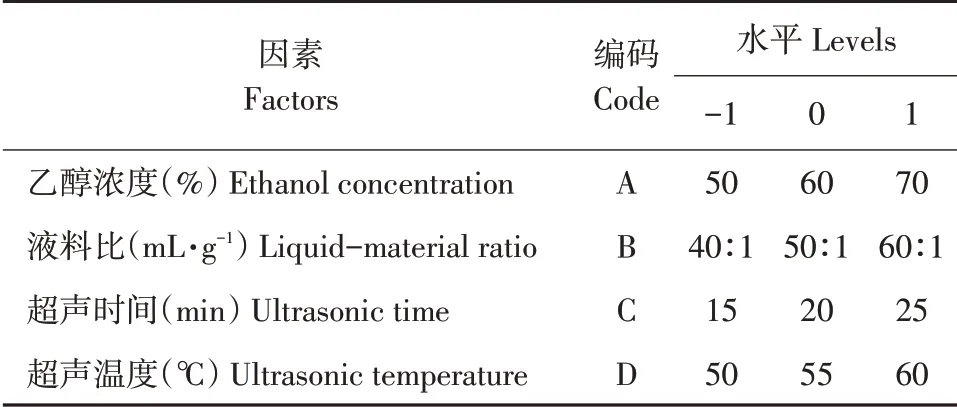
表1 响应面试验因素与水平Table 1 Response surface test factors and levels
1.4.2.3多酚得率测定
以没食子酸为标准品,采用Folin-Ciocalteu比色法(FC法)测定多酚含量[10]。
标准曲线回归方程为Y=0.133X+0.035,R2=0.9985,线性关系良好。根据标准曲线计算多酚浓度,计算公式如下:
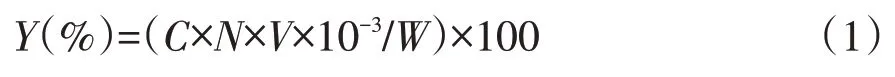
式中,Y为山楂叶提取液多酚得率(%);C为测定液多酚质量浓度(mg·mL-1);N为稀释倍数;V为提取液体积(mL);W为山楂叶干粉末质量(g)。
1.4.3 山楂叶多酚纯化处理
参照文献[11]方法,利用NKA-9大孔树脂纯化山楂叶多酚,上样液浓度为2 mg·mL-1,pH为5.0,体积为350 mL,进样流速为1 mL·min-1,充分吸附,采用120 mL 70%乙醇以1 mL·min-1速度动态洗脱,冷藏备用纯化后山楂叶多酚。
1.4.4 山楂叶多酚体外降糖效果
1.4.4.1山楂叶多酚对α-葡萄糖苷酶抑制作用
参照文献[12]方法,以α-葡萄糖苷酶抑制率为指标,阿卡波糖为对照,在波长为400 nm处检测,明确山楂叶多酚对α-葡萄糖苷酶抑制效果。
按如下公式计算:
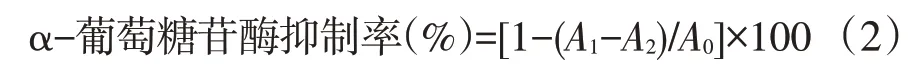
式中,A0为空白吸光值;A1为样品吸光值;A2为样品背景吸光值。
1.4.4.2山楂叶多酚对α-淀粉酶抑制作用
参照文献[13]方法,以α-淀粉酶抑制率为指标,阿卡波糖为对照,在波长为540 nm处检测,研究山楂叶多酚对α-淀粉酶抑制效果。
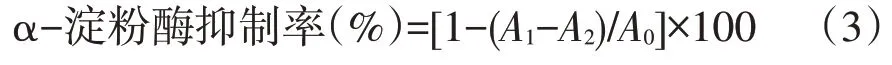
式中,A0为空白吸光度值,A1为样品吸光度值;A2为对照吸光度值。
1.4.5 山楂叶多酚体内降糖效果
1.4.5.1糖尿病小鼠模型的建立、分组与给药
取部分小鼠禁食12 h后,一次性腹腔注射STZ(320 mg·kg-1),72 h后,检测血糖,选取血糖浓度>11 mmol·L-1小鼠为合格糖尿病模型[14]。
取健康小鼠10只为正常对照组(Con),另取糖尿病小鼠60只分为模型组(Mod)、二甲双胍(60 mg·kg-1)对照组(Met)、山楂叶多酚600(H)、400(M)、200(L)mg·kg-1剂量组,每组10只;灌胃给药,1次·d-1,连续4周,给药期间检测相关指标。
1.4.5.2指标测定
给药期间,分别于第0、4、8、12、16、20、24、28天,小鼠禁食12 h,眼眶静脉取血,测定血糖含量;给药第28天,一次性灌胃葡萄糖2 g·kg-1,尾静脉取血测定0、0.5、1、2 h血糖含量;解剖小鼠称取适量肝脏、胰腺,检测肝糖原含量、肝脏及胰腺指数;按照试剂盒说明书,分别测定小鼠血清胰岛素水平、糖化血红蛋白含量、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性。
1.5 数据处理与分析
采用SPSS 23.0、Excel 2020和Design-Expert 8.0.6软件分析数据,通过ANOVA判定(Tukey′s检验)不同组间差异显著,通过t检验判定两组间显著性差异,P<0.05为显著性差异。
2 结果与分析
2.1 山楂叶多酚提取工艺研究
2.1.1 各单因素对山楂叶多酚得率的影响
由图1a可知,在40%~60%范围内,山楂叶多酚得率随乙醇浓度增加而增大,当乙醇浓度为60%时,多酚溶出量达高峰,多酚得率最高为0.63%,当乙醇浓度>60%,多酚得率逐渐下降。
液料比对山楂叶多酚得率影响如图1b所示,山楂叶多酚得率随液料比增加呈先增后减趋势,当液料比为50∶1时,多酚得率高达0.65%,继续增大液料比山楂叶多酚得率下降。
由图1c可知,温度升高,山楂叶多酚得率增加,超声温度55℃时,多酚得率最高,温度继续升高多酚得率反而下降。
超声时间对山楂叶多酚得率影响如图1d所示,随超声时间增加,山楂叶多酚得率先增后减,超声20 min时,多酚得率最高为0.68%,继续增加超声时间多酚得率下降。
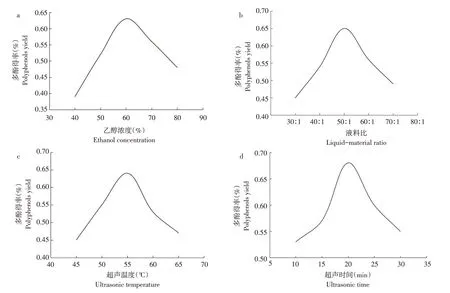
图1 各因素对山楂叶多酚得率的影响Fig.1 Effects of various factors on the yield of polyphenols from Hawthorn Leaves
2.1.2 响应面优化试验结果
2.1.2.1 Box-Behnken试验回归模型的建立及方差分析
选择乙醇浓度(A)、液料比(B)、超声时间(C)、超声温度(D)为自变量,山楂叶多酚得率为响应值,利用Box-Bohnken法优化提取试验。Box-Behnken试验结果见表2,方差分析见表3。
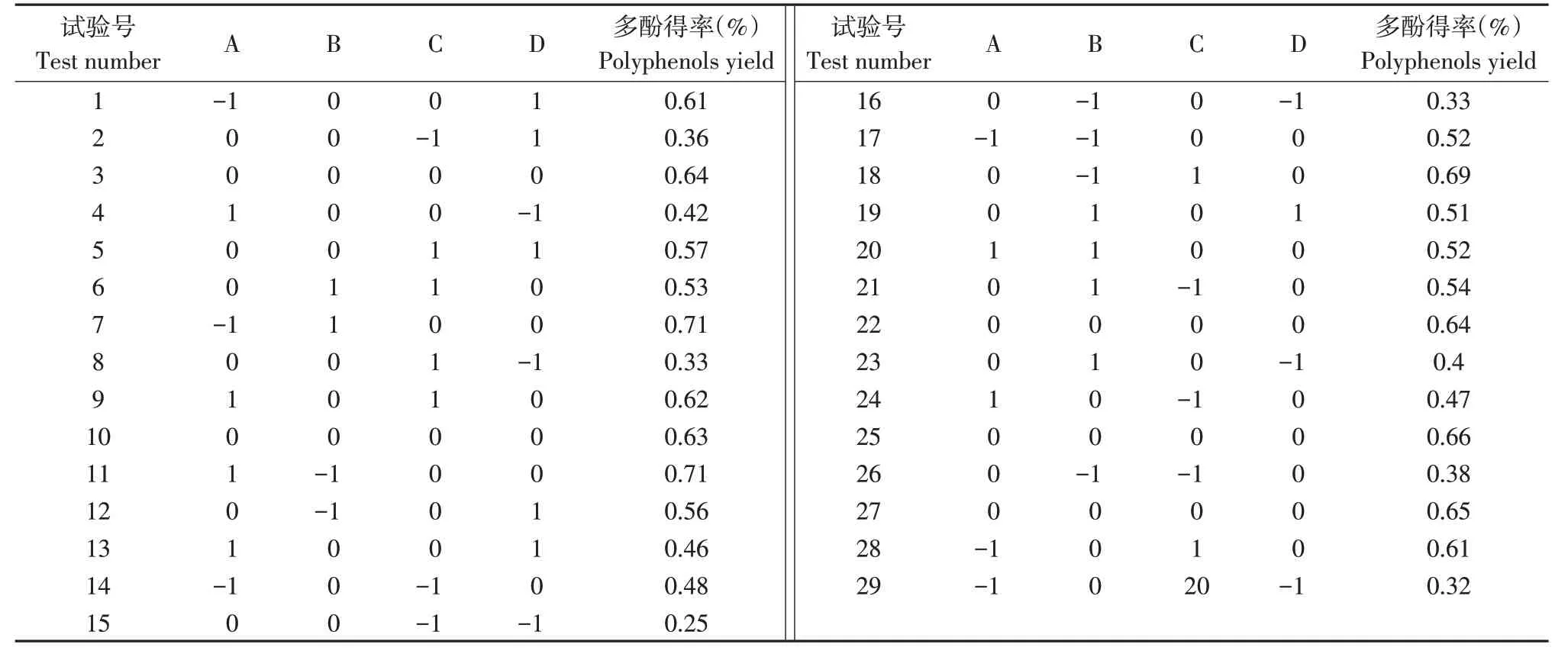
表2 响应面试验结果Table 2 Response surface test results
对表2中数据进行回归分析,得到二次回归模型如下:
多酚得率=0.64-4.167×10-3A+1.667×10-3B+0.072C+0.085D-0.095AB+5×10-3AC-0.063AD-0.080BC-0.030BD+0.032CD-0.012A2-0.018B2-0.089C2-0.18D2
由表3可知,模型P<0.0001,多酚得率与各自变量之间回归关系极显著,失拟项P=0.8335>0.05,不显著,说明该试验数据和模型符合度高,试验可靠。回归模型下,C、D、AB、AD、BC、BD、CD、A2、B2、C2、D2达 到差 异 极 显 著 水 平(P<0.01),A、B、AC差异不显著(P>0.05)。R2=0.9975,R2adj=0.9951,两系数较接近,说明得率理论值与实际值拟合良好。由F值可知,各因素对山楂叶多酚得率影响顺序为D(超声温度)>C(超声时间)>A(乙醇浓度)>B(液料比)。
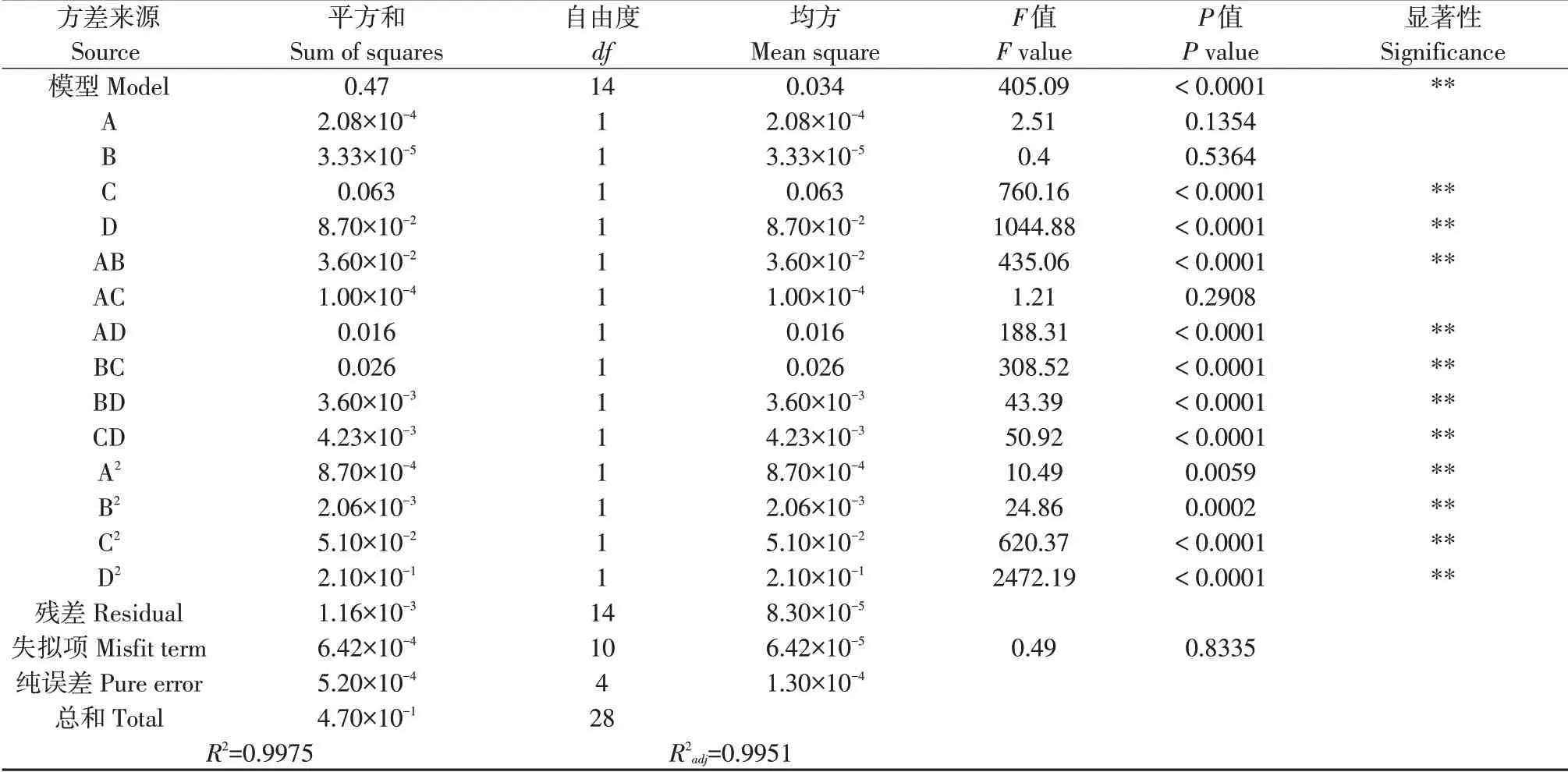
表3 Box-Behnken试验方差分析Table 3 Variance analysis of Box-Behnken test
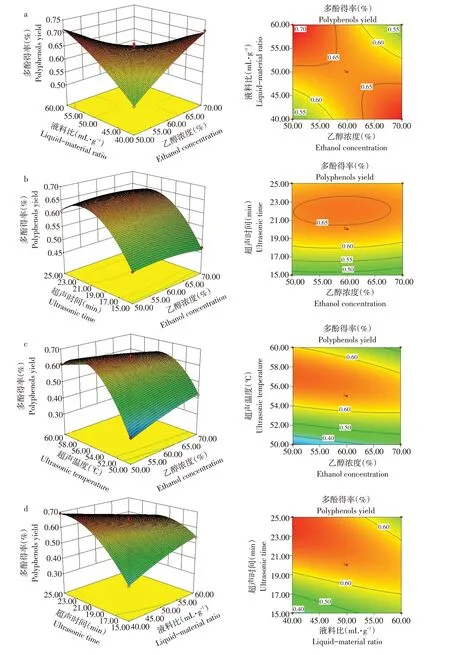
2.1.2.2响应面试验中交互项作用
由图2可知,乙醇浓度与液料比等高线呈马鞍形,乙醇浓度与超声时间、乙醇浓度与超声温度、液料比与超声时间、超声时间与超声温度等高线图呈椭圆形,说明4个因素两两间交互作用显著,其中超声时间与超声温度曲面图坡度最陡,说明二者之间交互作用对山楂叶多酚得率影响显著。
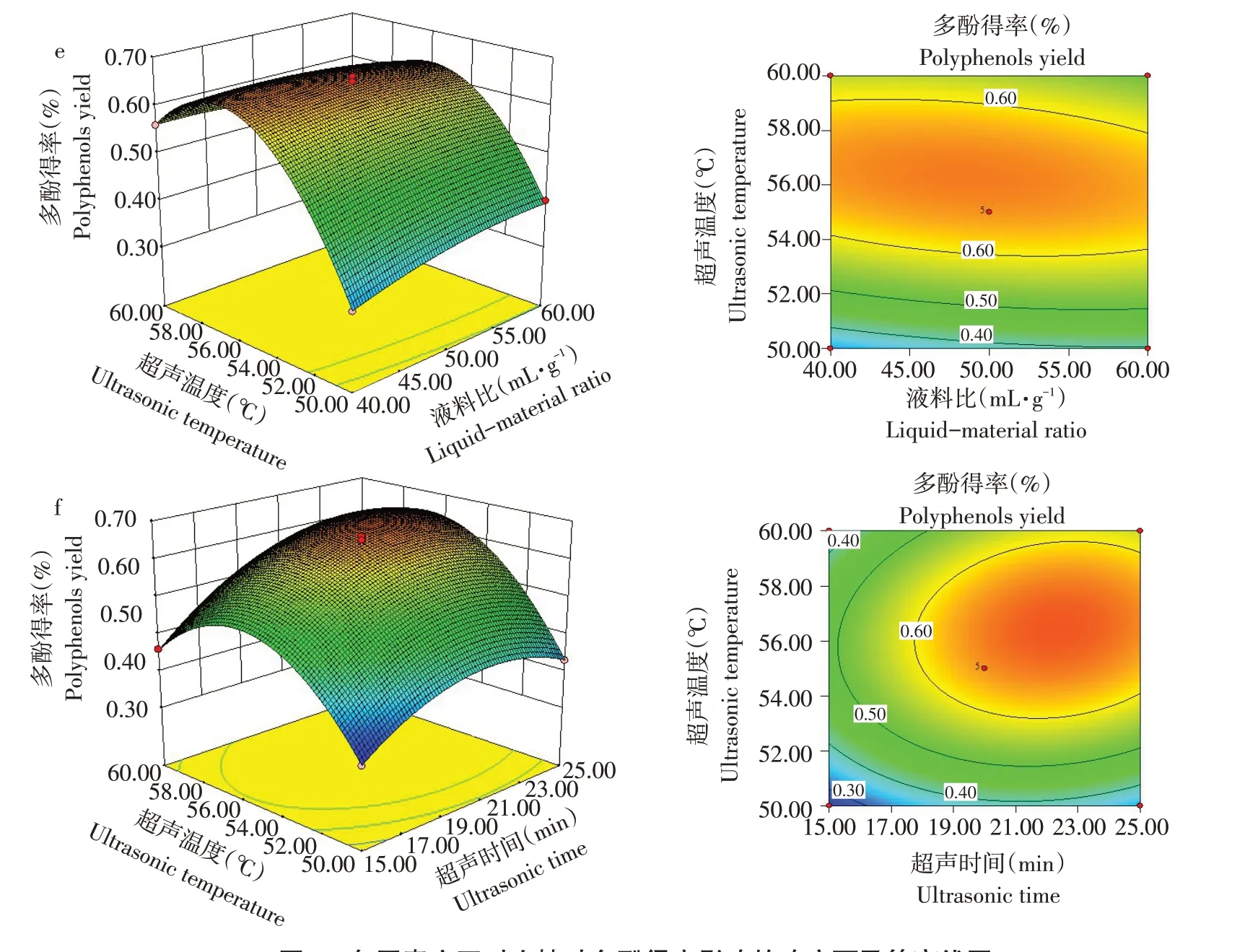
图2 各因素交互对山楂叶多酚得率影响的响应面及等高线图Fig.2 Response surface of interaction of various factors on polyphenols yield of hawthorn leaves
2.1.2.3提取工艺优化
通过响应面优化得到多酚提取最佳条件为乙醇浓度70.18%、液料比40.55∶1(mL·g-1)、超声时间24.98 min、超声温度56.39℃,多酚得率理论预测值为0.77%。为验证响应面试验结果,且便于实际操作,将条件调整为乙醇浓度70%、液料比40∶1(mL·g-1)、超声时间25 min、超声温度56℃,3次平行试验得到山楂叶多酚得率平均值为0.75%,结果与预测值接近,具有一定实用价值。
2.2 山楂叶多酚体外降糖研究
2.2.1 山楂多酚对α-淀粉酶活性的影响
由图3可知,随山楂叶多酚浓度增加,其对α-淀粉酶抑制作用逐渐增强,山楂叶多酚IC50为1.05 mg·mL-1,低于阿卡波糖1.33 mg·mL-1,在浓度为4.5 mg·mL-1时,山楂叶多酚对α-淀粉酶抑制率可达88.5%。尹国利等研究表明,苦丁茶多酚对α-淀粉酶抑制IC50值为1.31 mg·mL-1[15],本研究制备的山楂叶多酚对α-淀粉酶抑制效果与其研究结果相近,说明山楂叶多酚可有效抑制α-淀粉酶活性,可作为较强α-淀粉酶活性抑制剂。
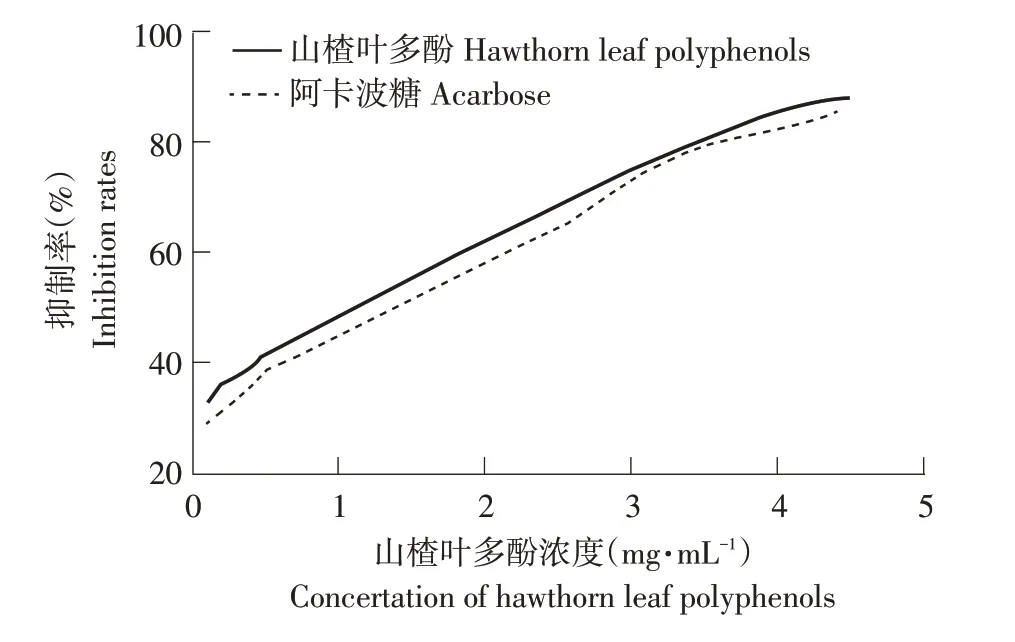
图3 山楂叶多酚对α-淀粉酶抑制作用Fig.3 Inhibitory effect of hawthorn leaf polyphenols on α-amylase
2.2.2 山楂多酚对α-葡萄糖苷酶活性的影响
由图4可知,山楂叶多酚浓度增加,其对α-葡萄糖苷酶抑制率也增大,山楂叶多酚IC50为1.89 mg·mL-1,低于阿卡波糖2.01 mg·mL-1,在浓度为4.5 mg·mL-1时,抑制率可达82.8%。尹国利等研究结果显示,苦丁茶多酚对α-葡萄糖苷酶抑制IC50为1.15 mg·mL-1[15];林宝妹等研究表明,嘉宝果叶片多酚提取物对α-葡萄糖苷酶抑制IC50值小于阿卡波糖[16],本研究制备山楂叶多酚对α-葡萄糖苷酶抑制效果与上述研究结果相近。说明山楂叶多酚可作为较好α-葡萄糖苷酶活性抑制剂。
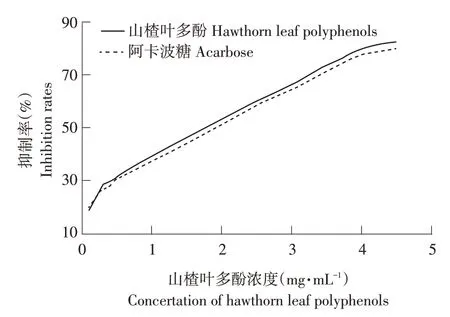
图4 山楂叶多酚对α-葡萄糖苷酶抑制作用Fig.4 Inhibitory effect of hawthorn leaf polyphenols on α-glucosidase
2.3 山楂叶多酚体内降糖研究
2.3.1 山楂叶多酚对糖尿病小鼠血糖值的影响
由图5可知,第0天时,与正常组相比,模型组小鼠FBG显著增加(P<0.05),此时糖尿病小鼠FBG大于11.1 mmol·L-1,表明造模成功。
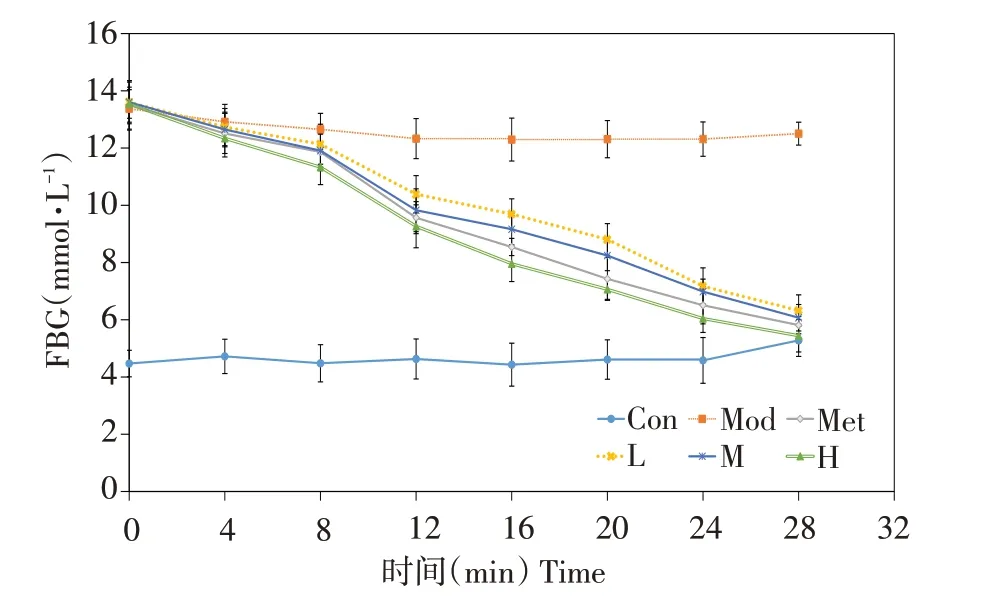
图5 山楂叶多酚对糖尿病小鼠血糖值的影响Fig.5 Effects of hawthorn leaf polyphenols on blood glucose level in diabetic mice
喂养过程中,正常组和模型组FBG均无明显变化,而对照组和山楂叶多酚各剂量组FBG逐渐下降,高剂量组与对照组下降幅度最大,且在第4天后高剂量组FBG低于对照组,说明山楂叶多酚各剂量组对糖尿病小鼠有降低空腹血糖值作用,高剂量组作用更为显著。
2.3.2 山楂叶多酚对糖尿病小鼠糖耐量的影响
由图6a可知,口服葡萄糖溶液后,小鼠血糖值呈先升后降趋势,在30 min时,各组血糖达到峰值,其中糖尿病小鼠组血糖升高明显,均高于18 mmol·L-1,正常组血糖升高不明显,在10 mmol·L-1以下。随时间延长,各组血糖迅速下降,120 min时,高剂量组和对照组血糖值与正常组最接近,中剂量组比正常组稍高,而低剂量组和模型组仍高于15 mmol·L-1。可见,高剂量山楂叶多酚对改善糖尿病小鼠糖耐量效果最显著,中剂量稍差,低剂量作用不明显。
由葡萄糖曲线下面积AUC图6b可知,对照组和各剂量组均可一定程度降低AUC,高剂量和对照组降低最为显著(P<0.01),与正常组接近,且显著低于模型组,而低剂量组降低程度最小,AUC与模型组接近,说明山楂叶多酚能够提高糖尿病小鼠的葡萄糖耐受能力,高剂量组能力更强。
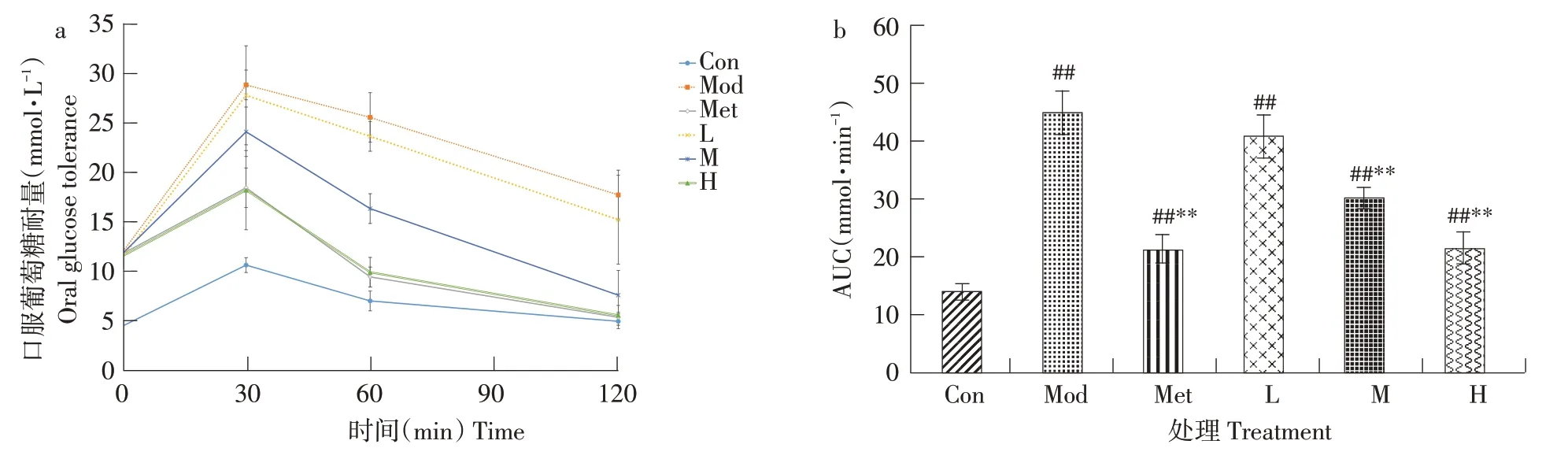
图6 山楂叶多酚对糖尿病小鼠糖耐量的影响Fig.6 Effects of hawthorn leaf polyphenols on glucose tolerance in diabetic mice
2.3.3山楂叶多酚对糖尿病小鼠血清胰岛素水平的影响
由图7a可知,模型组血清胰岛素含量(8.22 mIU·L-1)比正常组(4.95 mIU·L-1)高,且差异显著(P<0.01),与模型组相比较,给药组均明显降低(P<0.01),且高剂量组与对照组接近,可有效降低小鼠血清胰岛素水平。
由图7b、7c可知,与正常对照组比较,模型组HOMA-IR明显升高(P<0.01),HOMA-IS明显降低(P<0.01),说明胰岛素抵抗升高,受体敏感性降低。给药剂量组均可降低HOMA-IR,增加HOMAIS,且高剂量组效果最显著。因此,山楂叶多酚可有效降低小鼠血清胰岛素水平,缓解胰岛素抵抗,且呈剂量依赖性。
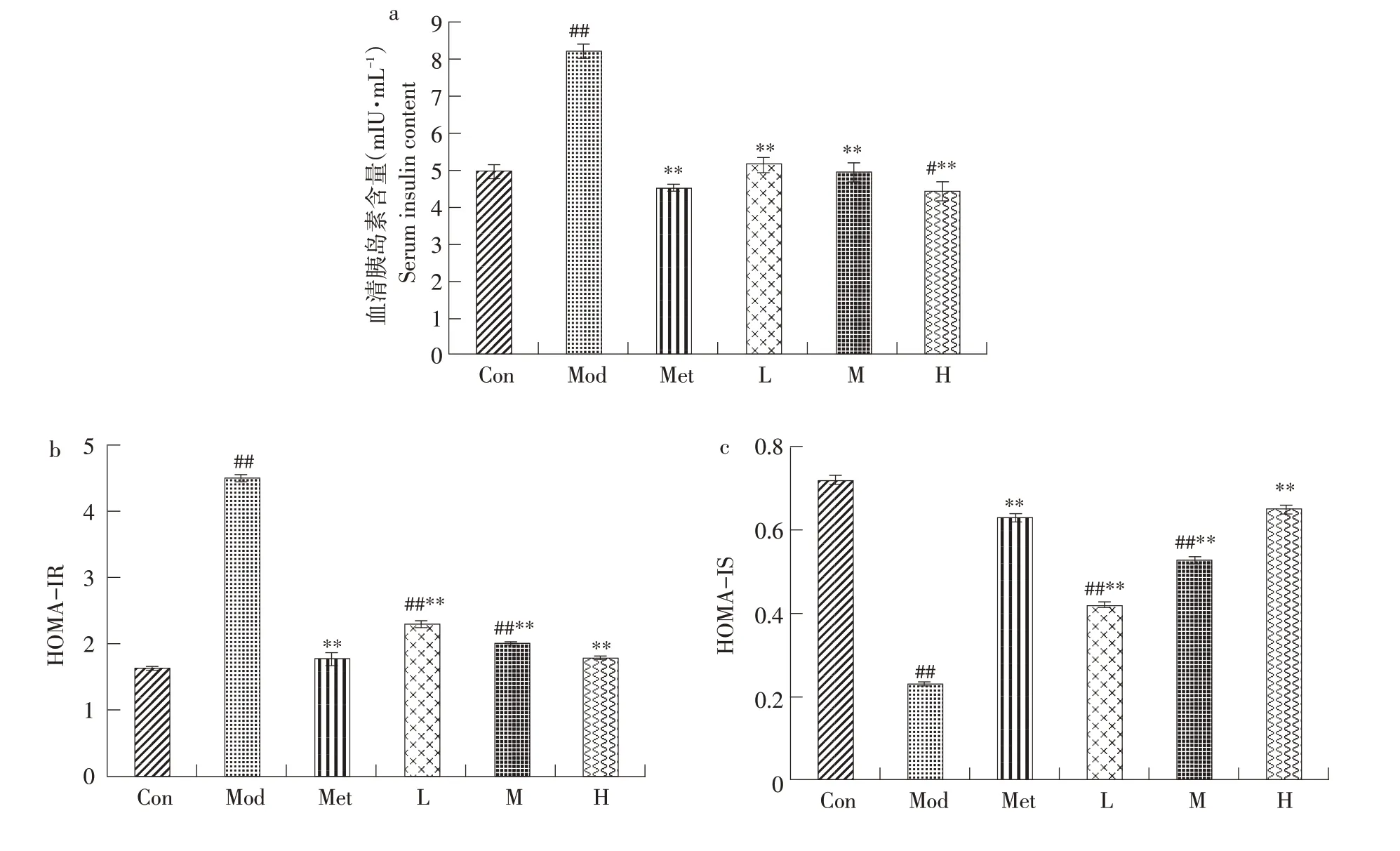
图7 山楂叶多酚对糖尿病小鼠血清胰岛素水平的影响Fig.7 Effects of hawthorn leaf polyphenols on serum insulin level in diabetic mice
2.3.4 山楂叶多酚对糖尿病小鼠血清糖化血红蛋白的影响
由图8可知,模型组小鼠血清糖化血红蛋白(GHb)与正常组小鼠相比显著升高(P<0.01),GHb结果与空腹血糖结果一致。对照组和山楂叶多酚各剂量组血清GHb比模型组小鼠明显降低(P<0.01),且给药组随用药剂量增加,血清GHb值逐渐下降,高剂量组与对照组更接近正常水平。说明高剂量山楂叶多酚有效改善糖尿病小鼠持续高血糖状态。
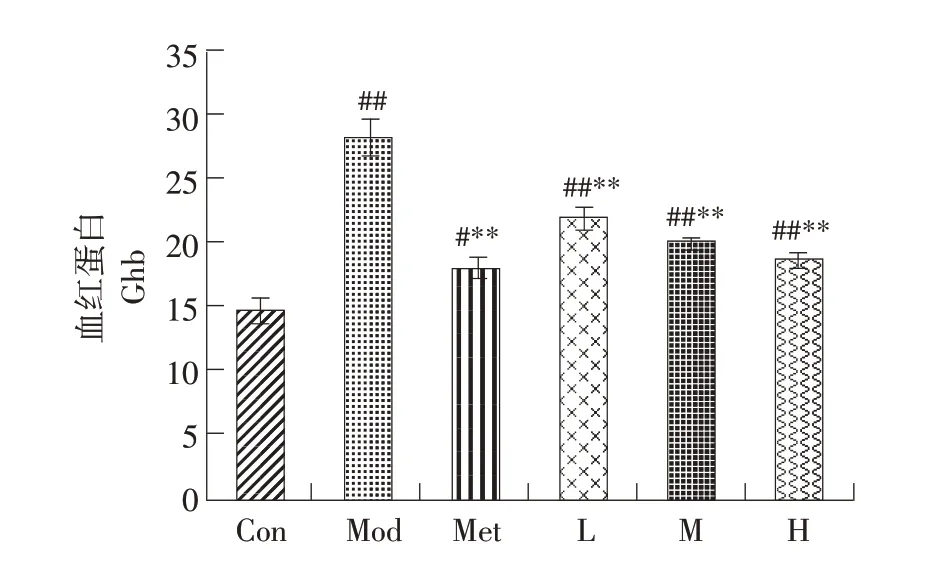
图8 山楂叶多酚对糖尿病小鼠血清糖化血红蛋白的影响Fig.8 Effects of hawthorn leaf polyphenols on serum glycosylated hemoglobin in diabetic mice
2.3.5 山楂叶多酚对糖尿病小鼠肝糖原含量的影响
如图9所示,与正常组(15.28 mg·g-1)比较,模型组(14.85 mg·g-1)肝糖原含量下降,但差异不显著。对照组和山楂叶多酚各剂量组均可提高小鼠肝糖原含量,且高剂量组肝糖原含量与模型组相比升高显著(P<0.01)。由此可知山楂叶多酚能提高体内肝糖原含量,降低血糖。
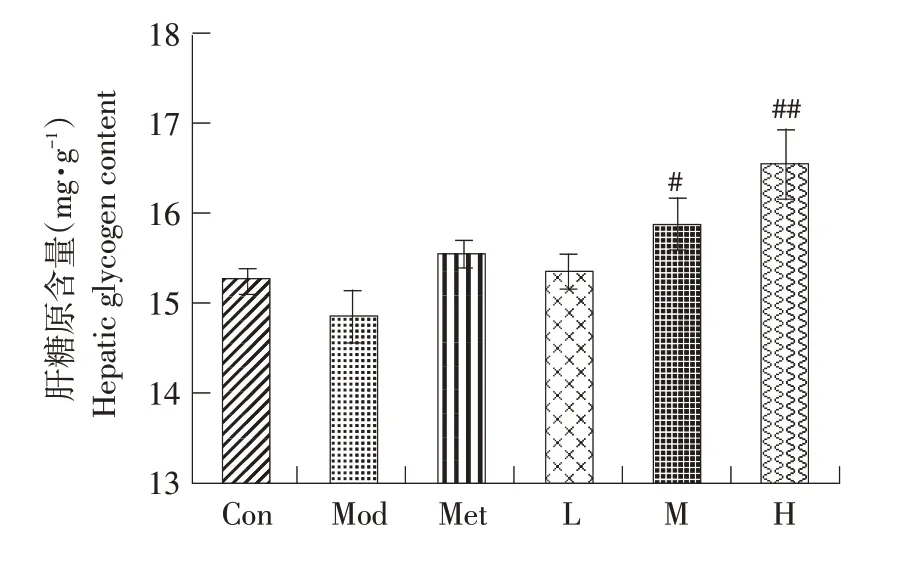
图9 山楂叶多酚对糖尿病小鼠肝糖原含量的影响Fig.9 Effects of hawthorn leaf polyphenols on liver glycogen content in diabetic mice
2.3.6 山楂叶多酚对糖尿病小鼠肝脏、胰腺指数的影响
由图10a可知,与正常组相比,模型组小鼠肝脏指数上升显著(P<0.01),与模型组相比,山楂叶多酚低、中剂量组及对照组小鼠肝脏指数显著降低(P<0.01),说明山楂叶多酚可缓解糖尿病小鼠肝脏病变损伤。
图10b显示,较正常组比较,模型组小鼠胰腺指数显著降低(P<0.01),与模型组相比,对照组和山楂叶多酚各剂量组小鼠的胰腺指数显著升高(P<0.01),与对照组相比,山楂叶多酚低剂量组差异明显,说明山楂叶多酚可降低小鼠胰腺病变。
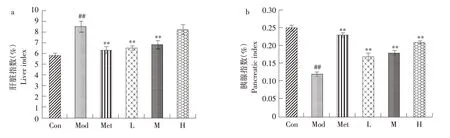
图10 山楂叶多酚对糖尿病小鼠肝脏、胰腺指数的影响Fig.10 Effects of hawthorn leaf polyphenols on liver and pancreatic index of diabetic mice
2.3.7 山楂叶多酚对糖尿病小鼠血清ALT和AST含量的影响
图11可知,模型组ALT和AST活性较正常组明显增强(P<0.01),与模型组相比,给药组活性均降低,且高剂量组ALT和AST活性下降更明显(P<0.01),活性与正常组接近,说明其对肝细胞保护效果最佳,由此可见,山楂叶多酚有效抑制肝细胞中ALT和AST释放,有助于修复糖尿病小鼠受损肝细胞,对糖尿病小鼠肝脏具有良好保护作用。
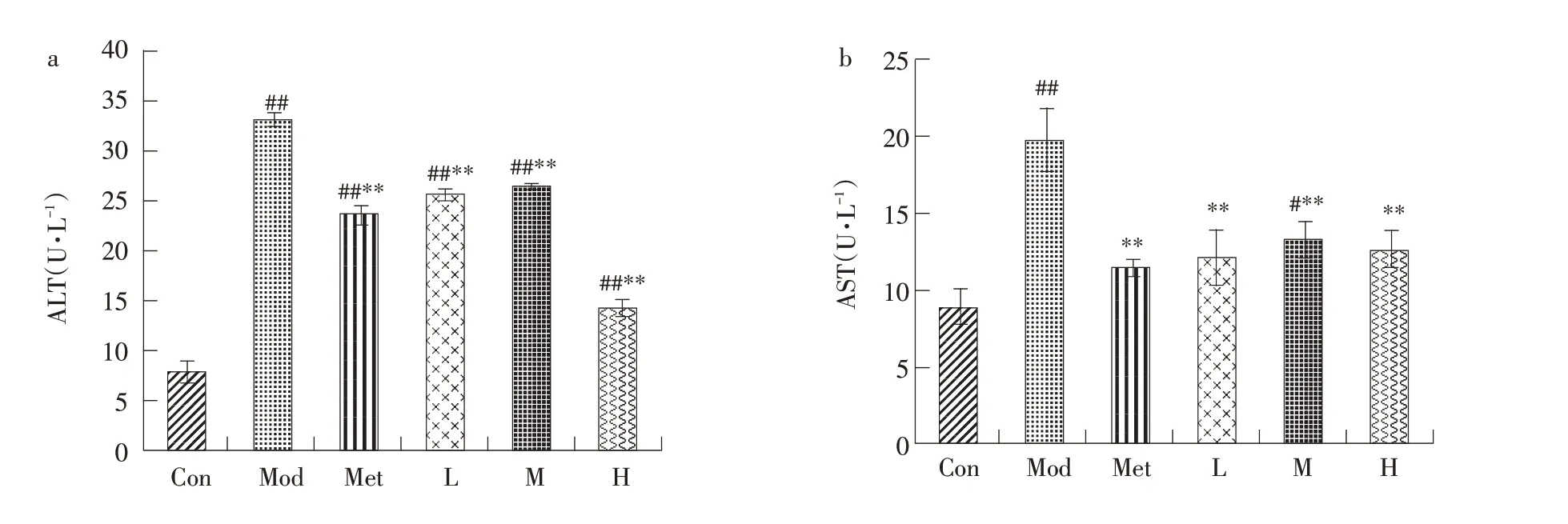
图11 山楂叶多酚对糖尿病小鼠血清ALT和AST含量的影响Fig.11 Effects of hawthorn leaf polyphenols on serum ALT and AST levels in diabetic mice
4 讨论与结论
微波、超声辅助提取均具有时间短、效率高以及提取物生物活性高的特点。陈旭等研究仅采用超声辅助提取山楂叶多酚,得率为0.65%[17],本研究结合二者优点,采用微波-超声联合辅助提取山楂叶多酚,得率增加至0.75%,且提取多酚降糖活性与已往结果相近[17],说明本研究提取方法可保护其活性,提高多酚提取效率。
影响多酚得率主要因素是乙醇浓度、液料比、超声温度和超声时间,山楂叶多酚得率随各因素增大呈相似变化趋势,即先增后减,因为多酚与乙醇水体系极性相近,当乙醇浓度增加、液料比增大、超声时间延长时,山楂叶与乙醇充分接触,山楂叶多酚溶解度增大使得山楂叶多酚溶出量增加;同时超声温度升高,多酚分子运动速度加快,加速多酚溶出,直至多酚溶出量达到饱和;然而,当进一步增加乙醇浓度、液料比、延长超声时间时,其他醇溶杂质溶出量随之增加,且温度过高加剧多酚氧化而破坏其结构,导致多酚得率下降。该结论与刘永等和许玲玉等研究结论一致[18-19]。
糖尿病是一种常见代谢性疾病,发病率逐年增加,主要表现为血糖升高。碳水化合物进入机体后,在α-淀粉酶和α-葡萄糖苷酶作用下水解为葡萄糖,导致血糖升高,因此,抑制这两种酶的活性,可降低葡萄糖进入血液速率。本文通过测定优化工艺后提取的山楂叶多酚对α-淀粉酶和α-葡萄糖苷酶抑制率,评价其体外降糖活性,结果显示其对两种酶抑制作用随山楂叶多酚浓度增加逐渐增强,且稍高于阿卡波糖,在其浓度为4.5 mg·mL-1时,对α-淀粉酶和α-葡萄糖苷酶抑制率分别为88.5%和82.8%,该结论与尹国利和林宝姝研究结果相近[15-16],说明提取的山楂叶多酚有较强体外降糖作用;为进一步验证山楂叶多酚降糖效果,进行小鼠体内试验,结果显示山楂叶多酚有效降低糖尿病小鼠空腹血糖、血清胰岛素水平、GHb含量、肝脏指数及ALT和AST活性,提高小鼠肝糖原含量、胰腺指数,呈剂量依赖,且高剂量山楂叶多酚组能力更强,说明山楂叶多酚具有较好体内降糖活性,与赵梦雅等研究结果相近[14]。
本研究通过响应面试验优化微波-超声提取山楂叶多酚,乙醇浓度70%、液料比40∶1(mL·g-1)、超声时间25 min、超声温度56℃时,山楂叶多酚得率为0.75%;体外试验结果显示,山楂叶多酚体外对α-淀粉酶和α-葡萄糖苷酶具有较强抑制作用;体内试验结果表明,山楂叶多酚具有较好体内降糖能力,且高剂量时降糖效果更佳。
