超声波辅助提取泡桐花总黄酮工艺及抑菌活性研究
2022-09-23刘璐付嘉阳邓红霞
刘璐,付嘉阳,邓红霞
(1.西北农林科技大学化学与药学院,陕西 杨凌 712100;2.陕西省粮油科学研究院,西安 710082)
泡桐为玄参科泡桐属多年生落叶乔木,共有9种,除新疆北部、内蒙、西藏、东北北部外,我国均有分布。泡桐花为泡桐的干燥花,是传统中草药之一。临床上对呼吸道感染、急性肠炎等有良好治疗效果。泡桐花活性成分包含多糖、多酚、总黄酮类等物质。研究表明,总黄酮有抗肿瘤、抗炎、抗氧化等活性功能[1]。我国泡桐花资源存量大,年产量达5×104t,具有一定开发利用价值。
目前泡桐花总黄酮常用提取方法有乙醇提取法、热水提取法和微波提取法等。孟志芬等通过乙醇浸提泡桐花总黄酮,采用乙醇浓度70%,料液比1∶14,浸提温度80℃,浸提时间1 h时,总黄酮得率为5.29%[2]。徐立丽通过热水提取泡桐花活性成分,料液比1∶15,常温浸泡2 h,80℃浸提1 h后取滤渣再次浸提1 h,泡桐花水提物得率为11.20%[3]。目前已报道泡桐花总黄酮提取方法中,溶剂提取法仪器设备简单、操作简便,但提取时间长、效果差[4]。超声波辅助提取法有提取条件易控制、温度低、耗时短、能耗低、总黄酮得率高等优点[5]。本文通过单因素试验和响应面法研究超声波辅助提取泡桐花总黄酮工艺,以泡桐花总黄酮得率为响应值,探究泡桐花总黄酮最佳提取工艺条件,评价其抑菌效果,为开发与利用泡桐花总黄酮提供技术参数。
1 材料与方法
1.1 材料与设备
1.1.1 供试样品及菌种
泡桐花于2021年5月采自陕西省杨凌区,经阴干、粉碎过20目筛备用。金黄色葡萄球菌(CVCC639)、链球菌(CVCC1622)、沙门氏杆菌(CVCC542)、大肠埃希菌(CVCC83003)均由西北农林科技大学动物医学院微生物保种室提供。
1.1.2 试验试剂及设备
芦丁(标准品,≥98%,CAS号:153-18-4,购自成都埃法生物科技有限公司);硝酸铝、亚硝酸钠、氢氧化钠、氯化钠、无水乙醇等均为分析纯;蛋白胨、琼脂粉、牛肉膏等均为生化试剂。
QYRE-501旋转蒸发仪(购自上海秋佐科学仪器有限公司)、KQ-400DE型数控超声波清洗器(购自昆山市超声仪器有限公司)、UV-1800紫外可见分光光度计(购自上海精若科学仪器有限公司)、DHP-500恒温培养箱(购自上海精胜科学仪器有限公司)。
1.2 方法
1.2.1 泡桐花总黄酮提取
称量30 g泡桐花干粉,按料液比1∶15,使用乙醇进行超声波辅助提取,提取后滤除残渣,滤液以6 000 r·min-1离心10 min,取上清液备用。
1.2.2 泡桐花总黄酮含量测定和总黄酮得率计算
泡桐花总黄酮含量参考文献[6]方法。配制不同浓度芦丁溶液,在510 nm波长处测定芦丁溶液吸光度,绘制标准曲线,其回归方程为A=9.2654C-0.0054,R2=0.9996。吸取2 mL泡桐花总黄酮溶液加至10 mL容量瓶,75%乙醇定容至刻度,按照标准曲线方法计算总黄酮得率,计算公式如下:
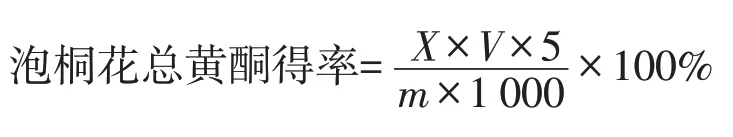
式中,X为计算得出的总黄酮质量浓度;V为提取液定容后体积;5为稀释倍数;m为泡桐花样品质量。
1.2.3 泡桐花总黄酮提取单因素试验
以泡桐花总黄酮得率为测定指标,研究乙醇浓度、提取时间、提取功率、提取温度单一因素对其得率的影响,每次3个重复(见表1)。
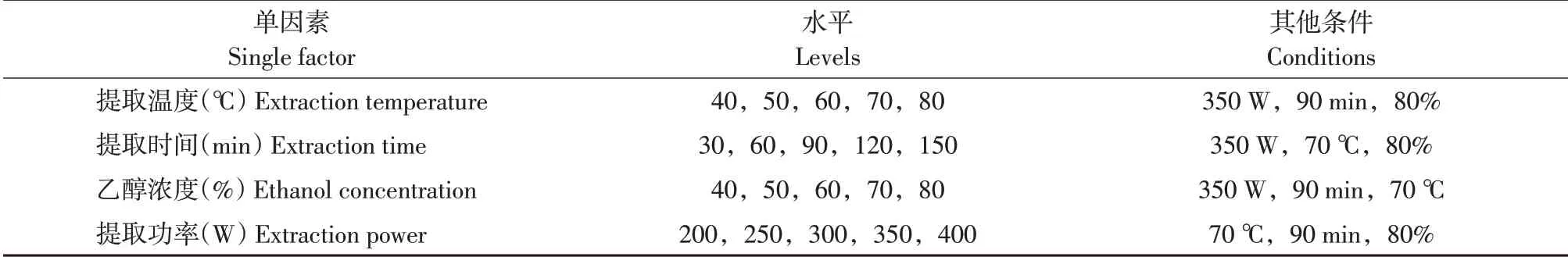
表1 单因素试验因素水平Table 1 Factors and levels of single factor experiment
1.2.4 响应面优化试验设计
选取提取功率(A)、提取时间(B)、乙醇浓度(C)、提取温度(D)为自变量,以总黄酮得率为响应值,应用Design-Expert 12软件设计4因素3水平共29个试验(见表2)。

表2 Box-Behnken设计试验因素水平及其编码Table 2 Factors and levels in the Box-Behnken design
1.2.5 泡桐花总黄酮不同提取方法比较
1.2.5.1乙醇提取法
称取样品5 g,置于圆底烧瓶,75%乙醇作为溶剂,料液比1∶15,在60℃恒温水浴锅上提取60 min,以6 000 r·min-1离心10 min,取上清液作为待测液,按1.2.2的方法测定总黄酮含量及得率,重复3次。
1.2.5.2热水提取法
称取样品5 g,加入蒸馏水,料液比1∶15,80℃浸提60 min,以6 000 r·min-1离心10 min,取上清液作为待测液,按1.2.2方法测定总黄酮含量及得率,重复3次。
1.2.6 泡桐花总黄酮抑菌作用测定
1.2.6.1泡桐花总黄酮体外抑菌作用测定
采用纸片扩散法[7],减压浓缩泡桐花总黄酮提取液至膏状,冷冻干燥。试验前用10%二甲基亚砜水溶液按两倍稀释法将其稀释为100~0.1 mg·mL-1不同浓度,无菌药敏试纸浸泡到不同浓度总黄酮药液1 h后,烘干备用。
普通琼脂平板上涂抹菌液(细菌浓度为1.0×106CFU·mL-1),药敏纸片放平板内,每次3个重复,同时设空白阴性(生理盐水)和阳性对照(庆大霉素,药敏试纸含10 μg·片-1)。培养20 h后测量抑菌圈直径。抑菌圈试验判定标准:抑菌圈直径≥20 mm,极强抑菌作用(++++);15 mm≤抑菌圈直径<20 mm,强抑菌作用(+++);10 mm≤抑菌圈直径<15 mm,中度敏感(++);6 mm≤抑菌圈直径<10 mm,弱抑菌作用(+);抑菌圈直径≤6 mm,无抑菌作用(-)。
1.2.6.2泡桐花总黄酮MIC和MBC测定
采用微量稀释法[8],每孔加入100 μL M-H肉汤;每行第1孔加入100 μL泡桐花总黄酮提取液,混匀吸出100 μL加入第2孔,连续稀释至10孔,阳性对照(仅添加试验菌种)为第11孔,阴性对照(仅添加M-H肉汤)为第12孔;在1~11孔加入10 μL菌液,封板,37℃培养24 h,培养液清澈透亮,表明无细菌生长,该浓度即为MIC。将MIC及以上浓度的培养物接种于营养琼脂,培养24 h,无菌落生长的最低浓度为MBC。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对总黄酮得率的影响
由图1a可知,在超声功率350 W,料液比1∶15,80%乙醇浓度,超声提取90 min,提取温度40~80℃条件下,泡桐花总黄酮得率随超声温度改变。温度70℃时,总黄酮提取得率为6.37%;继续升高温度,由于温度过高导致总黄酮化合物降解,得率反而降低。
2.1.2 提取时间对总黄酮得率的影响
从图1b可见,在超声功率350 W,料液比1∶15,80%乙醇浓度,提取温度70℃,超声提取时间30~150 min条件下,泡桐花总黄酮得率随超声时间改变。在90 min内,总黄酮得率随提取时间增加而提高;提取时间超过90 min时,提取液中杂质不断增加,总黄酮得率开始降低。
2.1.3 乙醇浓度对总黄酮得率的影响
图1c表明,在超声功率350 W,料液比1∶15,提取温度70℃,超声提取90 min,40%~80%乙醇浓度条件下,泡桐花总黄酮得率随乙醇浓度改变。乙醇浓度为40%~60%时,总黄酮得率随乙醇浓度升高而增加;当乙醇浓度为60%~80%,总黄酮得率趋势较平缓,且在80 %浓度时达到最大值。
2.1.4 提取功率对总黄酮得率的影响
由图1d可知,在提取温度70℃,料液比1∶15,80%乙醇浓度,超声提取90 min,超声功率200~400 W条件下,泡桐花总黄酮得率随超声功率改变。超声功率为200~350 W时,总黄酮得率随超声功率增加而增大;当超声功率大于350 W时,总黄酮得率逐渐降低。
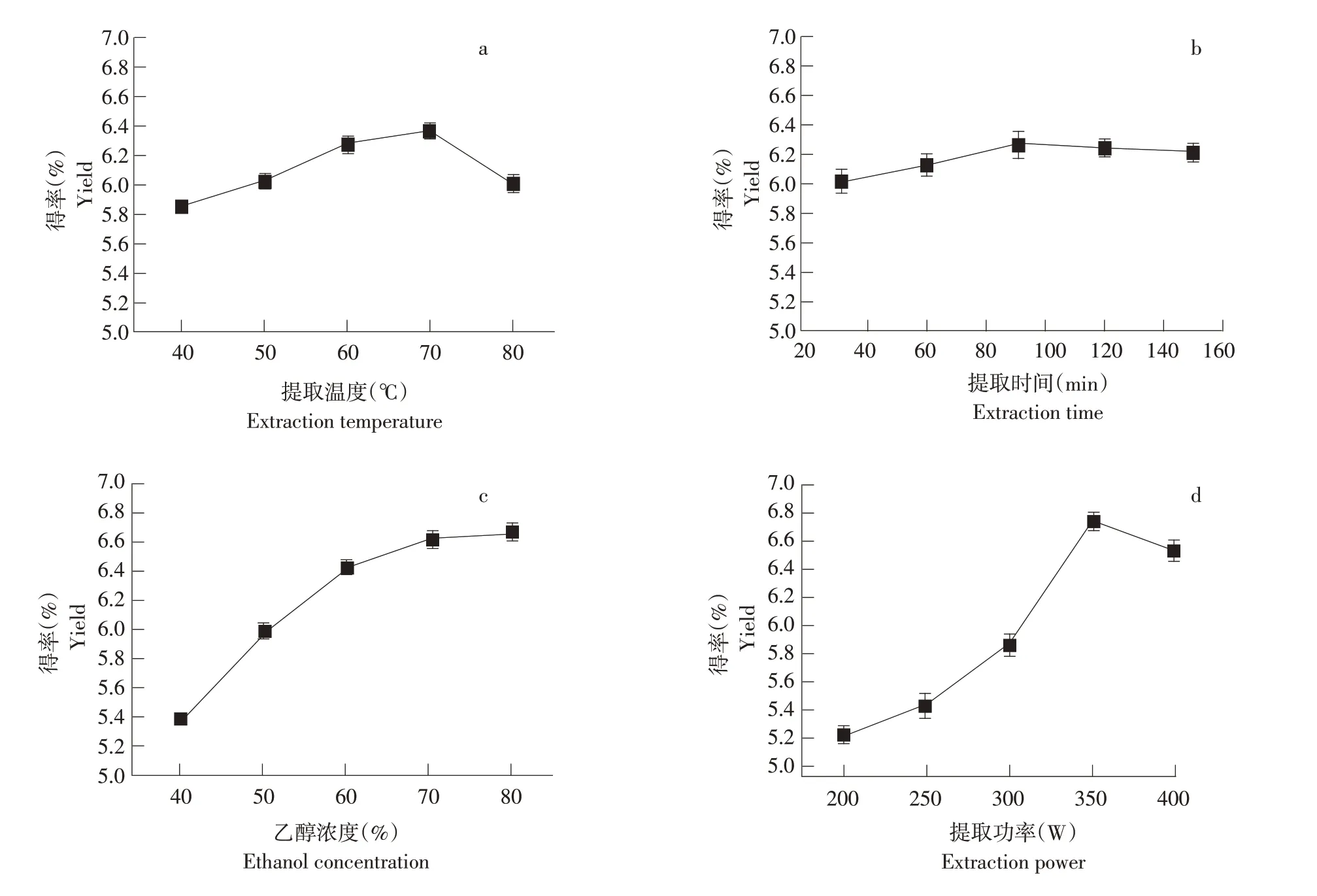
图1 不同因素对总黄酮得率的影响Fig.1 Effects of different factors on the flavonoid yield
2.2 响应面试验结果及方差分析
2.2.1 模型拟合与数据分析
利用Design-Expert 12软件设计响应面试验方法(见表3)。采用多元回归模型分析试验数据,获得回归方程:Y=7.36+0.03A-0.0333B+0.0392C-0.0025D+0.04AB-0.06AC+0.13AD-0.1BC-0.02BD-0.3075CD-0.0246A2+0.0904B2-0.2908C2-0.1658D2。对回归方程进行显著性检验及方差分析,结果见表4。模型P值<0.0001,表明模型有统计显著性。失拟项P值为0.5886,表明模型有效。试验所选模型决定系数R2=0.9793(P<0.01),模型可解释97.93%响应值变化,表明该模型拟合程度较好。模型R2Adj=0.9586,表明不确定因素干扰提取试验的可能性较小,总变异仅4.14%。一次项A、B提取因素影响显著(P<0.05),C提取因素影响极显著(P<0.01);AC交互项影响显著(P<0.05),AD、BC、CD极显著影响泡桐花总黄酮提取(P<0.01);B2、C2、D2极显著影响泡桐花总黄酮提取(P<0.01)。提取因素对总黄酮得率影响程度为乙醇浓度>提取时间>提取功率>超声温度。
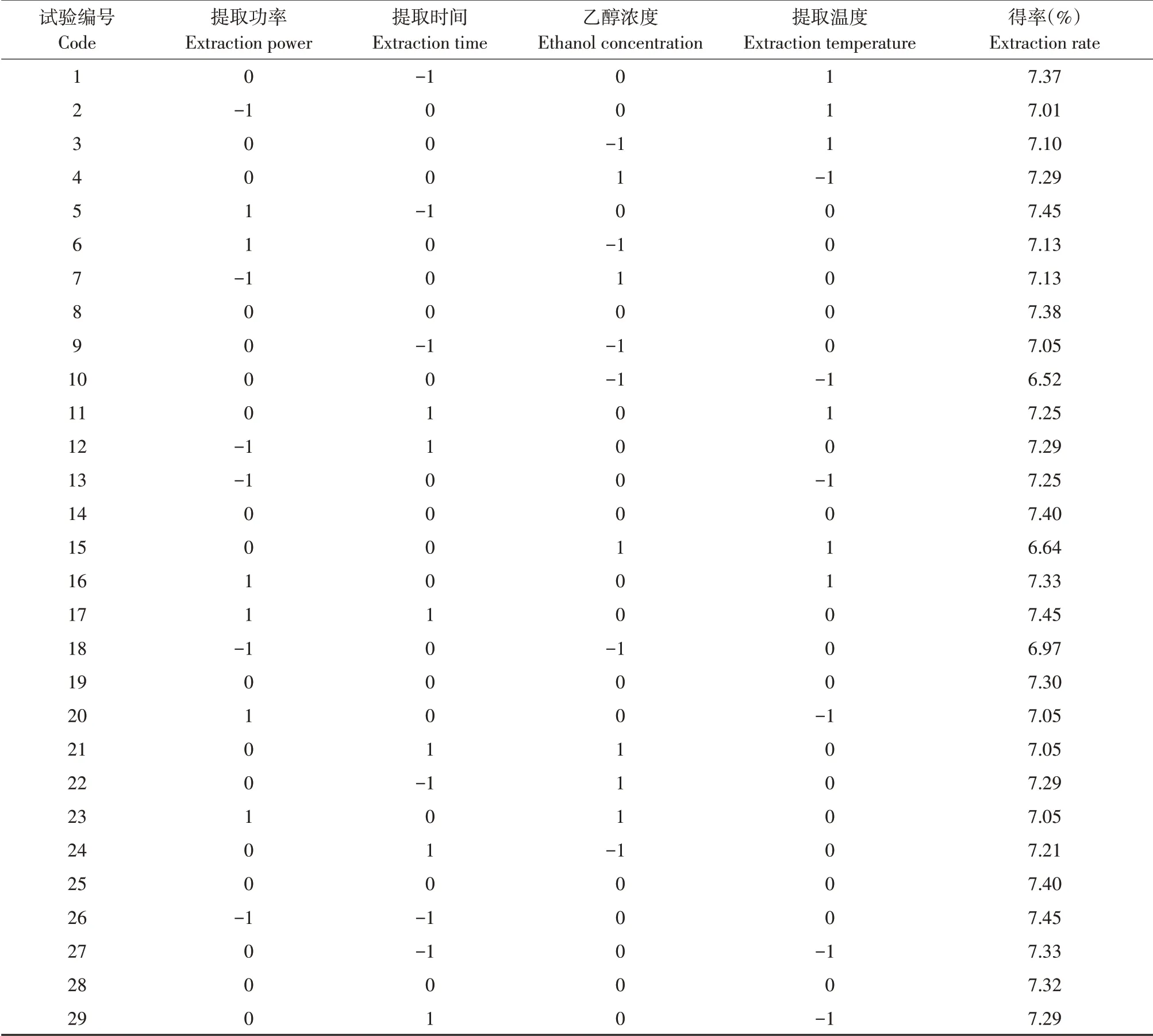
表3 响应面试验结果Table 3 Results of response surface methodology
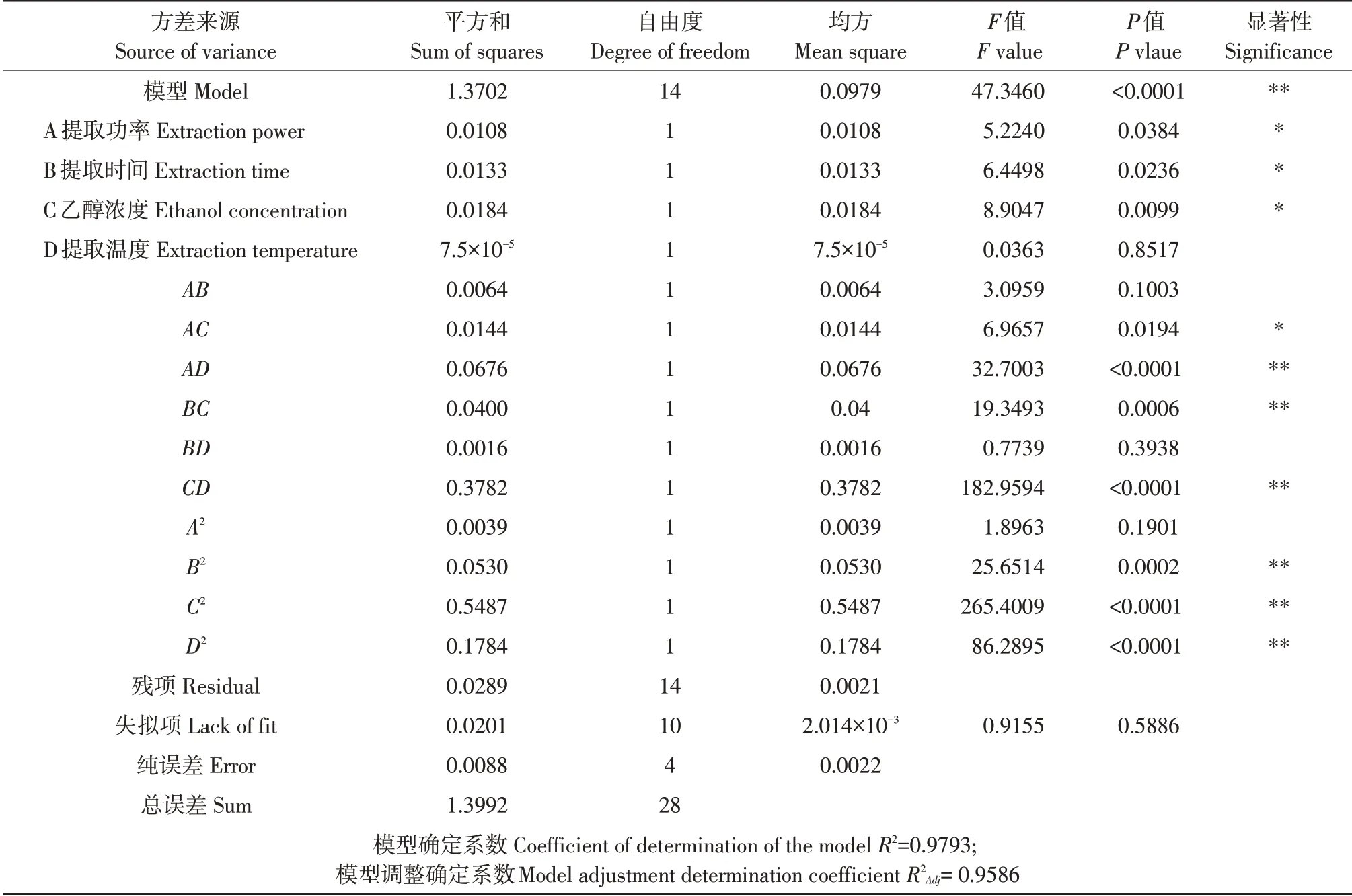
表4 回归模型方差分析Table 4 Regression equation fitting and variance analysis
2.2.2 响应面分析
由回归方程绘制不同因子响应面图,以评价两两交互作用对总黄酮得率的影响并确定各因素最佳水平范围,如图2所示。由图2a可知,当功率一定时,总黄酮得率随提取时间延长而持续增加;而当时间一定时,总黄酮得率随功率变化较为平缓,因此提取时间对总黄酮得率影响较大。由图2b可知,当乙醇浓度一定时,总黄酮得率随功率变化曲线较为平缓;当功率一定时,总黄酮得率随乙醇浓度增加呈先升后降趋势,因此乙醇浓度对得率影响较大。由图2c可知,当温度一定时,总黄酮得率随功率变化曲线较为平缓;而当功率一定时,总黄酮得率随着温度增加呈先升后降趋势,因此温度明显影响总黄酮得率。图2d表明,当提取时间一定时,泡桐花总黄酮得率随乙醇浓度提高呈先升后降趋势;而当乙醇浓度维持在一定范围时,总黄酮得率随提取时间增加呈先降后升趋势。由图2e可知,当提取时间一定时,总黄酮得率随温度升高呈先升后降趋势;而当温度不变时,总黄酮得率随提取时间增加呈先降后升趋势。由图2f可知,当乙醇浓度不变时,总黄酮得率随温度升高而持续升高;而当温度不变时,总黄酮得率随乙醇浓度增加而持续上升。
响应面曲面图的曲面越陡峭,表明该因素明显影响泡桐花总黄酮得率[9]。由图2可见,提取功率及乙醇浓度、提取功率及提取温度、提取时间及乙醇浓度、乙醇浓度及提取温度交互作用的曲面有较大倾斜度,说明这些交互项明显影响泡桐花总黄酮得率。

图2 提取因素交互作用响应面Fig.2 Response surface plots showing the mutual effects of different factors
2.3 验证试验
通过Design-Expert 12软件分析总黄酮提取最佳条件:当提取时间66.3 min,温度60.9℃,提取功率306.5 W,乙醇浓度75%时,预测泡桐花总黄酮得率为7.53%。考虑到操作条件可行性,最终将试验条件调整为提取时间66 min,温度61℃,提取功率310 W,乙醇浓度75%,此时总黄酮得率为7.49%,与预测值一致,表明此模型用于预测泡桐花总黄酮提取工艺条件有较高可靠性。
2.4 不同方法提取泡桐花总黄酮得率的比较
3种提取方式中,热水提取法泡桐花总黄酮得率为5.85%,乙醇提取法得率为6.53%,超声波辅助提取法得率为7.49%。表明超声波辅助提取法可提高泡桐花总黄酮得率。
2.5 泡桐花总黄酮体外抑菌效果
由表5可知,泡桐花总黄酮提取物对金黄色葡萄球菌、链球菌、沙门氏杆菌和大肠埃希菌均有不同程度抑制作用。随泡桐花总黄酮浓度降低抑菌活性也逐步下降,总黄酮100~0.39 mg·mL-1浓度对金黄色葡萄球菌效果显著(P<0.05),在100~25 mg·mL-1浓度与庆大霉素效果差异不显著(P>0.05)。总黄酮在100~1.57 mg·mL-1浓度对链球菌有明显抑菌活性。在100~12.50 mg·mL-1浓度对链球菌抑菌效果与庆大霉素效果差异不显著(P>0.05)。总黄酮对金黄色葡萄球菌、链球菌抑菌圈直径显著高于沙门氏杆菌和大肠埃希菌组(P<0.05)。总黄酮100~50 mg·mL-1浓度时对沙门氏杆菌抑菌效果较小。在100~12.50 mg·mL-1浓度时对大肠埃希菌有一定抑菌作用。总黄酮在25~0.10 mg·mL-1浓度时对沙门氏杆菌无抑菌活性。在6.25~0.10 mg·mL-1浓度时对大肠埃希菌无抑菌活性。
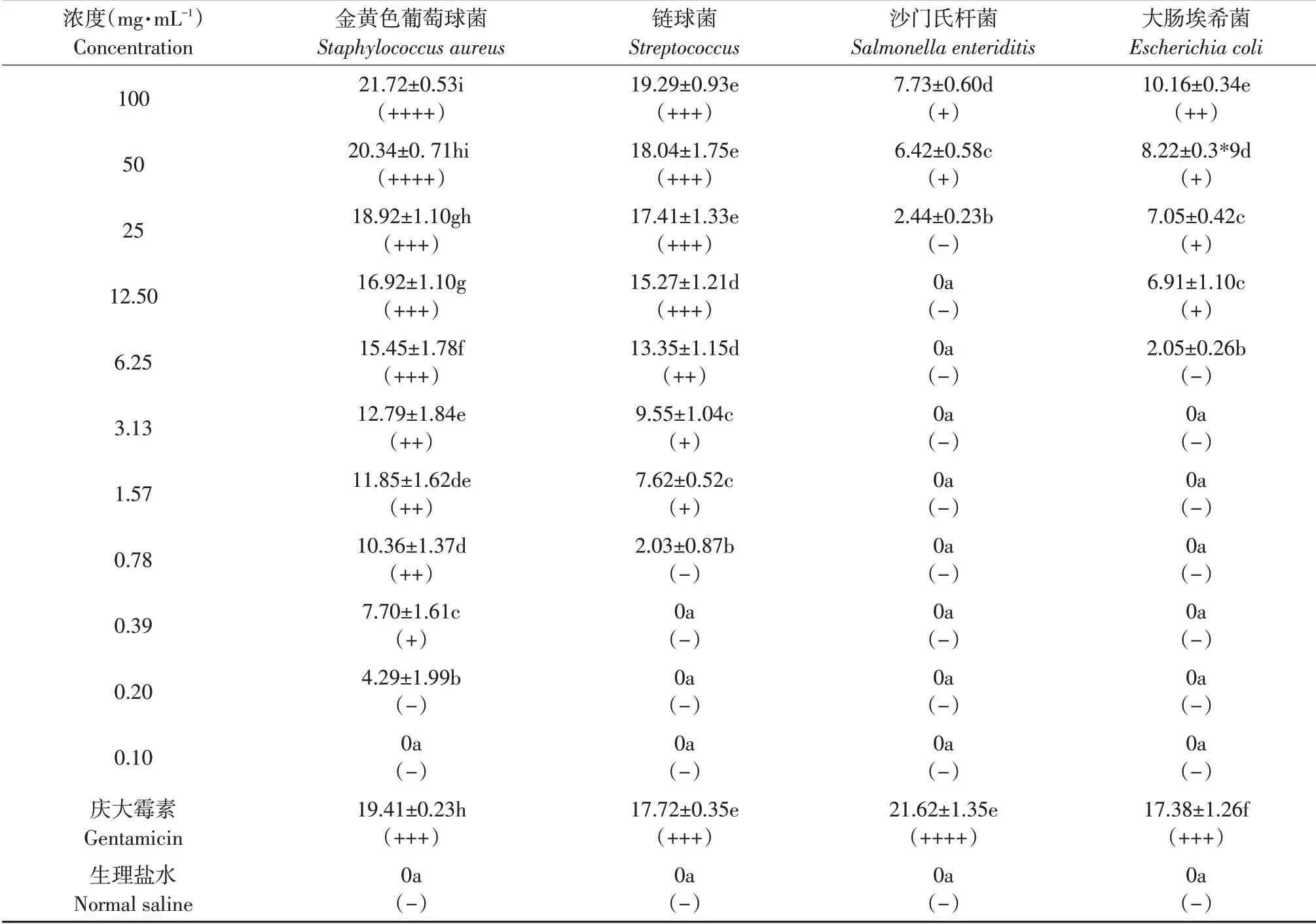
表5 不同浓度泡桐花总黄酮抑菌效果Table 5 Antibacterial activity of Flos Paulowniae Fortunei total flavonoids in different concentrations
2.6 泡桐花总黄酮MIC和MBC测定
泡桐花总黄酮对金黄色葡萄球菌MIC为0.39 mg·mL-1;MBC为0.78 mg·mL-1。泡桐花总黄酮对链球菌MIC为1.57 mg·mL-1;MBC为3.13 mg·mL-1。泡桐花总黄酮对沙门氏杆菌和大肠埃希菌MIC分别为50、12.50 mg·mL-1;MBC分别为50、25 mg·mL-1。MIC和MBC测定表明,泡桐花总黄酮对金黄色葡萄球菌抑菌及杀灭效果最佳,其次为链球菌,对大肠埃希菌和沙门氏杆菌抑菌及杀灭较弱。
3 讨论
3.1 超声波辅助提取对泡桐花总黄酮得率的影响
泡桐花总黄酮类化合物种类有40多种,如芹菜素、山奈酚类、木犀草素、槲皮素和高北美圣草素、橙皮素、柚皮素等二氢总黄酮类[10]。不同提取方法中各种成分溶出和提取得率均不同。目前,泡桐花总黄酮提取主要有热水、乙醇、碱液和系统溶剂等传统溶剂提取法,水提法仅限总黄酮苷类物质提取,鞣质、糖类、淀粉、蛋白质易溶于水中,增加杂质处理难度。长时间加热提取过程导致总黄酮化合物降解[11]。乙醇提取泡桐花总黄酮时,乙醇使用量大,生产成本大幅提高;碱液提取时,强碱条件下加热破坏总黄酮类化合物母核。选用极性由小到大的溶剂依次提取法操作复杂,因此仅限用于实验室,难以实现工业化应用。目前超临界流体、加压液提取、脉冲电场辅助提取、蒸汽爆破辅助提取及动态高压微流化等新技术已应用于植物总黄酮提取方法,新技术在提取效果、提取时间方面有明显优势,但因设备要求高、工艺条件高等条件限制,尚未应用于泡桐花总黄酮提取。微波提取得到的总黄酮类化合物提取率及抗氧化活性均明显优于溶剂提取法[12-13]。超声波辅助提取泡桐花总黄酮成分,其产生的空化效应和机械效应可破坏植物细胞结构,增加泡桐花总黄酮分子运动频率和速度以及溶剂渗透能力,有利于细胞内总黄酮化合物释放与溶出[14]。与传统溶剂提取方法相比,超声辅助提取法是一种绿色提取技术,有提取率高、提取时间短、提取温度低和污染少的优点[15]。
3.2 超声波辅助提取泡桐花总黄酮条件的优化
单因素试验证明,超声功率、提取温度、乙醇浓度和提取时间对泡桐花总黄酮得率的影响较大。过高超声功率导致剧烈空泡效应,引起总黄酮类化合物氧化,长时间提取可引起总黄酮醇类化合物在高温下发生化学结构变化[16]。高浓度乙醇导致更多色素和其他杂质进入溶剂。不适宜提取条件均降低泡桐花总黄酮得率[17]。因此,在单因素试验基础上使用Box-Behnken设计试验和响应面分析法优化泡桐花总黄酮提取条件,结果表明,提取功率与乙醇浓度、提取功率与提取温度、提取时间与乙醇浓度、乙醇浓度与提取温度两两交互作用显著影响总黄酮提取率。本试验筛选出泡桐花总黄酮最佳提取条件为:提取温度61℃,超声功率310 W,提取时间66 min,乙醇浓度75%。在此条件下,泡桐花总黄酮得率为7.49%,而传统热水提取法和乙醇提取法得率分别为5.85%、6.53%,超声波辅助提取法比传统热水和乙醇提取法分别提高28.03%、14.70%。超声波辅助提取法与孟志芬等通过微波法提取泡桐花总黄酮结果相近[18],高于张青青用乙醇提取泡桐花总黄酮得率4.79%[19]。提取过程中不同提取条件可能得到的总黄酮化合物结构不同,因此,后续试验应对超声波辅助提取的泡桐花总黄酮进一步分离纯化,获得总黄酮类物质单体并确定其结构。
3.3 泡桐花总黄酮抑菌活性
近年来,泡桐花总黄酮类化合物抑菌性广受关注。其对金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯菌、伤寒杆菌、痢疾杆菌、大肠埃希菌、白色念珠菌、铜绿假单胞菌和沙门氏菌等均有一定抑制活性。魏希颖等研究表明泡桐花提取液不同萃取部分对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌均有一定抑菌活性,而对产黄青霉、啤酒酵母、黑曲霉无抑制效果[20]。郭俊浩等研究表明乙酸乙酯萃取部分对金黄色葡萄球菌、铜绿假单胞菌、大肠埃希氏菌、白色念珠菌均有不同程度抑制作用,对金黄色葡萄球菌最小抑菌浓度可达到0.31%[21]。本研究通过泡桐花总黄酮超声波提取工艺获得总黄酮类化合物并开展抑菌试验,证明泡桐花总黄酮对金黄色葡萄球菌、链球菌、沙门氏杆菌和大肠埃希菌有不同程度抑杀作用,与Mbaven等研究植物总黄酮抑菌结果一致[22]。证明泡桐花总黄酮对革兰氏阳性菌抑菌活性优于革兰氏阴性菌,对金黄色葡萄球菌抑菌作用显著。总黄酮类化合物损伤细菌细胞质,阻碍细菌细胞壁和核酸合成,降低能量代谢,抑制关键酶活性[23-25]。推测泡桐花总黄酮抑菌活性与此有关。后续研究将分析不同种类总黄酮化合物活性,测定抑菌活性构效关系,确定其活性强弱和选择性,分析总黄酮可能作用机制,为泡桐花总黄酮资源合理利用提供科学依据。
4 结论
经Box-Behnken和响应面分析得到泡桐花总黄酮最佳提取条件为乙醇浓度75%,超声时间66 min,超声功率310 W,温度61℃,得率为7.49%。泡桐花总黄酮应用超声波辅助提取工艺可靠、简便、得率高,有一定体外抑菌活性,其中对金黄色葡萄球菌抑菌效果最佳。
