吲哚胺-2,3-双加氧酶/犬尿氨酸通路调控糖尿病并发抑郁症的机制研究*
2022-09-23阿丽娅吉力力再努尔买合木提卢雪玲
阿丽娅·吉力力,再努尔·买合木提,卢雪玲△
(新疆医科大学第七附属医院 1.内分泌科;2.全科医学科,乌鲁木齐 830054)
糖尿病是一种慢性代谢性疾病,可引起糖尿病肾病、视网膜病、心脑血管、抑郁症等多种并发症[1]。据统计,全球范围内糖尿病患病人数已经超过3.5亿,预计至2030年将超过5.5亿[2]。研究发现,60%~75%糖尿病患者伴有抑郁情绪,其中10%~35%为重度抑郁[3-4]。抑郁症状可导致血糖控制不良,增加糖尿病相关并发症的发生风险,而糖尿病患者血糖控制不佳又会加重抑郁症状。因此,探索糖尿病并发抑郁症的发病机制,寻找有效的治疗靶点,对于改善糖尿病患者的生存质量十分重要。
犬尿氨酸(KYN)是一种内源性神经系统兴奋性氨基酸受体拮抗剂,在犬尿氨酸-3-单加氧酶作用下可代谢为神经毒性物质3-羟基犬尿氨酸,而3-羟基犬尿氨酸可通过氧化应激损伤、细胞死亡等生物过程造成神经损伤。既往研究表明,KYN代谢途径(KP)的激活在情绪调节中起着重要作用,是连接神经系统免疫炎性反应等系统与抑郁症的主要途径[5]。研究显示,大鼠血浆中KYN水平降低可以保护大脑免受与抑郁症相关的应激性变化的影响[6]。提示通过调节细胞因子来降低KYN 水平可达到治疗抑郁症的目的。
吲哚胺-2,3-双加氧酶(IDO)是一种色氨酸降解酶,也是色氨酸-KP上的第一个限速酶,其可通过裂解色氨酸的吲哚环,使色氨酸代谢为KYN,最终导致色氨酸的相对降低和KYN的积累,从而诱导神经毒性[7]。已有研究证实,IDO/KP通路的激活可能与糖尿病并发抑郁症有关[8],但具体作用机制尚未完全阐明。基于此,本研究旨在探讨IDO/KP 通路在糖尿病并发抑郁症大鼠中的调控机制,以期为该病提供新的治疗靶点。
1 材料与方法
1.1 实验动物 SPF 级雄性SD 大鼠30 只,6~8 周龄,体重(200±20)g,购自新疆医科大学实验动物中心,许可证号:SCXK(新)2018-0002。在安静环境下适应性饲养1 周,相对湿度55%~60%,给予充足清洁饮水,自由摄食。
1.2 主要试剂和仪器 链脲佐菌素(STZ)(纯度≥98%,规格:100 mg)购自翌圣生物科技(上海)股份有限公司;IDO抑制剂1-甲基色氨酸(1-MT)(纯度≥96%,规格:250 mg)购自上海易恩化学技术有限公司;KYN对照品(纯度≥98%,规格:10 mg)购自成都成科汇博科技有限公司;去甲肾上腺素(NE)、5-羟色胺(5-HT)、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-4、IL-10、酶联免疫吸附试验(ELISA)试剂盒均购自武汉赛培生物科技有限公司;IDO、GAPDH抗体及HRP标记的二抗均购自美国Abcam公司;BCA 蛋白定量试剂盒、RIPA 裂解液、增强化学发光试剂(ECL)均购自上海碧云天公司;冰醋酸、醋酸钠、高氯酸均为分析纯,购自中国医药集团化学试剂有限公司。
SA215型旷场实验视频分析系统购自江苏赛昂斯生物科技有限公司;IX2-UCB型倒置荧光显微镜购自日本Olympus公司;Sorvall ST 16R型台式冷冻离心机、Varioskan Flash 型多功能酶标仪购自美国ThermoFisher 公司;Agilent1200 高效液相色谱仪购自美国安捷伦公司。
1.3 动物分组、造模及给药 将30 只大鼠随机分为对照组、模型组、干预组,每组10只。模型组和干预组复制糖尿病抑郁大鼠模型[9]。采用高脂饲料+注射STZ 的方法建立糖尿病模型:高脂饲料喂养4 周后禁食、不禁水12 h,一次性腹腔注射1% STZ溶液(20 mg/kg),10 min 内注射完毕,血糖>16.7 mmol/L 视为造模成功。糖尿病模型成功后每日给予无规律的应激处理,包括冷水游泳和束缚,即冷水游泳10 min/d或束缚20 min/d,每天一种刺激,连续刺激4周。以旷场实验结果作为糖尿病抑郁模型成功的判定标准:大鼠水平运动得分及垂直竖立得分较造模前明显下降。对照组大鼠注射等量生理盐水后正常饲养。
于造模成功后第8天起,干预组灌胃给予1-MT溶液(用0.9%NaCl溶解配制成10 mg/mL浓度的溶液)100 mg/kg,1 次/d,连续14 d。对照组和模型组灌胃给予等量生理盐水。
1.4 旷场实验评估大鼠行为学改变 准备80 cm×80 cm×40 cm的敞箱,将其底面划分成25个16 cm×16 cm 的方格,实验时将大鼠从同一位置放于敞箱底面,大鼠适应1 min 后,观察并记录大鼠3 min 内水平运动格数(每次四爪皆进入记为1次1分)和垂直竖立次数(每次两前爪腾空或攀附箱壁记为1次1分)。每次测评结束后,用消毒液擦拭敞箱底面,晾干等待下次使用。水平运动得分及垂直竖立得分越低,表示大鼠抑郁程度越严重。
1.5 大鼠海马组织NE、5-HT及血清炎性因子水平测定 实验结束后,用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,取尾静脉血2 mL,随后将大鼠麻醉处死,迅速剥离脑组织,冰上无菌分离出海马组织。血液离心,取上层血清;取适量海马组织制成匀浆液,采用ELISA法检测大鼠海马组织中NE、5-HT水平及TNF-α、IL-6、IL-4、IL-10水平。
1.6 高效液相色谱—荧光法测定大鼠血清KYN水平 取200 μL血清置于EP管内,加入5%高氯酸溶液,混匀;室温放置10 min 以充分沉淀血清中的蛋白质,10 000 r/min 离心10 min,将上清液转入另一EP管内再离心10 min;取上清液20 μL,于高效液相色谱仪上进样分析。流动相为0.125 mol/L醋酸锌∶乙腈(95∶5)。荧光激发波长340 nm,发射波长450 nm。KYN 采用峰保留值比较法和叠加法定性分析,用外标法测定峰面积进行定量分析。
1.7 Western blotting法检测大鼠海马组织IDO 蛋白表达 取海马组织,RIPA 裂解液提取组织总蛋白,BCA 试剂盒测定蛋白浓度后,行SDS-PAGE 电泳分离蛋白,将蛋白转移至PVDF 膜,5%脱脂牛奶封闭2 h。洗膜,加入IDO 一抗(1∶1 000)稀释液4 ℃冰箱孵育过夜,洗膜,加入二抗(1∶2 000)室温孵育2 h,洗膜,ECL 发光液显影,以GAPDH 为内参,用Image J软件分析蛋白条带灰度值。
1.8 统计学方法 采用SPSS 21.0统计软件进行数据分析,计量资料以均数±标准差()表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠水平运动行为和垂直竖立行为结果比较 造模第1 周,模型组和干预组大鼠水平运动行为得分和垂直竖立行为得分与对照组比较,差异均无统计学意义(均P>0.05);造模第4 周,模型组和干预组大鼠水平运动行为得分和垂直竖立行为得分较对照组下降(均P<0.05),且模型组与干预组比较,差异无统计学意义(P>0.05);干预14 d后,模型组大鼠水平运动行为得分和垂直竖立行为得分较对照组下降,且干预组高于模型组(均P<0.05),见表1。
表1 各组大鼠水平运动行为得分和垂直竖立行为得分比较n=10,分,
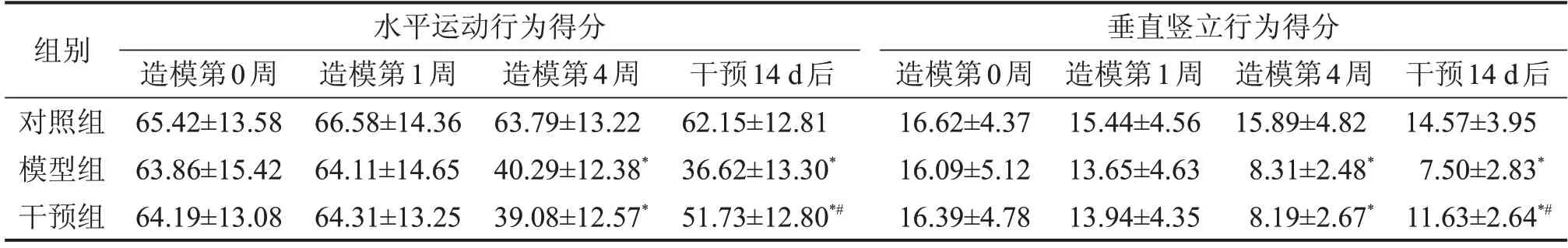
表1 各组大鼠水平运动行为得分和垂直竖立行为得分比较n=10,分,
与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.2 各组大鼠海马组织中NE、5-HT水平比较 与对照组比较,模型组大鼠海马组织NE、5-HT水平降低(P<0.05);与模型组比较,干预组大鼠海马组织NE、5-HT水平升高(P<0.05),见表2。
表2 各组大鼠海马组织中NE、5-HT水平比较n=10,ng/L,

表2 各组大鼠海马组织中NE、5-HT水平比较n=10,ng/L,
与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.3 各组大鼠血清炎性因子水平及KYN水平比较与对照组比较,模型组血清TNF-α、IL-6及KYN水平升高,IL-4、IL-10 水平降低(均P<0.05);与模型组比较,干预组血清TNF-α、IL-6及KYN水平降低,IL-4、IL-10水平升高(均P<0.05),见表3。
表3 各组大鼠血清炎性因子水平及KYN水平比较n=10,

表3 各组大鼠血清炎性因子水平及KYN水平比较n=10,
与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.4 各组大鼠海马组织IDO 蛋白表达量比较 与对照组比较,模型组海马组织IDO蛋白表达量升高(P<0.05);与模型组比较,干预组大鼠海马组织IDO蛋白表达量降低(P<0.05),见图1。
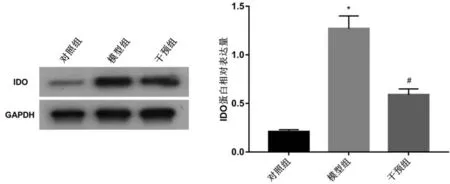
图1 各组大鼠海马组织IDO蛋白表达量比较
3 讨论
研究显示,抑郁症发生机制可能与神经元细胞的凋亡和增殖、单胺类神经递质紊乱、线粒体功能障碍、炎症反应等有关,其中单胺类神经递质紊乱和炎症反应与糖尿病并发抑郁症的机制最为关联[10-11]。NE 作为一种单胺类神经递质,在脑中含量降低会导致抑郁症发生[12];5-HT 能够控制神经稳定、调节情绪,从而防止认知和行为障碍。研究表明,5-HT 水平降低与抑郁症严重程度呈负相关关系,监测5-HT水平有助于评估抑郁症患者病情发展及预后[13-14]。本研究建立糖尿病并发抑郁症大鼠模型,采用旷场实验评估大鼠行为学改变,并检测大鼠海马组织中NE、5-HT水平,结果发现造模第4周模型组大鼠水平运动得分和垂直竖立行为得分较对照组均显著下降,且模型组大鼠海马组织中NE、5-HT 水平均显著降低。表明本研究糖尿病并发抑郁症大鼠模型构建成功。
IDO主要存在于淋巴细胞、胶质细胞、树突状细胞、微血管内皮细胞及巨噬细胞等细胞中,在免疫反应中发挥重要作用[15-16]。研究发现,抑郁症小鼠血清中IDO 活性升高,5-HT 活性降低,血清IDO 活性与5-HT水平呈负相关关系[17-18]。通过药物抑制抑郁症小鼠体内IDO 活性,可减轻小鼠抑郁样行为。此外,IDO活性抑制可使小鼠抑郁敏感性降低,神经发生良好。该结果提示IDO 参与了抑郁症的发生和发展。本研究结果显示,IDO 抑制剂1-MT 干预后糖尿病并发抑郁症大鼠水平运动得分和垂直竖立行为得分均显著升高,同时大鼠海马组织中NE、5-HT 水平显著升高。提示抑制IDO 活性可减轻糖尿病并发抑郁症大鼠抑郁样行为,提高大鼠海马组织中单胺类神经递质水平。
研究发现,炎症过程与抑郁症发生的病理生理学有关[19]。促炎因子TNF-α、IL-6 被发现在抑郁患者外周血中水平升高[20];血清抗炎因子IL-4、IL-10水平越低,抑郁症患者抑郁发作速度越快[21]。本研究中,糖尿病并发抑郁症大鼠血清TNF-α、IL-6水平升高,IL-4、IL-10水平降低;1-MT干预后,大鼠血清炎性因子水平得到明显改善。表明抑制IDO 活性有助于改善糖尿病并发抑郁症大鼠体内炎症反应。
Da 等[8]评估了选择性5-HT 再摄取抑制剂氟西汀、IDO 直接抑制剂1-MT、IDO 间接抑制剂米诺环素及非选择性环氧化酶抑制剂布洛芬对糖尿病并发抑郁症的作用,结果证实上述药物均可下调糖尿病并发抑郁症大鼠海马组织中IDO 表达。本研究发现,糖尿病并发抑郁症大鼠海马组织中IDO蛋白表达水平升高,1-MT 干预后大鼠海马组织中IDO蛋白表达水平降低,与Da等[8]研究结果相符。色氨酸是产生多种具有重要生理作用的神经活性代谢物的底物,其主要分解代谢途径是KP途径,由色氨酸生成KYN 是KP 途径的第一个限速步骤,受IDO等酶的介导[22]。失调的KP 途径与抑郁症的病理进程有关,KYN水平升高是抑郁行为的一个致病生物标志物[23-24]。本研究结果显示,糖尿病并发抑郁症大鼠血清KYN 水平升高,1-MT 干预后大鼠血清KYN 水平降低。表明抑制IDO 活性能够降低糖尿病并发抑郁症大鼠体内KYN水平,从而减少大鼠抑郁行为。
综上所述,抑制IDO/KP 通路可能通过提高NE和5-HT水平、减轻炎性反应来抑制大鼠糖尿病并发抑郁症的发生。IDO/KP 通路有望成为糖尿病并发抑郁症治疗的有效靶点。本研究不足之处是未评估糖尿病并发抑郁症大鼠体内色氨酸浓度以及神经损伤情况,后续将深入探索糖尿病并发抑郁症中IDO/KP 信号通路上、下游调控因子变化以及IDO活性变化与神经损伤的相关性。
