右美托咪定对布比卡因脊髓神经毒性的作用及相关机制*
2022-09-23韦丽玲罗云鹏陈美云紫刘敬臣
韦丽玲,罗云鹏,赖 坚,赵 漾,周 刚,陈美云紫,余 悦,刘敬臣
(广西医科大学第一附属医院麻醉科,南宁 530021)
椎管内麻醉广泛应用于临床,尤其在基层医院仍然是最主要的麻醉方式之一。但椎管内麻醉已经被证实具有潜在的神经毒性[1],比如短暂性神经综合征、马尾神经综合征等[2-4],虽然椎管内麻醉并发症发生率不高,然而一旦发生将救治困难。因此,探索椎管内麻醉发生神经毒性的机制具有重要意义。本课题组前期探索发现,局麻药神经毒性发生的机制可能与局麻药诱导细胞凋亡有关[5-6]。右美托咪定是临床麻醉中最见的麻醉药物之一,近年来其器官保护作用是一个很重要的研究方向。相关文献报道右美托咪定具有抑制大鼠海马神经细胞凋亡而起到脑保护作用[7-8],而右美托咪定是否能通过抑制椎管内神经元的凋亡而起到神经保护作用,目前尚缺乏相关报道。Pi3k/Akt 是细胞中一个经典的信号通路,参与体内细胞的生长、增殖、分化、凋亡等,维持机体正常的免疫、代谢,是生命体不可缺少的重要通路之一[9]。以往研究表明右美托咪定可以通过激活Pi3k/Akt通路而起到抗凋亡的作用。因此本研究拟探索右美托咪定是否可以通过激活Pi3k/Akt 信号通路减少脊髓神经细胞凋亡,从而减少布比卡因脊髓神经毒性。
1 材料与方法
1.1 药物、试剂和实验器材
PE-10 导管购自Smith Medical 公司(英国);布比卡因(货号:B5274)和右美托咪定盐酸盐(货号SML0956);YLS.A12A鼠尾光照测痛仪购自淮北正华生物仪器设备有限公司;GAPDH、Bax和Cleavedcaspase3抗体购自武汉三鹰生物技术有限公司;Bcl-2 购自沈阳万类科技有限公司;Akt、p-Akt、Pi3k、p-Pi3k 抗体均购自艾比马特生物医药上海有限公司;488 荧光二抗购自Abcam 公司;RIPA 蛋白酶裂解液、蛋白酶抑制剂、磷酸酶抑制剂、PMSF、5×蛋白上样缓冲液、BCA检测试剂盒均购自碧云天生物科技有限公司;ECL化学发光试剂盒购自沈阳万类科技有限公司;Odessey 红外荧光扫膜仪器购自Licor公司。
1.2 实验动物
SPF级成年雄性SD大鼠260~280 g购于广西医科大学动物实验中心,动物生产许可证号SCXK 桂2020-0004,实验动物使用许可证号SYXK-桂2020-0004,对大鼠进行分笼进行饲养,水和食物充足,20~25℃恒温环境,固定昼夜各12 h 交替循环周期。本动物实验已经获得广西医科大学动物实验中心伦理委员会批准。
1.3 动物分组以及干预方法
按随机数字表法将24 只SPF 级SD 大鼠分为3组:生理盐水组(S组)、布比卡因组(B组)、右美托咪定预处理组(D 组)。3 组SD 大鼠进行鞘内置管后分别进行以下处理:S 组鞘内注射0.12 μL/g 的生理盐水,连续3 次每次间隔90 min,B 组鞘内注射0.12 μL/g的5%的布比卡因,连续3次每次间隔90 min,D组腹腔注射50 μg/kg的右美托咪定[1],30 min后连续3 次鞘内注射5%布比卡因每次间隔90 min。置管前,给药后0 d、1 d、2 d、3 d 取材前分别测大鼠甩尾反应潜伏期(TFL)和进行运动功能评分(BBB)评分。给药后3 d取大鼠脊髓腰膨大处组织。
1.4 蛛网膜下腔置管
采用改良Yasksh 法[10]给SD 大鼠进行鞘内置管,预先用生理盐水充满PE-10导管,选取L5~L6腰椎间隙向头部置管,置管长度为1.5~2.0 cm。置管时大鼠出现甩尾反应和导管有生理盐水溢出,表示置管成功。将PE-10 导管固定于背部肌肉,皮下埋管导管远端从颈部穿出,并固定于颈部皮肤,火烧封管。置管后单笼饲养3 d,鞘内给10 μL 利多卡因,30 s内出现双下肢麻痹,且30 min内恢复表明蛛网膜下腔置管成功。双下肢出现运动功能受损者剔除出实验。
1.5 检测指标
1.5.1 感觉功能和运动功能评价 大鼠TFL 评价大鼠感觉功能,分别在置管前测基础值,给药后0 d、1 d、2 d、3 d用鼠尾光照测痛仪测定并记录大鼠甩尾反应时间,测量3次,每次间隔5 min,取平均值。换算成最大抗辐射热效应百分比(%MPE),转换公式=(实测值-基础值)/(最大值-基础值)×100%,防止鼠尾出现损伤,最大值为16.01 s。大鼠后肢BBB评分:0分是后肢运动功能消失,21分是后肢运动功能完全正常。为避免大鼠昼夜差异,测定时间固定于同一时间点进行。
1.5.2 光镜观察脊髓苏木精—伊红(HE)病理改变 各组大鼠于给药后3 d,采用10%水合氯醛进行麻醉,后用4 ℃生理盐水进行心脏灌注,取脊髓腰膨大处,迅速固定于4%多聚甲醛。腰膨大固定24 h后,石蜡包埋,切成4 μm 大小的连续厚片,进行HE染色。
1.5.3 Western blotting检测相关蛋白指标 每组脊髓腰膨大冻存标本加入RAPA、蛋白酶抑制剂、磷酸酶进行匀浆,后置于冰上裂解30 min,13 000 r/min,15 min,吸取上清。用BCA 法测定蛋白浓度,加入上样缓冲液,100 ℃水煮5 min。使用8%和12%的SDS-PAGE凝胶进行电泳,使蛋白质进行分离,使用湿法将蛋白转移至PVDF 膜上,BSA 封闭1 h,按一抗说明书指示进行抗体稀释,4 ℃孵育过夜。TBST洗膜,小鼠来源的一抗用二抗HRP标记的山羊抗体室温孵育1 h,TBST 洗膜,ECL 化学发光发暗室曝光显影。兔来源的一抗采用荧光标记的山羊抗体室温孵育1 h,TBST洗膜,Odessey 红外荧光扫膜仪器扫描所得PVDF 膜。扫描结果采用Image J 软件分析条带灰度值,以条带灰度值来反应蛋白质表达量的水平。
1.5.4 免疫荧光法 检测Bax 和Bcl-2 在细胞中表达量,取各组预先制好的石蜡切片至于60 ℃烤箱烤片1~2 h,脱蜡后用柠檬酸钠高压抗原修复,PBS 洗片,3%的过氧化氢室温孵育10 min,0.3%Triton X-100室温通透10 min,PBS洗片,5%驴血清室温封闭30 min,Bax和Bcl-2一抗(1∶50)4 ℃孵育过夜,PBS洗片,羊抗兔488 荧光二抗(1∶800)室温避光孵育1 h,PBS漂洗后DAPI染核室温5 min,PBS洗片,滴加抗荧光淬灭剂盖盖玻片封片;于荧光显微镜下观察拍照,蓝色荧光为细胞核染色,代表整片所有细胞数,绿色荧光为Bax和Bcl-2阳性表达。
1.6 统计学方法
采用SPSS 23.0统计软件,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,非正态分布的计量资料以中位数(四分位数)[M(P25~P75)]表示,以P<0.05为差异有统计学意义。
2 结果
2.1 各组感觉功能比较
S 组,B 组,D 组在置管前%MEP 差异无统计学意义(P>0.05)。B组和D 组在给药后0 d、1 d、2 d、3 d%MEP均大于S组,差异有统计学意义(P<0.05)。与B 组比较,D 组在给药后的3 d%MEP 较小,差异有统计学意义(P<0.05),见表1。
表1 各组感觉功能比较

表1 各组感觉功能比较
与S组比较,*P<0.05;与B组相较,#P<0.05。
2.2 各组大鼠不同时间点后肢BBB评分比较
S组、B组、D组给药前BBB评分均为21分。与S 组比较,B 组、D 组在给药后的0 d、1 d、2 d、3 d BBB评分较低,差异有统计学意义(P<0.05),见表2。
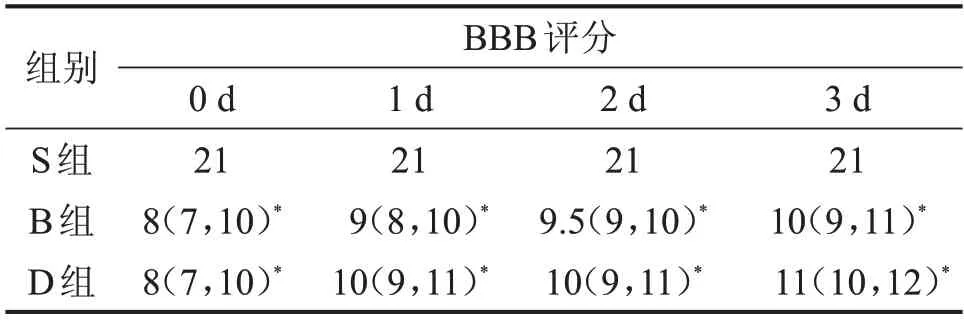
表2 各组不同时间点大鼠BBB评分比较分,M(P25~P75)
2.3 各组脊髓病理组织HE染色的改变
光镜下S组神经元结构完整,轮廓规则清晰,尼氏体丰富,核仁清晰,核膜完整。B组和D组神经元出现不同程度水肿、萎缩、数目减少,细胞核出现固缩、深染,溶解,核膜不完整。与B 组相较D 组损伤轻,神经元的水肿、萎缩较轻,核仁相对清晰,核膜相对完整,损伤的神经元个数较少,见图1。

图1 各组HE染色光镜下脊髓组织损伤情况
2.4 各组脊髓组织蛋白的表达情况
与S组比较,B组和D组凋亡相关蛋白Cleavedcaspase3、Bax表达量增多,Bcl-2、p-Akt、p-Pi3k表达量下降(均P<0.05)。与B 组比较,D 组Bcl-2、p-Pi3k、p-Akt表达量上升,凋亡相关蛋白Cleaved-caspase3 和Bax 表达量下降,差异有统计学意义(P<0.05),见图2。
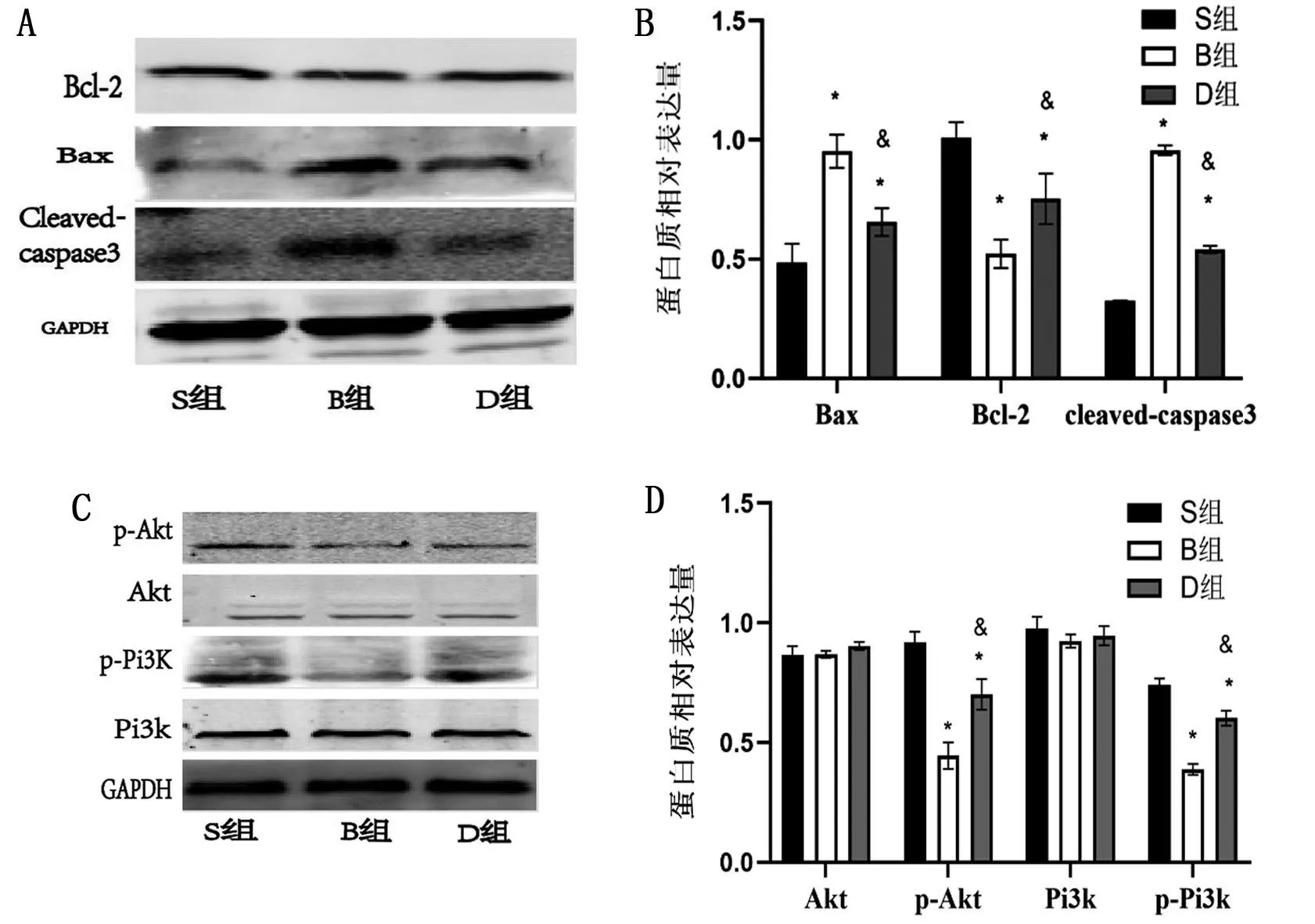
图2 各组脊髓组织Cleaved-caspase3、Bax、Bcl-2、Akt、p-Akt、Pi3k、p-Pi3k蛋白的表达情况
2.5 各组脊髓组织凋亡相关蛋白在神经元中的表达情况
各组脊髓组织凋亡相关蛋白Bax 和Bcl-2 均在细胞质中表达,B组和D组阳性表达量较多,S组较少;见图3、图4。

图3 各组脊髓组织Bax蛋白在神经元中的表达情况

图4 各组脊髓组织Bcl-2蛋白在神经元中的表达情况
3 讨论
腰麻是将局麻药注入蛛网膜下腔,阻滞神经根使其相应支配区域产生麻醉效果,局麻药已经被证实存在神经毒性,临床上出现局麻药神经毒性主要包括马尾综合征、短暂神经综合征等。在本研究中布比卡因处理的大鼠其感觉功能和运动功能受损,不能对热刺激及时做出甩尾反应,表现为BBB评分下降和TFL评分上升;HE染色神经元数量减少,神经元水肿明显,神经元周围空泡增多。应用右美托咪定预处理后的大鼠TFL 评分在第3 天后明显下降,HE染色神经元的水肿得到一定改善,神经元周围空泡减少。本实验可以证实布比卡因存在脊髓神经毒性,与本课题组前期研究结果一致,右美托咪定预处理后可以减轻布比卡因导致的脊髓神经毒性。布比卡因是临床最常使用的局麻药之一,有实验证实布比卡因可以诱导各种类型的神经细胞损伤,从而导致神经毒性。其中包括诱导小鼠背根神经节的神经元出现退变和神经元凋亡[11];通过t型钙通道诱导SHSY5Y 细胞凋亡[12],通过损害线粒体功能,从而增强谷氨酸诱导的大鼠海马兴奋性毒性[13],通过增强内质网应激促进细胞凋亡[14]。本实验研究发现布比卡因处理的大鼠凋亡相关蛋白Cleaved-caspase3和Bax表达量增多,抑制凋亡相关蛋白Bcl-2表达量下降。可以证实布比卡因诱导神经元凋亡从而产生了神经毒性。
凋亡作为脊髓神经毒性的重要机制之一已经得到证实,抑制凋亡具有神经保护效应。右美托咪定是高度选择性α2受体激动剂,可以结合突触前α2肾上腺素受体,激活交感反应的负反馈回路,减少去甲肾上腺素的释放,从而抑制交感反射和应激反应,具有镇静、镇痛、抗焦虑和抗交感的作用[15]。有实验表明右美托咪定可通过抑制内质网应激,氧化应激,炎症反应,细胞凋亡、焦亡等机制减轻创伤性脑损伤[16]、脑缺血再灌注损伤[17]、创伤性脊髓损伤[18]、脊髓缺血再灌注损伤[19]。在本实验布比卡因脊髓神经毒性模型中,应用右美托咪定预处理后凋亡相关蛋白Cleaved-caspase3和Bax表达量下降,抗凋亡蛋白Bcl-2表达量上升。本实验研究结果证实右美托咪定抑制脊髓神经元凋亡减轻了布比卡因的神经毒性从而产生神经保护作用,其神经保护作用和上述研究结果一致。
Pi3k/Akt 信号通路已经被证实和细胞生长、增殖、分化、生存、死亡密切相关。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,Pi3k)是一种异二聚体酶,是体内重要的信号传导分子,在接受外来信号刺激后活化,活化的Pi3k可以产生生磷脂酰肌醇三磷酸(PIP3),PIP3 是活下游蛋白激酶B(protein kinase B,PKB/AKT)的第二S 信使,蛋白激酶B 是一种进化上保守的特异性蛋白激酶,被激活后蛋白激酶B可以下调Bad、Bax、caspase等促凋亡蛋白,在细胞存活和凋亡中发挥重要作用,是PI3K的重要靶点[20]。有实验证实右美托咪定可以调控Pi3k/Akt信号通路抑制细胞凋亡[21],本实验也发现类似结果,B组的p-Pi3k、p-Akt 水平下降,而D 组p-Pi3k、p-Akt水平上升,表明布比卡因促进神经元凋亡可能与抑制Pi3k/Akt 通路有关,而右美托咪定减少神经元凋亡可能与激活Pi3k/Akt通路有关。
综上所述,本研究发现布比卡因具有脊髓神经毒性,其机制可能是布比卡因抑制Pi3k/Akt 信号通路诱导脊髓神经元的凋亡。右美托咪定可以减轻布比卡因导致的脊髓神经毒性,其机制是激活的Pi3k/Akt信号通路抑制了脊髓神经元的凋亡。本实验通过建立布比卡因大鼠脊髓神经毒性模型,为局麻药布比卡因脊神经毒性提供的新的治疗思路。本实验存在一定的局限性,布比卡因是如何抑制Pi3k/Akt信号诱导脊髓神经元凋亡以及右美托咪定如何激活Pi3k/Akt信号抑制脊髓神经元凋亡的仍需进一步的探究。
