大豆响应低磷胁迫的XTH基因鉴定及XTH38调节根系生长研究
2022-09-22张亚楠欧斯艳李方剑黄丽雅麦翠珊王金祥
张亚楠,王 婷,欧斯艳,李方剑,黄丽雅,麦翠珊,王金祥*
(1 华南农业大学资源环境学院/华南农业大学根系生物学中心,广东广州 510642;2 广东省农业农村污染治理与环境安全重点实验室,广东广州 510642)
细胞壁修饰酶在调节细胞壁的可塑性方面发挥重要作用。木葡聚糖内糖基转移酶/水解酶 (xyloglucan endotransglycosylases/hydrolases, XTHs)是一类参与纤维素/木葡聚糖交联和重塑的酶,XTH在细胞伸长过程中作用于微丝-基质界面[1–2],保持细胞壁的厚度、完整性和强度[3–5]。拟南芥 (Arabidopsisthaliana)和水稻 (Oryzasativa) 基因组分别有33和29个XTH基因[6]。已经发现超表达AtXTH19和AtXTH2促进侧根的发育,提高植物的耐盐性[7],超表达AtXTH30增强对盐胁迫的敏感性[8],超表达辣椒 (C.annuumcv.Pukang)CaXTH3提高拟南芥的耐旱性和耐盐性[9]。AtXTH21功能丧失限制主根的生长,其通过改变木聚糖的质量和纤维素的沉积调节根的生长[10]。超表达胡杨 (Populuseuphratica)PeXTH的烟草更耐盐[11]。这些研究说明,XTH基因在植物生长发育和响应非生物逆境方面起重要作用,但对于大豆XTH在生长发育和耐受逆境方面的功能还不清楚。
本研究通过生物信息学分析,明确大豆 (Glycine max) 基因组含有61个XTH基因家族成员;根据氨基酸序列进行进化分析,将大豆XTH家族分为3个亚组;通过定量PCR鉴定出受低磷(LP)诱导的XTH基因,尤其是GmXTH38在根叶均受LP诱导。在正常养分条件下,超表达GmXTH38导致拟南芥主根变短、侧根数增多和侧根密度增加。与Col-0相比,在LP、低铁(LFe)和高铁(HFe,铁毒) 胁迫条件下,超表达GmXTH38的拟南芥主根变短、侧根数减少、侧根密度减少。与Col-0相比,超表达GmXTH38导致拟南芥侧根形成对LP的敏感性增加;超表达GmXTH38导致拟南芥侧根密度在低铁或高铁条件下下降程度更多,增加拟南芥主根生长对低铁或高铁的敏感性。
1 材料与方法
1.1 供试材料
大豆品种为粤春03-3 (YC03-3),拟南芥野生型为哥伦比亚 (Columbia-0,Col-0) 生态型。
1.2 大豆GmXTH的生物信息学分析
以拟南芥XTH氨基酸序列为参考,通过BLASTP比对,在植物基因组数据库Phytozome (http://www.phytozome.org/index.php) 中获得大豆XTH基因编码的氨基酸序列;基于大豆基因组序列,确定GmXTH基因的全长序列,外显子和内含子数目,GmXTH基因上游2000 bp的核苷酸编码序列,以及大豆、拟南芥和水稻等XTH的氨基酸序列。
在 ExPaSy (https://wed.expasy.org/protparam) 网站获得GmXTHs的等电点、分子量;使用MEGA7.0.26(http://http//www.megasoftware.net) 构建 GmXTHs进化树;通过MEME (http://meme-suite.org/tools/meme)分析GmXTH蛋白和启动子的基序信息,利用TBtools软件绘图。利用大豆基因组数据库SoyBase (https://www.soybase.org) 分析大豆GmXTH家族基因在大豆不同组织和不同发育时期的表达模式,绘制热图。
1.3 大豆的低磷胁迫处理
参考文献方法[12],进行大豆水培和养分胁迫处理。YC03-3的种子用10% NaClO灭菌,在沙子中萌发。为了探索GmXTH38对磷铁养分胁迫的响应,首先将大豆幼苗在完全的 Hoagland 溶液 (pH 5.9) 中培养14天。然后将具有第一片三出复叶的大豆幼苗分别转入高磷 (HP,500 μmol/L KH2PO4)、低磷 (LP,25 μmol/L KH2PO4) 营养液中培养 14 天。大豆在遮阴网室进行培养,营养液每3 h通气15 min,每2天更换一次营养液[12]。
1.4 实时荧光定量PCR
用perlprimer设计实时荧光定量PCR特异引物(附表1)。反应在定量 PCR 仪 (Applied Biosystems 7500,Foster City,USA) 进行,用 SYBR Green I dye(Takara Bio Inc.,Otsu,Japan) 进行分析。反应条件为:初始变性 95℃,5 min,40 个循环 (95℃ 10 s、60℃20 s、72℃ 20 s)。以看家基因GmEF1α(Glyma.17G 186600) 或AtEF1α(At1G07940) 作为内参。

附表1 载体构建及定量PCR相关引物列表Supplyment table 1 Vector construction and quantitative PCR related primers list

续附表1 Supplyment table 1 continued
1.5 GmXTH38超表达基因株系的获得及检测
基于重组克隆方法[13],通过PCR将GmXTH38的开放阅读框 (ORF) 进行扩增,将克隆片段转入双元载体pMDC32,然后用农杆菌GV3101对拟南芥进行花序浸泡法转化,通过潮霉素筛选获得单拷贝插入的转基因材料。通过PCR进一步确定超表达GmXTH38的转基因拟南芥。
1.6 GmXTH38启动子活性分析
首先通过TSSP程序 (http://www.softberry.com)预测GmXTH38启动子,然后通过PCR扩增启动子片段 (长度为 2000 bp)。基于重组克隆方法[13],将GmXTH38启动子克隆转入GUS报告基因载体pMDC162,转化拟南芥[14],通过潮霉素筛选获得单拷贝插入的转基因材料。纯化的T3代植株进行GUS染色,在体视显微镜下观察拍照,分析启动子活性。
1.7 低磷、低铁和高铁胁迫条件下GmXTH38超表达株系根系生长分析
将酒精消毒的超表达GmXTH38株系 (#1和#2)和Col-0种子播种于1/2 MS培养基,置于4°C处理2天。然后于人工气候培养箱进行培养,光温周期分别为 16 h/8 h (光照/黑暗)和 22℃/20℃ (白天/黑夜),光照强度为 100 μmol/(m2·s),相对湿度为 70%。2天后挑选长势一致的幼苗分别移入高磷 (HP:1.25 mmol/L KH2PO4)、低磷 (LP:0 mmol/L KH2PO4)、高铁 (HFe: Fe-EDTA 500 μmol/L)、中铁 (MFe: Fe-EDTA 50 μmol/L)、低铁 (LFe: Fe-EDTA 0 μmol/L)固体培养基上,7天后测定相关指标,每个处理4个重复,HP和MFe培养基的P和Fe含量是植物正常生长需求量。根据参考文献,本研究中拟南芥HFe培养条件视为铁毒 (铁过量) 处理。
1.8 数据分析
用SPSS20.0进行数据分析,计算平均值和标准误,用Student’st-test进行差异显著性分析;用OriginPro8绘图。
2 结果与分析
2.1 GmXTHs家族成员理化性质分析
相对于拟南芥基因组,大豆基因组更大更复杂。为全面分析大豆XTH基因家族,我们结合两个方法鉴定大豆XTH基因家族。方法一是通过关键词PF06955 在 Phytozome 网站 (www.phytozome.org) 进行检索,发现大豆基因组 (GlycinemaxWm82.a2.v1版本) 共有61个基因编码XTH;方法二是以33个拟南芥XTH的氨基酸序列为种子序列,通过BLASTP程序对大豆蛋白质组进行迭代比对。基于两种方法分析的结果,确定大豆基因组有61个XTH基因。大豆GmXTH家族成员分布在1~5号、7~20号染色体上,其中定位13号和17号染色体上的GmXTH基因数目最多,分别为9和7个。根据GmXTH在染色体上的位置,命名为GmXTH1至GmXTH61(附表2)。
通过ExPaSy网站对GmXTH蛋白进行分析,发现GmXTH分子量范围为13.0~40.5 KDa,氨基酸数目在115~347 (附表2);22个GmXTH的等电点小于7,其他39个XTH蛋白的等电点均大于7 (附表2)。

附表2 GmXTH家族成员基因的基本信息Supplyment table 2 Basic information of GmXTHs

续附表2 Supplyment table 2 continued
2.2 XTHs的系统进化分析
根据文献和比对分析,发现拟南芥和水稻XTH基因家族分别有33和29个成员(https://phytozome.jgi.doe.gov/pz/portal.html)。我们利用MEAG7.0.26重建大豆、水稻和拟南芥的XTHs系统进化树。如图1所示,大豆、拟南芥、水稻的XTH家族可分为3个亚组;其中GmXTH38与拟南芥XTH9、XTH23位于同一亚组,GmXTH38与后两者的氨基酸同源性分别为83.1%和63.4%。

图1 GmXTH系统进化分析Fig.1 Phylogenetic analysis of GmXTH
2.3 大豆GmXTH保守基序、启动子和蛋白质结构域分析
通过对GmXTH进行保守结构域分析,发现除GmXTH33外,其他GmXTH均含有3个基序。与GmXTH38的基序排列极为相似的有GmXTH2、12~19、30~31、36、46~48,表明这些蛋白可能具有相似的功能(图2)。如图2B所示,基序1~3中分别包含XTH蛋白特有的保守序列。

图2 GmXTH蛋白基序 (A) 和保守结构域分析 (B)Fig.2 Analysis of motif (A) and conserved domain of GmXTH protein (B)
为进一步了解GmXTH的启动子顺式调控元件,我们利用MEME程序对GmXTH启动子序列进行了保守核苷酸基序 (motif) 的分析。GmXTH的启动子包含的基序类型相似,有3种基序类型 (Motif 1~3),其中GmXTH9、GmXTH12、GmXTH14、GmXTH26、GmXTH29、GmXTH52均含有3种类型的基序,其余GmXTH启动子中仅包含其中1~2种基序 (图3)。与GmXTH38的基序排列极为相似的有GmXTH18、GmXTH34、GmXTH51,且它们仅含有1个基序。这表明可能有共同的转录因子结合在这些XTH启动子元件上调控其转录。
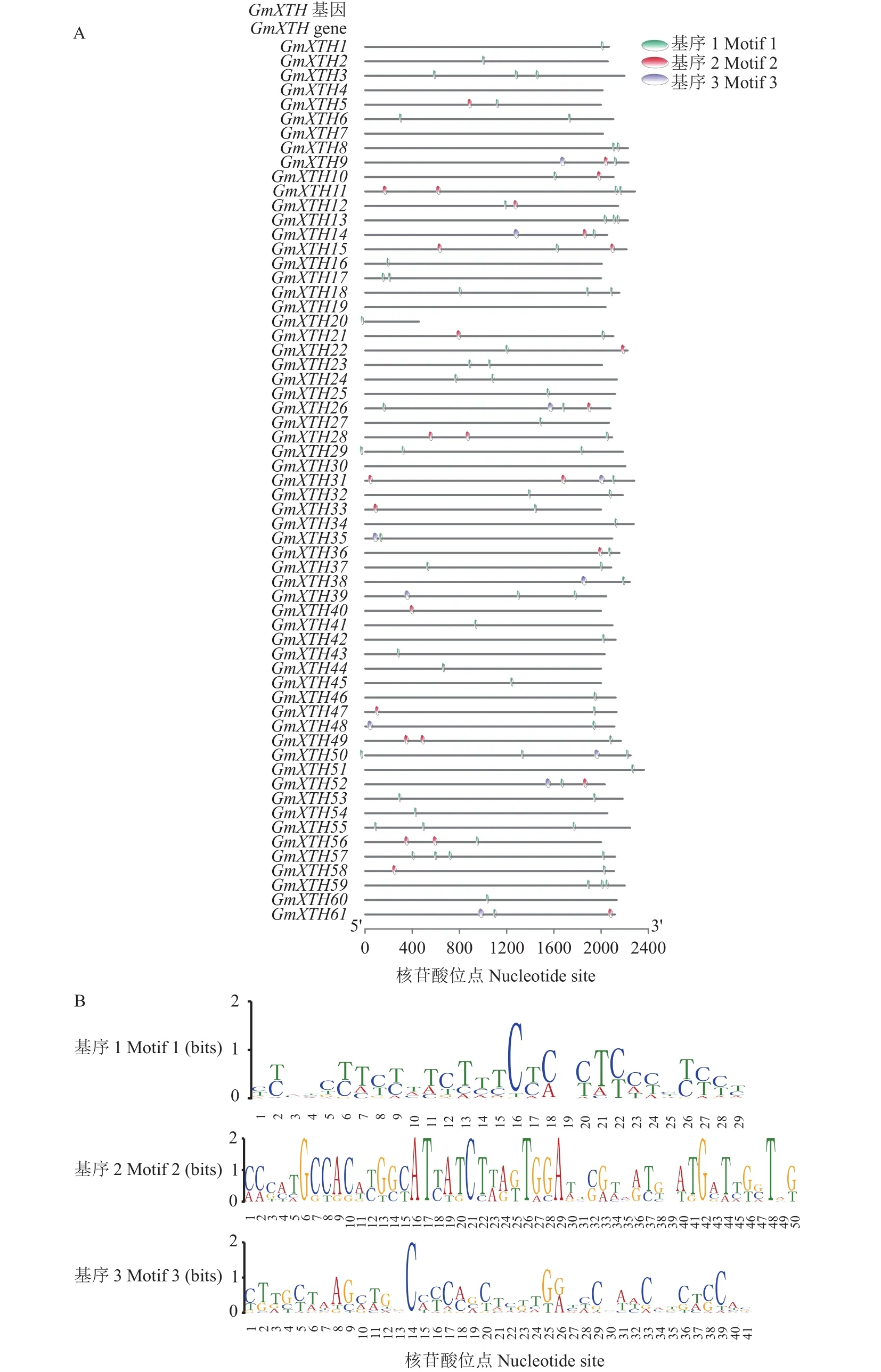
图3 GmXTH启动子基序 (A) 和保守结构域分析 (B)Fig.3 Analysis of motif (A) and conserved domain of GmXTH promoter (B)
2.4 GmXTHs家族成员在大豆不同器官的表达水平
为了确定GmXTH基因的表达模式,我们使用公开的大豆全基因组转录组数据(www.soybase.org) 进行分析。如图4所示,GmXTH基因在各器官广泛表达,GmXTHs具有不同的组织特异性表达模式。15 个GmXTHs (XTH2、6、10、13~15、19、22、25、27、32、33、39、45、61)在根表达量较高;6 个GmXTHs (XTH13、29、32~34、55)在根瘤表达量较高。

图4 GmXTH基因家族在不同器官的表达模式Fig.4 The expression patterns of GmXTH gene family in different organs
2.5 GmXTHs对低磷胁迫的响应
为明确GmXTHs对LP胁迫的响应,我们前期对大豆LP胁迫14天的叶进行转录组分析,已上传相关数据至 NCBI (accession number:PRJNA48973),发现GmXTHs家族中有5个基因 (GmXTH24、28、38、41和52) 对LP有较明显的响应。本研究进一步通过定量PCR对这5个GmXTH基因响应LP胁迫进行了分析(图5)。GmXTH24在叶的表达量显著高于根,但GmXTH24在根叶均不受LP诱导,这与转录组结果不一致;GmXTH28也是在叶的表达量高于根,GmXTH28在根显著受LP诱导,其表达量是HP(对照) 处理的 9.8倍 (P<0.01)。值得注意的是,GmXTH38在大豆根和叶都明显受LP诱导,LP在根和叶中的相对表达量分别是HP的15.3和4.4倍;GmXTH41明显受LP诱导,LP在根和中叶的相对表达量分别是HP的 39.1和 2.5倍 (P<0.05);而GmXTH52仅在大豆根受LP诱导,与HP相比,LP诱导倍数高达14.2倍 (P<0.05)。后面的试验针对GmXTH38开展。
2.6 GmXTH38启动子活性分析
定量PCR分析已证明GmXTH38在大豆根、叶均受LP诱导 (图5)。我们进一步分析了GmXTH38启动子活性及其对LP的响应。GUS染色结果显示(图6),HP条件下,整个拟南芥幼苗 (如叶、主根、侧根) 均能观察到GUS染色;LP条件下,地上部和地下部染色更深,范围更大,说明GmXTH38启动子活性受低磷促进。暗示GmXTH38可能在大豆根系响应LP胁迫方面起作用。

图5 GmXTHs对低磷胁迫的响应Fig.5 Responses of soybean GmXTHs to low phosphorus stress
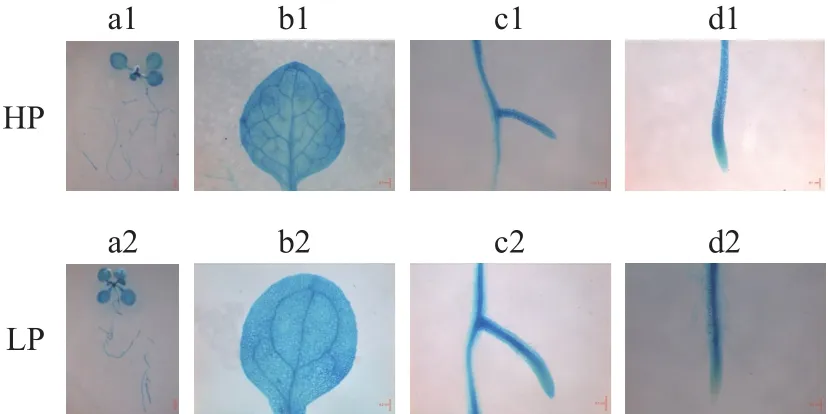
图6 GmXTH38启动子活性Fig.6 Promoter activity of GmXTH38
2.7 低磷条件下GmXTH38超表达对拟南芥根系生长的影响
为揭示GmXTH38的功能,我们将GmXTH38在拟南芥进行异源表达,通过半定量PCR鉴定到2个纯合的超表达GmXTH38株系#1和#2 (附图1)。因LP诱导GmXTH38在根的表达(图5),我们将转基因株系进行LP处理,研究超表达GmXTH38对拟南芥根系生长的影响。
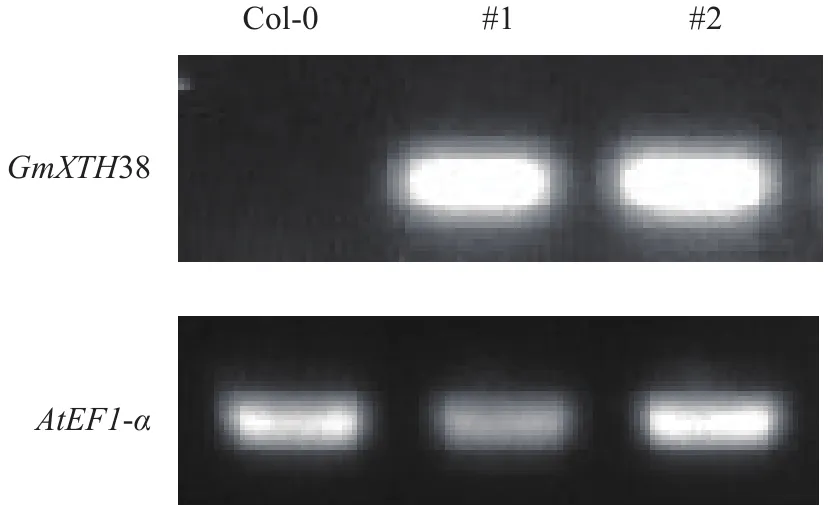
附图1 GmXTH38过表达株系的鉴定Supplement figure 1 Identification of overexpressing GmXTH38 lines
在HP处理下,与Col-0比,超表达GmXTH38材料#1和#2的主根长分别被抑制了34.22%和37.65%(图7a、c);LP处理7天,#1和#2的主根长分别被抑制了30.59%和29.58% (图7b、c)。与HP处理相比,LP处理的Col-0的主根长被抑制了50.03%,而超表达的2个株系主根长分别被抑制了47.27%和43.56% (图 7a、b、c)。说明超表达GmXTH38降低主根生长对LP的敏感性。
与Col-0相比,超表达材料#1和#2在HP下生长7天的侧根数 (包括侧根原基) 显著减少,分别被抑制了69.70%和65.15% (图7a、d)。LP条件下Col-0、#1和#2的侧根数明显比HP条件下的多。在LP条件下,与Col-0相比,#1和#2的侧根数分别被抑制了46.63%和41.01% (图7b、d)。与HP相比,LP处理下Col-0的侧根数增加了1.70倍,而#1和#2株系侧根数分别增加了3.75和3.57倍 (图7a、b、d)。
LP处理明显增加Col-0、#1和#2的侧根密度。与HP比,LP条件下Col-0的侧根密度增加了4.63倍,而#1和#2株系侧根密度分别增加了10.97和8.07倍 (图7e)。这说明超表达GmXTH38增加侧根形成对LP的敏感性。

图7 低磷处理对野生型和转基因拟南芥生长的影响Fig.7 Effects of low phosphorus treatment on the growth of wild type and transgenic Arabidopsis thaliana
2.8 GmXTH38调节拟南芥根系在低铁和高铁条件下的生长
基于磷营养和铁营养之间存在密切的关系,土壤或培养介质铁存在会降低磷的有效性。我们进一步研究了超表达GmXTH38对拟南芥根系在低铁(LFe) 或高铁 (HFe,铁毒) 下生长的影响。与 MF (中铁,对照)比,HFe条件下Col-0、#1和#2的主根长分别被抑制了31.87%、34.67% 和 42.82% (图8 a、b、d),LFe处理下Col-0、#1和#2的主根长分别被抑制了 66.51%、68.33% 和 73.17% (图8 b、c、d)。这些结果表明,超量表达GmXTH38增加拟南芥主根生长对LFe或HFe的敏感性。
LFe和HFe胁迫均抑制侧根形成 (图8)。与MF相比,HFe处理下的Col-0、#1和#2侧根数分别被抑制了 88.27%、90.48%、69.23% (图 8a、b、e),Col-0、#1和#2的侧根数在LF条件下分别被抑制了74.40%、92.86%、69.23% (图 8b、c、e)。HFe条件下,与Col-0相比,#1和#2的侧根数分别被抑制63.64% 和 45.45% (图 8e)。
与MFe比,LFe条件下Col-0、#1和#2的侧根密度分别下降了62.01%、68.33%和69.58%,HFe条件下Col-0、#1和#2的侧根密度分别下降了22.16%、34.67%和42.82% (图8f)。这表明GmXTH38超量表达导致拟南芥侧根形成对LFe或HFe更敏感。
3 讨论
XTH是一类参与纤维素/木葡聚糖交联的构建和重塑的酶,在调节细胞壁的伸长方面起重要作用。然而,人们对大豆中的这类酶知之甚少。本研究发现,大豆基因组含有61个XTH基因,进化分析表明GmXTH可分为3个亚组 (图1)。大豆XTH基因数目远高于水稻和拟南芥XTH基因数目,这可能与大豆基因组在进化过程中出现两次基因组复制有关,也暗示大豆XTH家族的功能更复杂。
通过启动子元件分析,发现GmXTH24、28、38、41和52都含有 G-box 元件 (CACGTG) (附表3)。G-box元件与基因转录响应光、激素和环境因子有关[15–16]。受低磷诱导的OsPTF1和GmPTF1的启动子均含有G-box元件[17],两者都属于bHLH型转录因子,调节水稻和大豆磷营养。此外,GmXTH38、41和52都含有W-box元件(附表3)。W-box元件是WRKY转录因子结合位点[18]。WRKY6通过结合PHO1启动子内的两个W-box元件负调控PHO1的表达,在低磷条件下,WRKY6抑制PHO1的转录[18–20];WRKY42也可以直接结合PHO1启动子的W-box,WRKY42与WRKY6相互作用抑制PHO1的表达[20–21];WRKY45与PHT1(PHOSPHATETRANSPORTER1)启动子的两个W-box元件结合,直接上调PHT1转录[22]。拟南芥和水稻部分低磷响应基因启动子中存在P1BS元件,而MYB类转录因子PHR1通过结合P1BS (PHR1 binding sequence)元件调控下游基因的转录[23]。我们发现GmXTH28和GmXTH38的启动子含有P1BS元件。这些结果暗示,大豆bHLH、WRKY以及PHR1类转录因子可能调节GmXTHs的转录。此外,GUS分析均证实GmXTH38启动子活性受LP诱导 (图6),与定量PCR结果一致 (图5)。

附表3 五个受低磷调控基因中磷相关的启动子元件Supplyment table 3 Five phosphorus-related promoter elements in low phosphorus-regulated genes
对GmXTH38进行同源性比对发现,它与AtXTH9相似度为83.1%,与AtXTH23相似度为63.4%。已有研究表明,XTH9超表达增加侧根长度,并增加对低硝酸盐胁迫的耐受性[24];AtXTH19和AtXTH23的超表达促进侧根的发育并增强盐胁迫耐受性,而AtXTH23单突变和AtXTH19/AtXTH23双突变对盐胁迫敏感,侧根较少[7]。本研究发现,超表达GmXTH38在植物正常生长养分条件下抑制主根生长和侧根形成(图7)。GmXTH38在大豆根、叶均受LP诱导(图5),而磷与铁养分存在密切关系。在HP条件下,超表达GmXTH38抑制主根的生长、侧根的数目和侧根密度 (图7)。但是否是抑制主根分生区活性;影响侧根的起始或突破表皮等需进一步研究。另一方面,超表达GmXTH38改变拟南芥对磷缺乏的敏感性,表现为主根生长对LP的敏感性降低,而侧根形成对LP的敏感性增加,侧根密度增加更多 (图7)。文献报道,低磷抑制野生型拟南芥Col-0主根生长,增加侧根密度,且依赖于生长素信号转导途径[25],我们结果与此文献一致。这是否与生长素信号途径耦联值得进一步研究。
值得注意的是,我们发现超表达GmXTH38导致拟南芥对铁饥饿 (LFe)和铁毒 (HFe)更敏感,表现为主根长和侧根密度都会受到强烈的抑制(图8)。这暗示,超表达GmXTH38会强化铁缺乏或过量对根系生长发育的调控。基于本研究结果,推测GmXTH38在调节磷铁养分互作方面起作用。

图8 不同铁浓度处理对野生型和转基因拟南芥生长的影响Fig.8 Effects of different iron concentrations on the growth of wild and transgenic Arabidopsis thaliana
4 结论
GmXTH38可能在根系响应低磷和铁胁迫方面起重要作用,调节主根的生长和侧根形成。超表达GmXTH38改变了拟南芥主根和侧根对磷、铁等养分胁迫的敏感性。本研究为今后揭示GmXTH调节磷、铁养分胁迫的分子机制打下了基础,今后需要创制大豆GmXTH相关的基因编辑材料,以便对其调节根系应答磷铁养分胁迫的机制进行深入研究。
