营养不良五阶梯模式在腹腔镜胃癌根治术患者营养干预中的应用及对术后恢复、体能状态的影响
2022-09-22贺雪菲赵建梅杨婕杨丽肖霞
贺雪菲,赵建梅,杨婕,杨丽,肖霞
【提要】目的 探讨营养不良五阶梯模式在腹腔镜胃癌根治术患者营养干预中的应用效果。方法 选取2018年1月~2021年1月102例胃癌患者进行前瞻性研究,采用简单随机数字表法分为观察组和对照组,各51例。两组均采用腹腔镜胃癌根治术治疗,对照组给予常规营养干预,观察组给予营养不良五阶梯模式营养干预。比较两组术后恢复时间、患者自评主观评定量表(PG-SGA)评分、营养相关生化指标、T淋巴细胞亚群、Karnofsky日常体能状态评估(KPS)评分、并发症发生率。结果 观察组术后恢复时间短于对照组(P<0.05);观察组术后1个月、3个月PG-SGA评分低于对照组,KPS评分高于对照组(P<0.05);观察组术后1个月、3个月转铁蛋白(TRF)、白蛋白(ALB)、前白蛋白(PA)、血红蛋白(Hb)高于对照组(P<0.05);观察组术后1个月、3个月CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组(P<0.05);观察组并发症发生率低于对照组(P<0.05)。结论 营养不良五阶梯模式应用于腹腔镜胃癌根治术患者,可有效改善患者营养情况及体能状态,调节机体免疫功能,促进患者术后恢复,减少并发症。
腹腔镜胃癌根治术是目前临床治疗早中期胃癌的微创方式,可有效切除病灶,安全有效[1]。但由于恶性病质消耗,同时受心理应激因素影响,胃癌患者易出现食欲下降、味觉异常等,营养物质摄取明显减少,且基础代谢增加,高达59.80%的患者存在营养风险[2]。此外手术损伤诱导的高代谢、负氮平衡、免疫抑制,术后营养状况可能进一步恶化,增加切口感染、肺部感染、吻合口瘘等并发症发生风险,严重影响患者预后[3]。目前国内外大量学者已广泛认同营养干预在改善肿瘤患者预后中的作用[4-7]。胃癌患者术后恢复期较长,患者出院后仍需延续性营养指导。营养不良五阶梯模式是由中国抗癌学会、中华医学会肠外肠内营养学分会推荐的营养干预模式,通过患者自评主观评定量表(Patient-Generated Subjective Global Assessment,PG-SGA)[8]对患者营养风险进行量化评估,根据营养风险分级依次实施营养教育、口服营养补充、完全肠内营养、部分肠外营养、全肠外营养,已有研究表明其在改善患者营养状况方面的效果[9-10],但在腹腔镜胃癌根治术患者中的具体效果仍缺乏大量循证依据。基于此,本研究选取我院胃癌患者为研究对象,从术后恢复时间、体能状态、营养状况、免疫功能等多方面分析实施腹腔镜胃癌根治术的围术期进行营养不良五阶梯模式干预的效果,具体结果报告如下。
1 资料与方法
1.1 研究对象
选取2018年1月至2021年1月重庆大学附属中心医院胃癌患者102例,采用简单随机数字表法分为观察组和对照组,各51例。两组年龄、性别、ASA分级、肿瘤分期、病理分型、肿瘤大小、淋巴结转移情况、肿瘤位置、手术方式、消化道重建方式比较,差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会审批通过。
纳入标准:①符合胃癌诊断标准[11],且经胃镜病理检查首次确诊;②肿瘤分期为Ⅰ~Ⅲ期;③自愿接受腹腔镜胃癌根治术治疗;④具有正常的沟通能力,可清晰回答医护人员问题;⑤PG-SGA≥2分,有营养风险;⑥Karnofsky日常体能状态评估(Karnofsky performance status,KPS)[12]评分>60分;⑦知情同意本研究。
排除标准:①腹腔内多发转移或肝脏转移;②围术期使用白蛋白类药物、免疫调节剂或血液制品;③严重心肝肾功能障碍;④入院前有活动性消化道出血、消化道梗阻、感染性疾病、自身免疫性疾病;⑤有明显胃潴留;⑥合并其他恶性肿瘤:⑦代谢障碍类疾病。
剔除标准:①依从性差,未能按计划完成研究;②围术期死亡。
1.2 方法
两组均采用腹腔镜胃癌根治术治疗。
1.2.1 对照组
给予常规营养干预。住院期间对患者进行营养宣教,教育内容包括围术期营养原则、饮食忌宜、饮食误区,纠正不良饮食习惯,可正常饮食者参考患者及家属意见制定相关食谱。机体能量需求量为20~30 kcal/(kg·d),蛋白质为1.5~2.0 g/(kg·d),液体需求量50岁以下为35 mL/kg,50岁及以上者为30 mL/kg。若无法正常饮食或日常饮食无法满足
腹腔镜胃癌根治术是目前临床治疗早中期胃癌的微创方式,可有效切除病灶,安全有效[1]。但由于恶性病质消耗,同时受心理应激因素影响,胃癌患者易出现食欲下降、味觉异常等,营养物质摄取明显减少,且基础代谢增加,高达59.80%的患者存在营养风险[2]。此外手术损伤诱导的高代谢、负氮平衡、免疫抑制,术后营养状况可能进一步恶化,增加切口感染、肺部感染、吻合口瘘等并发症发生风险,严重影响患者预后[3]。目前国内外大量学者已广泛认同营养干预在改善肿瘤患者预后中的作用[4-7]。胃癌患者术后恢复期较长,患者出院后仍需延续性营养指导。营养不良五阶梯模式是由中国抗癌学会、中华医学会肠外肠内营养学分会推荐的营养干预模式,通过患者自评主观评定量表(Patient-Generated Subjective Global Assessment,PG-SGA)[8]对患者营养风险进行量化评估,根据营养风险分级依次实施营养教育、口服营养补充、完全肠内营养、部分肠外营养、全肠外营养,已有研究表明其在改善患者营养状况方面的效果[9-10],但在腹腔镜胃癌根治术患者中的具体效果仍缺乏大量循证依据。基于此,本研究选取我院胃癌患者为研究对象,从术后恢复时间、体能状态、营养状况、免疫功能等多方面分析实施腹腔镜胃癌根治术的围术期进行营养不良五阶梯模式干预的效果,具体结果报告如下。
1 资料与方法
1.1 研究对象
选取重庆大学附属中心医院2018年1月~2021年1月102例胃癌患者进行前瞻性研究,采用简单随机数字表法分为观察组和对照组,各51例。两组年龄、性别、ASA分级、肿瘤分期、病理分型、肿瘤大小、淋巴结转移情况、肿瘤位置、手术方式、消化道重建方式比较,差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会审批通过。

表1 两组一般资料比较

组别例数肿瘤大小淋巴结转移肿瘤位置手术方式消化道重建方式<5cm≥5cm有无胃窦胃体胃角贲门远端胃切除术全胃切除术毕-Ⅰ式吻合毕-Ⅱ式吻合离断式Roux-en-Y非离断式Roux-en-Y观察组5139(76.5)12(23.5)22(43.1)29(56.9)22(43.1)17(33.3)5(9.8)7(13.7)35(68.6)16(31.4)30(58.8)6(11.8)11(21.6)4(7.8)对照组5141(80.4)10(19.6)19(37.3)32(62.8)25(49.0)14(27.5)7(13.7)5(9.8)38(74.5)13(25.5)28(54.9)5(9.8)13(25.5)5(9.8)t/χ2/z0.2320.3671.1490.4340.438P0.6300.5450.7650.5100.932
纳入标准:(1)符合胃癌诊断标准[11],且经胃镜病理检查首次确诊;(2)肿瘤分期为Ⅰ~Ⅲ期;(3)自愿接受腹腔镜胃癌根治术治疗;(4)具有正常的沟通能力,可清晰回答医护人员问题;(5)PG-SGA≥2分,有营养风险;(6)Karnofsky日常体能状态评估(Karnofsky performance status,KPS)[12]评分>60分;(7)知情同意本研究。
排除标准:(1)腹腔内多发转移或肝脏转移;(2)围术期使用白蛋白类药物、免疫调节剂或血液制品;(3)严重心肝肾功能障碍;(4)入院前有活动性消化道出血、消化道梗阻、感染性疾病、自身免疫性疾病;(5)有明显胃潴留;(6)合并其他恶性肿瘤:(7)代谢障碍类疾病。
剔除标准:(1)依从性差,未能按计划完成研究;(2)围术期死亡。
1.2 方法
两组均采用腹腔镜胃癌根治术治疗。
1.2.1 对照组 给予常规营养干预。住院期间对患者进行营养宣教,教育内容包括围术期营养原则、饮食忌宜、饮食误区,纠正不良饮食习惯,可正常饮食者参考患者及家属意见制定相关食谱。机体能量需求量为20~30 kcal/(kg·d),蛋白质为1.5~2.0 g/(kg·d),液体需求量50岁以下为35 mL/kg,50岁及以上者为30 mL/kg。若无法正常饮食或日常饮食无法满足自身营养需求,胃肠功能正常进行口服营养补充(ONS),否则进行肠内管饲营养,若胃肠功能障碍或消化障碍时则选取肠外营养模式。营养支持期间酌情根据患者情况适当补充维生素,维持电解质平衡,若存在液体不足则静脉补充。出院时建立微信群,邀请患者及家属加入,病友可于微信群中相互交流营养经验,若遇到疑问可@医护人员寻求专业解答,避免自行在网络寻找一些非专业答案,医护人员亦可推荐医院、科室等医学专业公众号、网站等,供患者查阅信息。出院后每月进行一次电话随访,随访时首先回答患者院外恢复过程中遇到的营养问题,评估患者依从性,对依从性不足者进行强化健康教育,并根据患者当前营养状况进行膳食指导。
1.2.2 观察组 给予营养不良五阶梯模式营养干预。患者入院后采用PG-SGA进行营养评估,符合本研究纳入标准的患者均为PG-SGA≥2分,分为可疑营养不良(2~3分)、中度营养不良(4~8分)、重度营养不良(≥9分)三个等级;根据五阶梯模式实施营养干预,饮食调整+营养宣教为阶梯一,饮食调整+ONS为阶梯二,肠内营养支持(EN)为阶梯三,EN+肠外营养(PN),全肠外营养支持(TPN)为阶梯五,对存在营养风险的患者首先开展营养宣教,讲解营养干预相关知识,下一个阶梯未能满足60%的目标能量需求3~5 d时逐步向上一个阶梯晋级,初期非目标能量需求以4.8~6.0 kJ/(kg·d)为标准,营养不良严重者则降低至2.4~3.6 kJ/(kg·d),以预防再喂养综合征。具体干预措施如下:
PG-SGA评分2~3分:给予阶梯一干预,营养宣教内容同对照组,鼓励患者积极对治疗期间遇到的营养问题进行提问,对患者的正性、积极行为予以肯定、表扬,出院后鼓励患者在微信群中分享日常饮食相关内容,促进病友间相互监督、促进。每2周复评一次,根据评估结果调整营养干预措施。
PG-SGA评分4~8分:根据Harris-Bendeict公式计算能量需求,首次采用食物模型、量具进行演示,询问前一天三餐、零食、夜宵的膳食种类、数量、烹饪方式,出院后嘱患者以记账法在随访记录本中记录每日膳食情况,对食物进行编码,依据《食物成分表(2002)》、《膳食营养素参考摄入量(2000)》量化营养素摄入量。依据患者情况实施阶梯二、三、四、五的干预措施,无法正常饮食或日常饮食无法满足自身营养需求,胃肠功能正常者给予ONS。若因食管完全梗阻、严重胃瘫、吞咽障碍等完全缺乏进食条件时,选取EN,由肠内营养剂(白普力、瑞代、能全力)提供所有营养素,喂养途径包括内镜辅助下胃肠置管术、鼻-空肠管、鼻-胃管及空肠造口管等。EN无法满足患者营养需求时由肿瘤专科医师于营养科医师会诊,开具个体化营养配方,在EN基础上实施PN。阶梯五为TPN,经中心静脉导管、外周静脉穿刺置入中心静脉导管、外周静脉输注全合一营养液。住院期间每周评估一次,出院后1个月、3个月复查时复查一次。
PG-SGA评分≥9分。术前进行1~2周EN、PN,每天进行PG-SGA评估,待PG-SGA评分≤8分时进行手术,术后再次进行营养评估,依据评估结果进行营养干预。
两组均干预至术后3个月。
1.3 观察指标
1.3.1 术后恢复时间 包括术后导管留置时间、肠鸣音恢复时间、首次排气时间、首次进食时间、首次下床活动时间、住院时间。
1.3.2 PG-SGA评分 分为患者自评、医务人员评估,自评部分包括4个方面,分别为体质量、摄食情况、症状、活动和身体功能;医务人员评估包括4个方面,分别为体质量丢失、疾病状态、代谢应激、体格检查(脂肪、肌肉及水肿情况)。二者相加记为总分,分为无营养不良(<2分)、可疑营养不良(2~3分)、中度营养不良(4~8分)、重度营养不良(≥9分)。分别于入院时、术后3 d、术后1个月、术后3个月进行评价比较。
1.3.3 营养相关生化指标 入院时、术后3 d、术后1个月、术后3个月采集空腹外周静脉血3 mL,采用迈瑞BS-240全自动生化分析仪以免疫比浊法测定转铁蛋白(TRF)、白蛋白(ALB)、前白蛋白(PA)水平,采用迈瑞BC-5000全自动血细胞分析仪以HiCN法测定血红蛋白(Hb)水平,试剂盒由仪器配套提供。
1.3.4 T淋巴细胞亚群 采用BD FACSVerse流式细胞仪测定CD3+、CD4+、CD8+,计算CD4+/CD8+。
1.3.5 KPS评分 总分0~100分,60分级以上为基本时生活自理,得分越高患者体能状态越好。
1.3.6 并发症发生率 包括切口感染、肺部感染、吻合口瘘等。
1.4 统计学处理

2 结果
2.1 术后恢复时间
观察组术后导管留置时间、肠鸣音恢复时间、首次排气时间、首次进食时间、首次下床活动时间、住院时间短于对照组(P<0.05),见表2。
2.2 PG-SGA评分
组内比较,两组PG-SGA评分术后3d高于入院时,术后1个月低于入院时、术后3d,术后3个月低于入院时、术后3d、术后1个月(P<0.05);组间比较,观察组术后1个月、3个月PG-SGA评分低于对照组(P<0.05)。见表3。
2.3 营养相关生化指标
组内比较,两组TRF、PA、Hb术后3d低于入院时,TRF、ALB、PA、Hb术后1个月高于入院时、术后3d,术后3个月高于入院时、术后3d、术后1个月(P<0.05);组间比较,观察组术后1个月、3个月TRF、ALB、PA、Hb高于对照组(P<0.05)。见表4。

表2 两组术后恢复时间比较
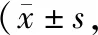
表3 两组PG-SGA评分比较分)

表4 两组营养相关生化指标比较
2.4 T淋巴细胞亚群
组内比较,两组CD3+、CD4+、CD4+/CD8+术后3d低于入院时,术后1个月高于入院时、术后3d,术后3个月高于入院时、术后3 d、术后1个月(P<0.05),CD8+术后3 d高于入院时,术后1个月低于入院时、术后3 d,术后3个月低于入院时、术后3 d、术后1个月(P<0.05);组间比较,观察组术后1个月、3个月CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组(P<0.05)。见表5。
2.5 KPS评分
组内比较,两组KPS评分术后3 d低于入院时,术后1个月高于入院时、术后3 d,术后3个月高于入院时、术后3 d、术后1个月(P<0.05);组间比较,观察组术后1个月、3个月KPS评分高于对照组(P<0.05)。见表6。
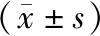
表5 两组T淋巴细胞亚群比较

表6 两组KPS评分比较分)
2.6 并发症发生率
观察组并发症发生率低于对照组(P<0.05)。见表7。

表7 两组并发症发生率比较[n(%)]
3 讨论
胃癌是临床常见胃肠道恶性肿瘤,患者行腹腔镜胃癌根治术后胃容积明显减小,消化功能减弱,尤其是术后1至3个月体质量下降显著,严重影响患者体能状态[13]。据曹子谦等[14]相关报道显示,胃癌根治术后86.60%患者存在营养风险。大量研究证实,营养支持不仅能为患者提供营养物质,还有助于维护胃肠功能,减轻炎症反应,在促进患者术后康复中具有重要意义[15-19]。但不同患者的营养状况、对营养制剂耐受性存在显著差异,如何合理规划、制定满足患者个体化需求的营养干预措施仍是当前肿瘤科、营养科医师的研究重点。
《中国肿瘤营养治疗指南》[20]中明确指出,理想的肿瘤患者营养干预应实现能量和蛋白质双达标。近年来,随着营养医学的发展,营养干预模式逐渐完善,五阶段模式在临床得到广泛应用[21-22]。学者赵思雨[23]对胃肠肿瘤围手术期化疗患者实施五阶梯营养干预,结果发现,干预后患者营养状况、生活方式显著改善,化疗不良反应亦减少。本研究在PG-SGA量化评估胃癌营养风险的基础上实施五阶梯模式的干预,可满足不同营养状态患者的个性化需求,可有效改善患者营养状况,且患者体能状态亦可以得到较大幅度改善。医护人员是患者营养知识的最主要、最可靠来源,对可疑营养不良的患者在积极调整饮食方案的同时强化营养宣教,提升患者对影响相关知识的掌握水平,增强自我管理意识,积极转变生活方式,且可避免患者自行搜寻信息造成的信息量庞大、真假难辨等问题。EN符合患者生理状况,可有效刺激肠内内分泌素增加,促进肠道吸收营养物质,减轻患者营养不良状况,同时能维持胃肠道血流增加,刺激胃肠蠕动,促进患者胃肠功能恢复,还可使小肠黏膜获得足够的营养,维持正常的肠黏膜功能,减少肠道菌群易位,降低感染风险。PE不受制剂口感等因素限制,可避免造成呼吸性肺炎,适应证较广,但随着时间延长会诱发导管相关感染,同时长时间禁食亦会损伤肠屏障功能。对于中度营养不良患者,依据患者饮食情况、胃肠道耐受能力逐级选择人工营养方案,以EN或EN+PN为主,对存在EN禁忌的选择PN,满足患者个性化能量需求,避免营养不耐受情况。对于重度营养不良患者先进行1~2周营养干预,待营养风险降低至中度时才行手术治疗,不仅可提高患者手术耐受性,还有助于降低手术风险。蔡泽君等[24]对有营养风险胃癌患者实施早期肠内营养,患者术后首次肛门排气、排便时间显著缩短。本研究发现五阶梯模式干预在促进腹腔镜胃癌根治术患者术后恢复方面有显著效果,且可提高治疗安全性。T淋巴细胞亚群是判断患者细胞免疫功能的关键指标。营养液中的谷氨酰胺可为人体巨噬细胞、中性粒细胞、淋巴细胞等提供能量,避免术后患者应激状态下机体谷氨酰胺被免疫组织消耗,促进患者免疫功能增强。腹腔镜胃癌根治术患者围术期实施营养不良五阶梯模式干预后机体营养更充分,因此术后T淋巴细胞亚群改善更显著,免疫功能增强。
综上所述,腹腔镜胃癌根治术患者围术期实施营养不良五阶梯模式干预,在改善患者营养情况及体能状态、调节机体免疫功能、缩短术后恢复时间、降低并发症发生风险等方面均具有显著效果。营养风险筛查是个体化营养干预的,因此医务人员在进行PG-SGA评分时应尽可能做到客观、准确,以精准实施营养干预策略。此外,在确保膳食补充剂安全及可靠的前提下,可将膳食补充和替代纳入营养干预范畴,以进一步丰富五阶梯模式干预内容。
