微小RNA-525-5p通过靶向RECQ样蛋白5调控乳腺癌放射敏感性
2022-09-22梁猛
梁猛
保乳术后的放射治疗在临床上已经很成熟,可以保留大多数早期乳腺癌病人的器官;即使乳房切除后,放射治疗仍然是防止术后局部复发的有效手段[1-2]。然而,放射抗性是影响乳腺癌病人预后的重要因素[3-4]。miRNA在癌症中的功能得到普遍认可,其不仅参与癌症的发生发展,在癌症的放化疗抗性中可具有重要作用[5-6]。研究报道微小RNA-525-5p(miR-525-5p)可抑制宫颈癌细胞的增殖和转移[7]。朱长春等[8]在乳腺癌放射治疗的研究中报道,miR-525-3p为乳腺癌细胞辐照后表达异常升高的miRNA之一,具有成为放射治疗新靶点的潜力。然而miR-525-5p对乳腺癌放射敏感性的影响及机制尚未清楚。RECQ解旋酶(recQ helicase)为DNA解旋酶,被称为“基因的守护者”,包括RECQL1、WRN、BLM、RECQL4和RECQL5等成员,其表达水平与乳腺癌病人的预后密切相关[9-10]。RECQL5基 因 与DNA复制、修复和转录密切相关,Peng等[11]报道,三阴性乳腺癌细胞中的RECQL5功能受损,导致DNA损伤持续存在、G2停滞,最终导致增殖停止,表明RECQL5可能是TNBC的潜在治疗靶点。RECQL5高表达促进非小细胞肺癌的转移和对顺铂的耐药性[12],但是RECQL5在乳腺癌中的功能研究甚少。因此,本研究在2019年6月至2020年6月开展,旨在探讨miR-525-5p、RECQL5对人乳腺癌细胞MDAMB-231辐射照射敏感性的影响。
1 资料与方法
1.1 一般资料人乳腺癌细胞MDA-MB-231、MCF-7、BT474、非恶性乳腺上皮细胞MCF-10A均购自美国菌种保藏中心;DMEM培养基购自invitrogen公司;胎牛血清购自上海江林生物科技有限公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂购自美国Sellect公司;LipofectamineTM2000购自上海阳光生物科技有限公司;二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自上海玉博生物科技有限公司;逆转录试剂盒购自美国Promega公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)购自武汉迈博瑞生物膜技术有限公司;双荧光素酶报告基因检测试剂盒购自上海翊圣生物科技有限公司;膜联蛋白V-异硫氰酸荧光素/碘化丙锭(Annexin V-Fluorescein isothiocyanate/propidium iodide,Annexin V-FITC/PI)凋亡检测试剂盒购自上海臻诺生物有限公司。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 细胞培养 将人乳腺癌细胞MDA-MB-231、MCF-7、BT474以及正常乳腺上皮细胞MCF-10A使用DMEM培养基(10%胎牛血清)在37℃、5%二氧化碳的恒温细胞培养箱中进行常规培养。
1.2.2 转染和分组 将正常培养的MDA-MB-231、MCF-7、BT474、MCF-10A细胞分别标记为MDA-MB-231组、MCF-7组、BT474组、MCF-10A组。将MDA-MB-231细胞按随机数字表法分为miR-525-5p模拟物(miR-525-5p mimics)阴性对照(miR-NC)组、miR-525-5p组、RECQL5小干扰RNA阴性对照(si-NC)组、RECQL5小干扰RNA(si-RECQL5)组、miR-525-5p+RECQL5过表达空载体(pcDNA)组、miR-525-5p+RECQL5过表达载体(pcDNA-RECQL5)组。处理方法:按照脂质体LipofectamineTM2000的说明书操作,将miR-NC、miR-525-5p mimics、si-NC、si-RECQL5、miR-525-5p mimics+pcDNA、miR-525-5p mimics+pcDNA-RECQL5转 染至MDA-MB-231细 胞,转染4 h后,补充培养基继续培养48 h,在进行转染效率的检测。确定转染成功后方可用于后续试验。
1.2.3 miR-525-5p、RECQL5 mRNA的qRT-PCR检测实验 取适量对数生长期“1.2.2”各组细胞,提取细胞总RNA后,快速将其合成cDNA,再用qRT-PCR试剂盒进行miR-525-5p、RECQL5检测。以U6、GAPDH为 内 参 ,用2-ΔΔCt=[(CTmiRNA-CTU6)Treatment group-(CTmiRNA-CTU6)Control group]计算miR-525-5p的 表 达 ,2-ΔΔCt=[(CTRECQL5-CTGAPDH)Treatment group-(CTRECQL5-CTGAPDH)Control group]计算RECQL5的表达。信物序列(5'-3'):miR-525-5p正向引物CUCCAGAGGGAUGCAC,反向引物GTGCAGGGTCCGAGGT;U6、GAPDH均采用通用内参引物序列。RECQL5引物由上海吉玛公司设计合成。
1.2.4 RECQL5的蛋白检测实验 取适量对数生长期“1.2.2”各组细胞,冰上用蛋白裂解液充分裂解并提取总蛋白,定量后用沸水浴法进行变性。将蛋白用聚丙烯酰胺凝胶进行蛋白电泳,再将蛋白转移到PVDF膜。将膜用脱脂奶粉封闭2 h后浸入一抗(1∶1 500)溶液中孵育过夜(4℃)。结束后再将膜浸入二抗(1∶1 000)溶液中孵育2 h(37℃)。用超敏ECL电化学发光试剂盒对膜进行显影曝光,再用Image J分析条带灰度值。
1.2.5 细胞凋亡检测 按照Annexin V-FITC/PI细胞凋亡检测试剂盒要求操作,首先将“1.2.2”各转染组细胞用500 μL的结合缓冲液悬浮,然后依次加入Annexin V-FITC、PI,避光反应后上流式细胞仪检测细胞凋亡情况。细胞总凋亡率(%)为Annexin V-FITC染色阳性细胞百分比与PI阳性染色细胞百分比之和。
1.2.6 克隆形成实验检测细胞的辐射敏感性 先用Siemens Primμs直线加速器6 mV高能X线,设置剂量率3 Gy/min,以0 Gy、2 Gy、4 Gy、6 Gy、8 Gy垂直照射10 cm×10 cm范围,距靶源30 cm,在辐射照射结束后放置在37℃,5%二氧化碳培养箱中常规培养传代,约培养4 d。平皿底部出现肉眼可见的小白点,用甲醇固定(15 min)和吉姆萨染色(25 min),最后在显微镜下观察细胞的克隆数,并计数。
1.2.7 双荧光素酶报告基因检测实验检测miR-525-5p与RECQL5的结合力 用生物信息学在线预测网站Target Scan(http://www.targetscan.org/)预测miR-525-5p的靶标。为了验证miR-525-5p与RECQL5之间的 靶 向关系 ,将RECQL5 3′UTR-WT(含RECQL5 3′UTR片 段)和RECQL5 3′UTR-MUT(含RECQL5 3′UTR片段突变体)克隆至载体psi-CHECK2中,构建荧光素酶报告载体psiCHECK2-RECQL5-3′UTR WT、psiCHECK2-RECQL5-3′UTR MUT。再用LipofectamineTM2000法分别将其与miR-525-5p、miR-NC、miR-525-5p抑制物(anti-miR-525-5p)、anti-miR-525-5p阴性对照(anti-miR-NC)共转染至MDA-MB-231,24 h后,按双荧光素酶报告基因检测试剂盒技术手册操作并分析检测结果。
1.2.8 统计学方法 实验数据的分析使用SPSS 21.0软件,数据相关图片的绘制使用GraphPad Prism 6.0,计量资料用表示,多组间数据比较采用单因素方差分析+LSD-t检验,两组比较采用独立样本t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 乳腺癌细胞中miR-525-5p、RECQL5的表达与MCF-10A组 相 比,MDA-MB-231、MCF-7、BT474组细胞中miR-525-5p mRNA表达显著降低,RECQL5 mRNA和蛋白表达均显著升高(P<0.05)。选择与正常细胞差异有统计学意义的MDA-MB-231细胞进行后续试验研究。见图1,表1。
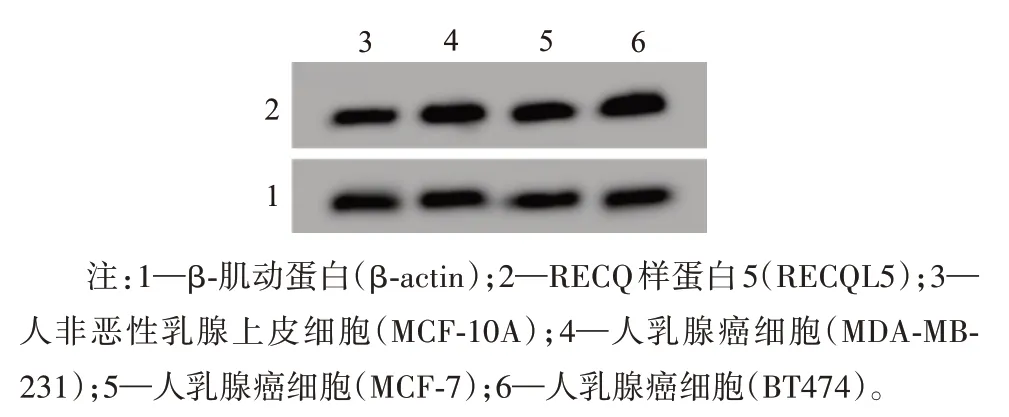
图1 RECQL5蛋白的表达
表1 miR-525-5p、RECQL5在乳腺癌细胞中的表达/
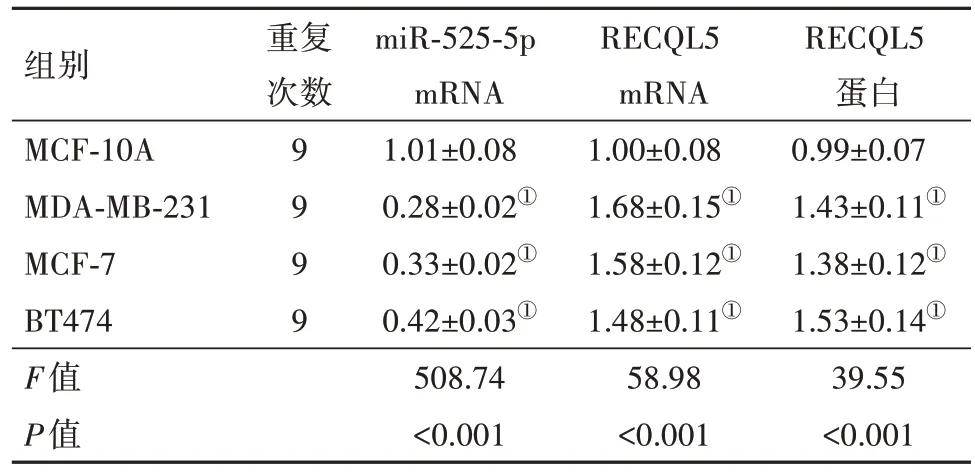
表1 miR-525-5p、RECQL5在乳腺癌细胞中的表达/
注:MCF-10A为人非恶性乳腺上皮细胞,MDA-MB-231、MCF-7、BT474为人乳腺癌细胞,miR-525-5p为微小RNA-525-5p,RECQL5为RECQ样蛋白5。①与MCF-10A组比较,P<0.05。
组别MCF-10A MDA-MB-231 MCF-7 BT474 F值P值重复次数9999 miR-525-5p mRNA 1.01±0.08 0.28±0.02①0.33±0.02①0.42±0.03①508.74<0.001 RECQL5 mRNA 1.00±0.08 1.68±0.15①1.58±0.12①1.48±0.11①58.98<0.001 RECQL5蛋白0.99±0.07 1.43±0.11①1.38±0.12①1.53±0.14①39.55<0.001
2.2 细胞凋亡及过表达miR-525-5p调节乳腺癌细胞的辐射敏感性与miR-NC组相比,miR-525-5p组MDA-MB-231细胞中miR-525-5p表达显著升高,细胞凋亡率显著升高,在2 Gy、4 Gy、6 Gy、8 Gy辐照下,细胞存活分数均显著降低(P<0.05),见表2;图2,3。miR-NC组、miR-525-5p组的单击多靶模型的参数值见表3,放射增敏比(SER)值为1.659,具有增敏作用。
表2 过表达miR-525-5p对乳腺癌细胞辐射敏感性的影响/

表2 过表达miR-525-5p对乳腺癌细胞辐射敏感性的影响/
注:miR-NC为微小RNA-525-5p模拟物阴性对照,miR-525-5p为微小RNA-525-5p。
组别miR-NC miR-525-5p t值P值重复次数99 miR-525-5p 1.00±0.06 1.86±0.07 27.98<0.001凋亡率/%7.43±0.54 25.76±1.15 43.28<0.001存活分数2 Gy 0.89±0.06 0.67±0.54 1.22<0.001 4 Gy 0.75±0.07 0.41±0.04 12.65<0.001 6 Gy 0.55±0.05 0.04±0.01 30.01<0.001 8 Gy 0.34±0.03 0.03±0.01 29.41<0.001

图2 过表达miR-525-5p调节乳腺癌细胞的凋亡
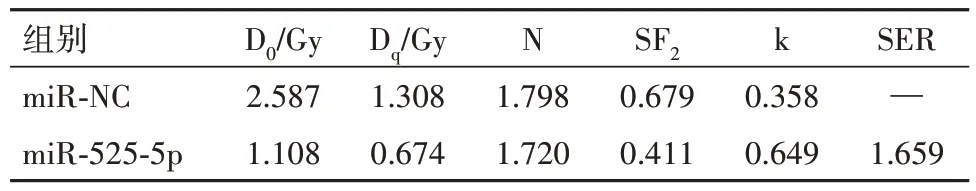
表3 miR-NC组、miR-525-5p组的单击多靶模型参数
2.3 miR-525-5p靶向RECQL5结果如图4A所示,生物信息学预测显示,miR-525-5p与RECQL5存在靶向互补结合位点。与miR-NC组相比,miR-525-5p组WT-RECQL5细胞的荧光活性显著降低0.23±0.02,1.00±0.08;与miR-NC组相比,miR-525-5p组细胞中RECQL5相对蛋白表达量显著降低0.20±0.02,1.01±0.08,与anti-miR-NC组相比,anti-miR-525-5p组细胞中RECQL5相对蛋白表达量显著升高1.79±0.16,1.00±0.09(图4B,P<0.05)。
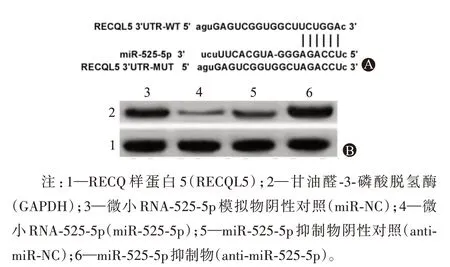
图4 RECQL5的3’UTR中含有与miR-525-5p互补的核苷酸序列和RECQL5蛋白表达
2.4 敲减RECQL5对乳腺癌细胞辐射敏感性的影响与si-NC组相比,si-RECQL5组MDA-MB-231细胞中RECQL5表达显著降低,细胞凋亡率显著升高,在2 Gy、4 Gy、6 Gy、8 Gy辐照下,细胞存活分数均显著降低(P<0.05),见表4,图5。si-NC组、si-RECQL5组的单击多靶模型的参数值见表5,SER值为1.882,具有增敏作用。

表5 si-NC组、si-RECQL5组的单击多靶模型参数

图5 敲减RECQL5对乳腺癌细胞辐射敏感性的影响:A为流式细胞仪检测细胞凋亡;B为Western blotting检测RECQL5蛋白表达
表4 敲减RECQL5对乳腺癌细胞辐射敏感性的影响/

表4 敲减RECQL5对乳腺癌细胞辐射敏感性的影响/
注:RECQL5为RECQ样蛋白5,si-NC为RECQ样蛋白5小干扰RNA阴性对照,si-RECQL5为RECQ样蛋白5小干扰RNA。
组别si-NC si-RECQL5 t值P值重复次数99 RECQL5 1.73±0.14 0.86±0.07 16.68<0.001凋亡率/%7.50±0.51 23.16±2.01 22.66<0.001存活分数2 Gy 0.89±0.09 0.67±0.06 6.10<0.001 4 Gy 0.75±0.07 0.41±0.04 14.62<0.001 6 Gy 0.55±0.05 0.04±0.01 30.01<0.001 8 Gy 0.34±0.03 0.03±0.01 29.41<0.001
2.5 过表达RECQL5逆转miR-525-5p对乳腺癌细胞辐射的增敏作用与miR-525-5p+pcDNA组相比,miR-525-5p+pcDNA-RECQL5组MDA-MB-231细 胞中miR-525-5p表达显著降低,细胞凋亡率显著降低,在2 Gy、4 Gy、6 Gy、8 Gy辐照下,细胞存活分数均显著升高(P<0.05),见表6,图6。miR-525-5p+pcDNA组、miR-525-5p+pcDNA-RECQL5组的单击多靶模型的参数值见表7,SER值为1.286,具有增敏作用。
表6 过表达RECQL5对miR-525-5p的乳腺癌细胞辐射增敏作用的影响/
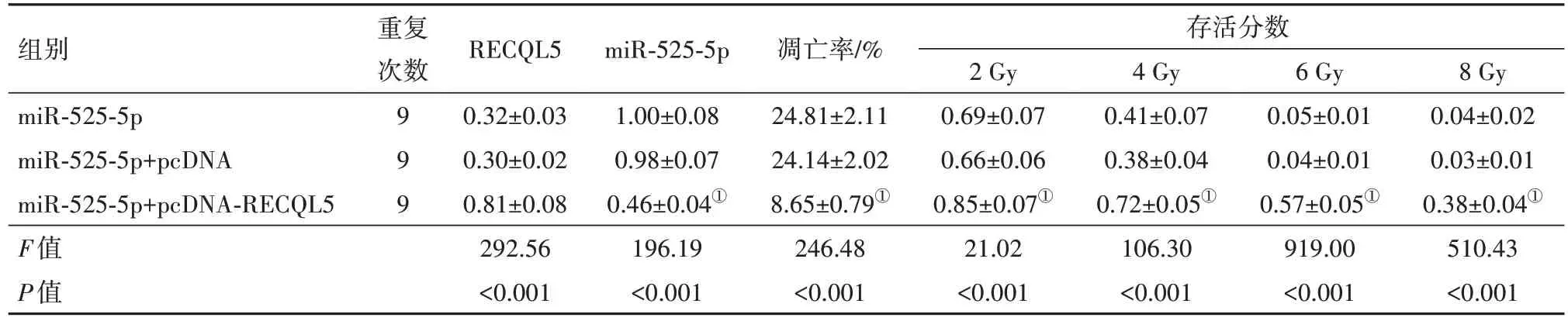
表6 过表达RECQL5对miR-525-5p的乳腺癌细胞辐射增敏作用的影响/
注:RECQL5为RECQ样蛋白5,miR-525-5p为微小RNA-525-5p,miR-525-5p+pcDNA为微小RNA-525-5p与RECQ样蛋白5过表达空载体,miR-525-5p+pcDNA-RECQL5为微小RNA-525-5p与RECQ样蛋白5过表达载体。①与miR-525-5p+pcDNA组比较,P<0.05。
组别miR-525-5p miR-525-5p+pcDNA miR-525-5p+pcDNA-RECQL5 F值P值重复次数999 RECQL5 0.32±0.03 0.30±0.02 0.81±0.08 292.56<0.001 miR-525-5p 1.00±0.08 0.98±0.07 0.46±0.04①196.19<0.001凋亡率/%24.81±2.11 24.14±2.02 8.65±0.79①246.48<0.001存活分数2 Gy 0.69±0.07 0.66±0.06 0.85±0.07①21.02<0.001 4 Gy 0.41±0.07 0.38±0.04 0.72±0.05①106.30<0.001 6 Gy 0.05±0.01 0.04±0.01 0.57±0.05①919.00<0.001 8 Gy 0.04±0.02 0.03±0.01 0.38±0.04①510.43<0.001

表7 miR-525-5p+pcDNA组、miR-525-5p+pcDNARECQL5组的单击多靶模型参数

图6 乳腺癌细胞凋亡及RECQL5蛋白表达:A为流式细胞仪检测细胞凋亡;B为Western blotting检测RECQL5转染情况
3 讨论
miRNA是一种有19-25个核苷酸组成的内源性、稳定的非编码小分子RNA,其可沉默靶基因的转录,抑制蛋白的翻译,进而参与癌症的进展[13]。Anne等[14]报道miR-525-3p在宫颈癌细胞、骨肉瘤细胞和脐静脉细胞融合细胞辐射照射后的表达水平明显上调,增强辐射照射的敏感性,并且miR-525-3p可靶向β抑制蛋白1(β-arrestin 1,ARRB1)、硫氧还蛋白(thioredoxin,TXN1)和热休克蛋白A9(heatshock protein A9,HSPA9),揭示miR-525-3p的上调及其直接靶标ARRB1、TXN1和HSPA9的下调是辐射后细胞存活的关键作用,提示miR-525-3p可能是改善放射敏感性的潜在靶标。Mark等[15]发现,在膀胱癌和乳腺癌中miR-525-3p为DNA修复基因结合位点miRNA之一,其表达水平异常下调,且对放射治疗后膀胱癌、乳腺癌病人的生存率具有明显的调控作用。令人遗憾的是,miR-525-5p对乳腺癌细胞辐射照射的敏感性的调控并未深入探究。本研究检测了乳腺癌细胞系MDA-MB-231、MCF-7、BT474中miR-525-5p的表达,结果显示,miR-525-5p异常降低,为其在癌症中的功能研究奠定基础;进一步研究发现,过表达miR-525-5p可促进乳腺癌细胞的凋亡,增强癌细胞对辐射照射的敏感性,为提高乳腺癌的放射治疗的疗效提供新的作用靶点;通过生物信息学分析、双荧光素酶报告基因检测实验及Western blotting证实miR-525-5p可负向调控RECQL5的表达。
RECQL5是RecQ家 族DNA解 旋酶的成员,在同源重组、碱基切除修复、复制和转录中具有关键作用[16]。Lin等[17]研 究发现胃 癌 组织中RECQL5 mRNA的表达显著下调,RECQL5的低表达与肿瘤的浸润深度,组织学分化程度和TNM分期显著相关,提示胃癌病人的预后较差。Arora等[18]的研究中发现,乳腺癌中RECQL5的表达水平明显升高,这与高组织学分级、更高的有丝分裂指数、去分化、多形性和生存率低显著相关,揭示了其在乳腺癌中的致癌功能,提示RECQL5是一种有前途的乳腺癌生物标志物。Sun等[19]发现,RECQL是一种潜在的乳腺癌易感基因,其突变有助于家族性乳腺癌的发展。因此,我们推测RECQL5在乳腺癌放射治疗中具有增敏作用。本研究检测了乳腺癌细胞中RECQL5的表达,发现RECQL5高表达,这与前人的研究结果均相一致;进一步研究发现,敲减RECQL5可促进乳腺癌细胞凋亡,增强其对辐照的敏感性,更重要的是,过表达RECQL5可逆转miR-525-5p对乳腺癌细胞辐照的增敏作用,这不仅说明RECQL5具有辐照增敏作用,其辐照增敏功能还受miR-525-5p的逆向调控。这些结果为增强乳腺癌放射治疗的疗效提供新靶点,探索miR-525-5p、RECQL5在乳腺癌中的功能机制提供更充分的实验依据。
综上所述,miR-525-5p可增强乳腺癌细胞对辐射照射的敏感性,这可能与其靶向RECQL5促进癌细胞凋亡有关,为乳腺癌的放射治疗提供新方向。
