藤茶内生真菌的分离鉴定及对宿主硒富集的影响
2022-09-22周防震刘水松龚琪雯陈梦洁鄢鹏飞
周防震,周 志,刘水松,龚琪雯,陈梦洁,鄢鹏飞
(1.硒食品营养与健康智能技术湖北省工程研究中心,湖北 恩施 445000;2.湖北民族大学生物科学与技术学院,湖北 恩施 445000)
硒是人体必需的微量元素之一,其生理功能已经得到国内外专家的广泛认可。研究表明,克山病、大骨节病以及其他免疫性疾病均与人体硒元素缺乏有关[1]。土壤中的无机硒主要是通过高等植物的同化作用进入食物链而被人体摄入的。国内有22个省、72%的人口生活的地方存在缺硒现象,这导致在缺硒地区的人体硒摄入量不足,存在低硒引发疾病的隐患[2]。因此,筛选富硒的植物尤其是富硒中药及富硒农产品具有重要的现实意义。
藤茶(Amepelopsis grossedentata)是一种非常古老的中草药资源、类茶植物资源和药食两用植物资源[3],具有抗炎、止咳、化痰和保肝护肝等多种生理活性[4]。研究表明,藤茶有效成分为黄酮类物质,主要成分为二氢杨梅素和杨梅素,其中前者占藤茶总黄酮的70%以上。藤茶活性成分二氢杨梅素的保肝护肝、抗肿瘤、降血糖等药理研究已有大量报道。尽管市场上广有富硒藤茶的宣传,但藤茶富硒方面的研究罕见报道。周成河等[5]通过藤茶盆栽试验,发现随着亚硒酸钠含量的升高,藤茶硒含量呈先降后升的规律;张朝阳等[6]通过藤茶大田试验,发现随着富硒生物有机肥用量的增加,藤茶嫩茶茎叶硒含量呈上升趋势。迄今,对藤茶富硒方面的研究以藤茶扦插苗为主,未见硒肥对藤茶实生苗硒富集的报道。本研究在前期藤茶硒含量抽样检测的基础上,针对龙须藤茶硒含量普遍不足的问题,继续深入研究藤茶内生真菌在藤茶实生苗硒富集中的作用,以期为藤茶的大田富硒栽培提供参考。
1 材料与方法
1.1 材料与试剂
藤茶成熟浆果采集于湖北省恩施市七里坪藤茶基地。引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)由上海英骏生物技术有限公司合成。改良马丁培养基(真菌培养基)购于杭州微生物试剂有限公司;NaClO购于武汉市中天化工有限责任公司;TaqDNA聚合酶购于TAKARA公司;盐酸、氢氧化钾、硼氢化钾(均为优级纯)和亚硒酸钠(化学纯)购于国药集团化学试剂有限公司;硒标准溶液购于环境保护部标准样品研究所。
1.2 主要仪器
所用仪器有ABI-2720 PCR扩增仪、Bio-rad凝胶成像系统、Milli-Q Advantage超纯水系统、MARS微波消解仪和AFS-930d原子荧光光度计。
1.3 方法
1.3.1 藤茶内生真菌的分离 用无菌水将藤茶种子表面冲洗干净,用75%乙醇浸泡2 min,用无菌水冲洗3次,5%次氯酸钠处理10 min,无菌水冲洗3次。将消毒的藤茶种子接种到PDA培养基上,置于37℃恒温箱中培养48 h。挑取菌丝接种到改良马丁培养基上纯化培养。挑取菌落边缘菌丝转接于分离培养基平板,得到藤茶种子源优势内生真菌的纯培养体。
1.3.2 内生真菌的基因组提取 称取少量的菌丝体(0.04 g),加入0.5 mL 1.5%(m/V)CTAB抽提液在预冷研钵中充分研磨;将研磨液转入1.5 mL离心管中,立即置于65℃水浴10 min,再加入200 μL乙酸铵(10 mol/L)冰浴8 min,12 000 r/min离心10 min;吸取上层水相至另一1.5 mL离心管中,加入0.5~0.6倍体积的冰预冷的异丙醇,颠倒混匀,-20℃放置15 min,12 000 r/min离心15 min,弃上清,75%乙醇洗涤两次,自然晾干,加入适量ddH2O,放入-20℃冰箱保存,待用。利用0.8%的琼脂糖凝胶电泳检测基因组提取情况。
1.3.3 ITS序列扩增 取PCR管,在其中添加以下各种反应液:ddH2O 7 μL、模板DNA 2 μL、上下游引物各0.5 μL、TaqDNA聚合酶(含dNTP混合物)10 μL、总体积20 μL;PCR扩增程序如下:95℃5 min;95℃30 s,58℃1 min,72℃30 s,30个循环;72℃ 延伸10 min,4℃保存。琼脂糖凝胶电泳检测PCR产物;PCR扩增产物由生工生物工程(上海)股份有限公司武汉分公司进行ITS序列测定。
1.3.4 藤茶实生苗的制备及移栽 将藤茶种子按常规方法育苗,待实生苗长度在4~7 cm时移入大田(北纬30°17′44″,东经109°29′48″,海拔440 m);大田土壤为黄棕壤,硒背景值为0.75 mg/kg。5周后进行内生真菌处理;晴天早晚各浇水一次。
1.3.5 内生真菌孢子悬液的制备及田间试验 血球计数板计数后,将内生真菌孢子悬液调整为高、低浓度两组,其浓度分别为5.0×106、2.5×106CFU/mL。藤茶实生苗共分为4个处理,分别为生理盐水对照组(CK)、根际施硒组(T1)和高(T2)、低(T3)浓度孢子悬液叶面喷施+根际施硒组,每处理组6株藤茶,重复3次。其中根际施硒量为每株50 mL浓度为80 mg/L亚硒酸钠溶液,而喷施以叶面有液滴滴落为标准。
1.3.6 藤茶硒含量的测定 内生真菌处理1个月后,收集藤茶茎尖至下方4层叶片,60℃干燥至恒重,放研钵中充分研磨待用。精确称取藤茶粉末0.200 g加入5 mL硝酸和1.25 mL H2O2,用微波消解仪以1 000 W、150℃消解40 min。于通风橱中180℃条件下赶酸至终体积1 mL左右,加入盐酸5 mL,继续赶酸至1 mL左右,然后用8%的盐酸定容至25 mL,待用。采用原子荧光光谱法,按照GB 5009.93—2017[7]测定硒浓度。硒标准品溶液经稀释后终浓度分别为1.0、2.5、5.0、10.0、25.0、50.0 μg/L。
1.4 数据处理
采用Origin2019进行硒标准曲线绘制,使用SPSS 16.0统计软件进行方差分析和多重比较。
2 结果与分析
2.1 内生真菌的分离
分离得到一株藤茶种子源优势内生真菌LZC-1,在改良马丁培养基上培养可见白色菌丝(图1a),光学显微镜下可见明显镰刀型孢子(图1b)。
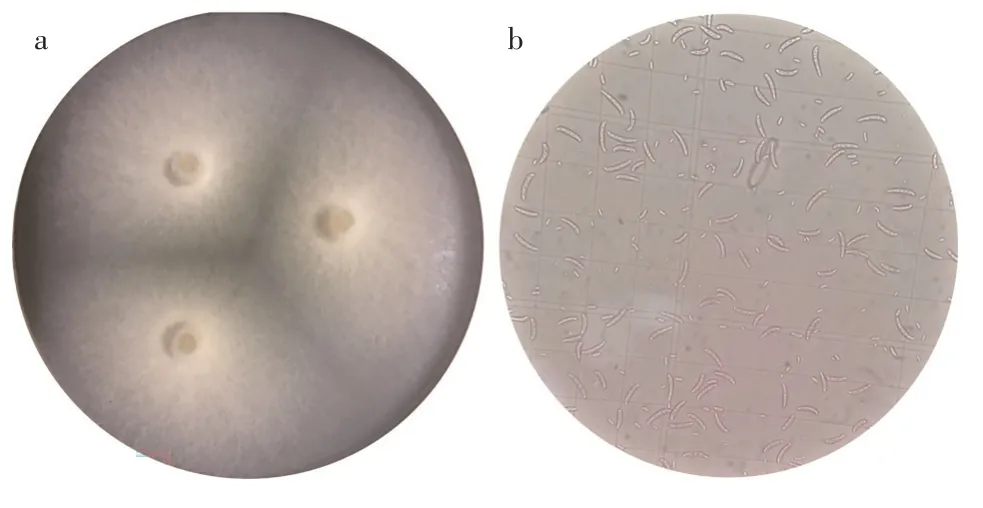
图1 LZC-1菌落及分生孢子形态
2.2 内生真菌的分子鉴定
分离纯化得到的内生真菌LZC-1经基因组提取,进行琼脂糖凝胶电泳。该基因大小在10 kb以上(图2),表明该基因组DNA提取成功。对LZC-1的rDNA-ITS序列进行PCR扩增,电泳检测结果显示该基因片段大小为500 bp(图3)左右,符合真菌通用引物扩增ITS基因序列片段的大小。将扩增出来的ITS序列测序,发现其片段长度为538 bp,将测序结果与NCBI数据库进行BLAST比对和系统进化树分析(图4),发现内生真菌LZC-1与镰孢菌属菌种(Fusariumsp.)最为相似,与形态学观察结果一致。
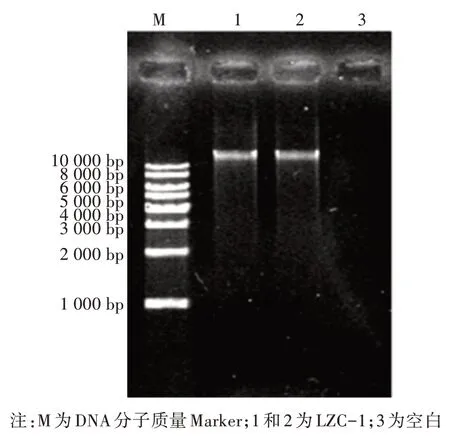
图2 内生真菌LZC-1基因组DNA电泳图谱
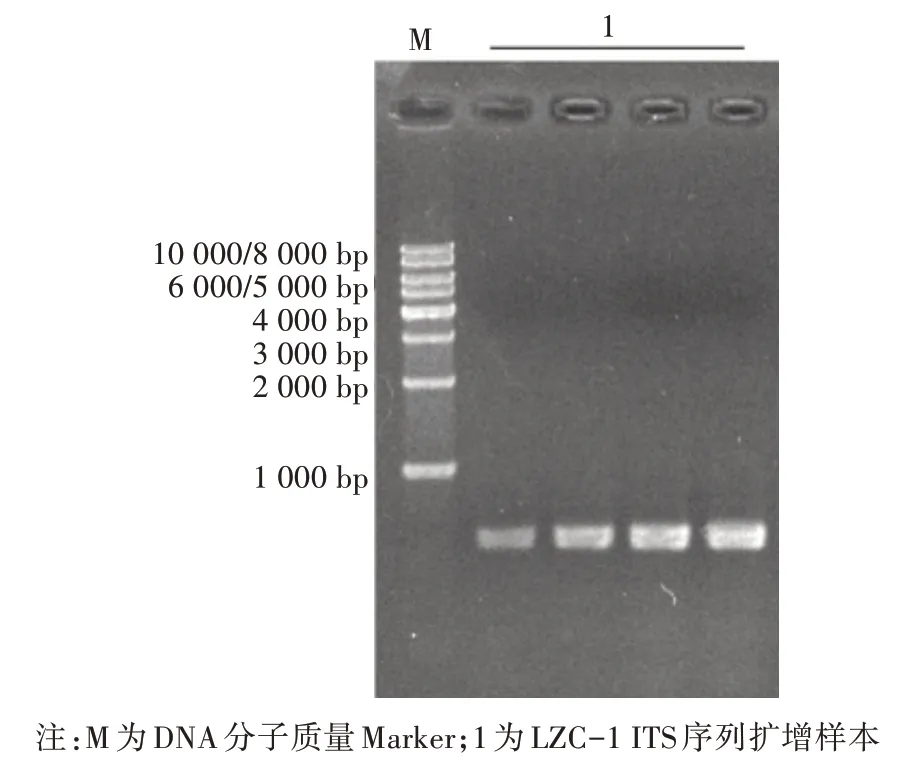
图3 内生真菌LZC-1 ITS序列扩增片段电泳图谱

图4 LZC-1的系统进化树分析
2.3 内生真菌对藤茶硒富集的影响
硒浓度在1~50 μg/L范围内,荧光值与浓度间有良好的线性关系,y=17.875 55+83.466 49x,R2=0.999 45(图5)。
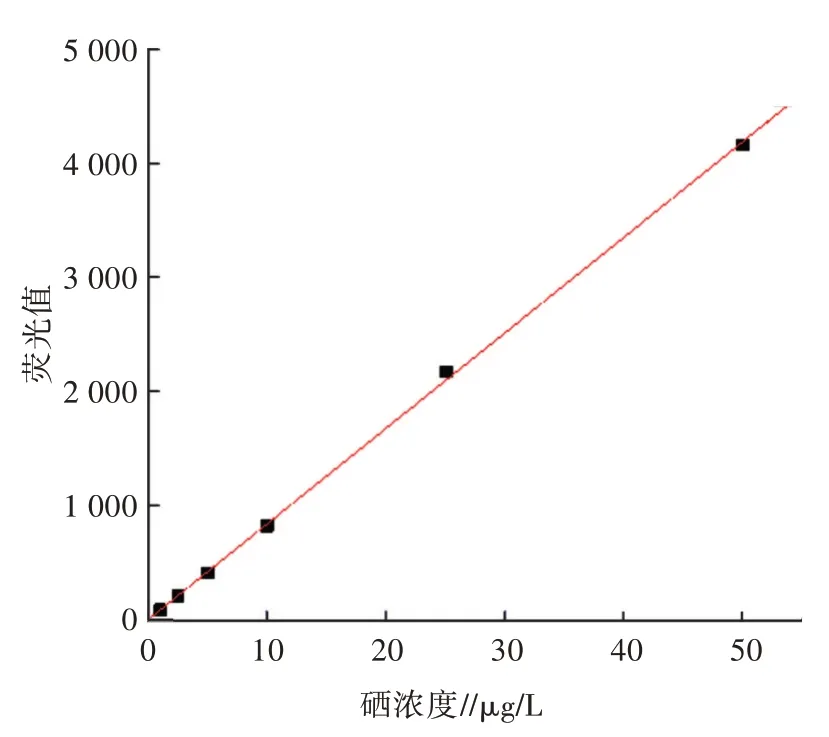
图5 硒溶液的标准曲线
根据标准曲线计算得藤茶供试样本中的硒含量如表1所示,可以看出高、低浓度内生真菌处理均能显著降低藤茶对硒的富集(P<0.01),且呈现明显的剂量依赖关系(P<0.05),高浓度内生真菌孢子悬液的抑制作用强于低浓度内生真菌孢子悬液。
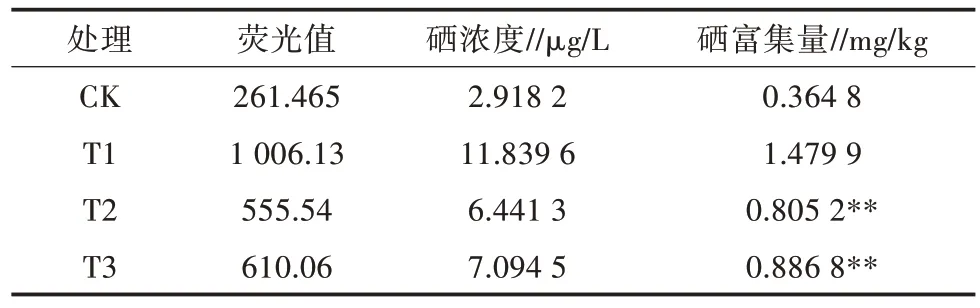
表1 LZC-1处理对藤茶中硒富集的影响
3 讨论
藤茶属于葡萄科蛇葡萄属的一种藤本植物,随着生理药理功能不断被发现[8,9],已开始被越来越多的人所青睐。藤茶及其总黄酮在抗氧化、降血糖、降血脂等方面表现出较好的活性,被认为是防治慢性代谢性疾病的一个非常有前景的研究对象;2013年藤茶叶被国家卫生计生委批准为新食品原料[10]。来凤藤茶是国家地理标志性保护产品,目前,来凤县藤茶产业基地面积达3 333 hm2,年产值近10亿元[6]。人工栽培的藤茶均采用枝条进行无性繁殖,除了有性繁殖需要增加育苗环节[11]以外,有性繁殖的藤茶种子育苗出苗率低,出苗晚及出苗不整齐等现象[11]也是其进行无性繁殖的重要原因。本研究也发现自然条件下藤茶种子萌发需要70 d以上,且萌发率只有5%左右。而同是葡萄科的植物葡萄,其种子通常在第7~9天开始萌发,且萌发率为19.4%~78.8%[12]。葡萄实生苗因寿命长、生长发育快、分生力和抗寒性强等优点,在生产上被广泛用作砧木培育葡萄耐寒性品系。前期研究发现无性繁殖的藤茶扦插苗带有多种内生菌,这些内生菌对藤茶萌发和硒富集的影响尚未见报道,亟待评估。
本研究从藤茶种子中分离和鉴定了一株优势内生真菌LZC-1,发现利用该菌的孢子悬液叶面喷施能显著降低宿主实生苗对土壤中硒的富集;同时发现根际施硒可以显著增加藤茶实生苗叶片中硒的富集。富硒栽培提高藤茶硒含量的结果与已有报道一致[5,6]。前期藤茶硒含量抽样检测结果显示,原产世界硒都湖北恩施来凤县的21家藤茶企业的龙须藤茶硒含量均值为0.030 4 mg/kg(数据未发表)。本研究中对照组藤茶中硒含量的测定值为0.36 mg/kg,明显高于龙须藤茶硒含量,可能原因是试验过程中采样的不同。有报道显示,老叶中的硒含量高于嫩叶硒含量[13,14];龙须藤茶是采用茎尖(龙须)部位,而本研究采样为藤茶茎尖至下方4层叶片。80 mg/L亚硒酸钠溶液根际施硒30 d后藤茶硒含量可以达1.48 mg/kg,与文献报道[15]结果基本一致。内生真菌LZC-1显著降低藤茶硒富集的结果暗示,内生真菌的积累以及富硒技术的缺乏可能是导致目前大田龙须藤茶硒富集不足的重要原因。
