大黄鱼STAT6分子特征及其在溶藻弧菌感染后表达模式研究*
2022-09-21袁晓琴孟钰帆任超群母尹楠陈新华
袁晓琴 陈 友 荣 毅 孟钰帆 任超群 母尹楠① 陈新华, 2①
大黄鱼分子特征及其在溶藻弧菌感染后表达模式研究*
袁晓琴1陈 友1荣 毅1孟钰帆1任超群1母尹楠1①陈新华1, 2①
(1. 福建农林大学生命科学学院 福建农林大学海洋学院 福建省海洋生物技术重点实验室 福建福州 350002; 2. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 山东青岛 266237)
信号转导和转录激活因子(signal transducers and activators of transcription, STAT)是兼具信号转导和转录活化功能的一类蛋白, 在细胞增殖、分化、迁移、凋亡等过程中发挥重要作用。目前, 关于鱼类基因的分子特征及其在病原感染过程中表达模式研究仍相对较少。克隆了大黄鱼基因()的开放阅读框序列, 其全长2 211个核苷酸, 编码1个含736个氨基酸的蛋白质。通过氨基酸序列分析发现,STAT6蛋白具有5个保守的功能结构域, 包括氨基端结构域、卷曲螺旋结构域、DNA结合结构域、SH2结构域和转录激活结构域。系统进化分析显示,STAT6和其他硬骨鱼类STAT6聚为一支, 与棘头梅童鱼() STAT6的亲缘关系最近, 与两栖类、鸟类和哺乳类STAT6的亲缘关系相对较远。实时荧光定量PCR结果显示,在所检测的大黄鱼各组织或器官中均有表达, 尤其在血液、鳃、脾脏等免疫相关组织中表达量相对较高; 蛋白免疫印迹实验显示其蛋白也在鳃和脾脏中高表达。溶藻弧菌()感染后, 大黄鱼头肾和脾脏组织中的mRNA水平都显著上调, 达到峰值时分别上升了3.82倍和6.54倍; 同时大黄鱼头肾组织中STAT6蛋白及其磷酸化蛋白水平也明显上调, 头肾白细胞细胞核内STAT6的蛋白量也显著增加。此外, 溶藻弧菌感染后,STAT6下游效应基因和表达水平显著升高。这些研究结果表明STAT6可能在大黄鱼抗病原感染的免疫应答中发挥重要作用, 该结果对于深入认识STAT蛋白在鱼类免疫防御中的调控机制具有重要意义。
大黄鱼; STAT6; 多克隆抗体; 表达模式; 免疫应答
信号转导和转录激活因子(signal transducers and activators of transcription, STAT)是一类既有信号转导又有转录活化功能的蛋白, 由特定的细胞因子、生长因子或激素激活, 在细胞增殖、分化、迁移、凋亡等过程中发挥重要作用(Sung, 2010)。STAT家族由7个成员组成: STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6, 它们都具有相对保守的功能结构域, 包括氨基端结构域(N-terminal interaction domain)、卷曲螺旋结构域(coiled-coil domain)、DNA结合域(DNA binding domain)、SH2结构域(Src homology 2)、磷酸化位点(phosphorylation site)和羧基端转录激活结构域(transcriptional activation domain) (宋舟等, 2012)。STAT6是辅助型T细胞2 (T helper 2 cell, Th2)分化过程中的特异性转录因子, 主要由白细胞介素4 (Interleukin-4, IL-4)和IL-13激活, 可促进Th2细胞增殖并分泌IL-4、IL-10、IL-13等细胞因子(Wills-Karp, 2008)。此外, 活化的STAT6还能够诱导精氨酸酶()、II类组织相容性复合物()、等基因表达(Kelly-Welch, 2005; Satoh, 2010)。
近年来, 已经在多种鱼类中鉴定得到了基因, 如斑点绿河豚() (Sung, 2010)、斑马鱼() (Mitra, 2010)、花鲈() (于小娜等, 2016)、鳜() (Guo, 2009)等。花鲈具有保守的结构特征, 在脾、头肾、鳃、大脑和肠组织中表达量相对较高, 哈维氏弧菌()刺激后, 其在脾、头肾、肠和鳃中的转录水平都显著上调(于小娜等, 2016); 鳜mRNA在脾脏中表达量最高, poly I: C刺激后48 h, 鳜仔鱼细胞系(MFF-1)中的表达水平也显著升高(Guo, 2009); 这些结果表明STAT6可能在鱼类的抗病原感染过程中发挥着重要作用。斑马鱼STAT6已被证实是IL-4信号通路的重要信号分子, IL-4诱导后STAT6磷酸化水平及细胞核内积累水平都显著升高, 说明IL-4通过激活STAT6促进B细胞增殖和特异性IgM的产生(Zhu, 2012; Bhattarai, 2016)。
大黄鱼()是我国重要的海水经济鱼类, 也是我国海水养殖鱼类中产量最高的鱼类(霍振华等, 2018)。但是随着大黄鱼养殖业的快速发展, 由细菌、病毒和寄生虫引发的疾病频繁暴发, 给大黄鱼产业造成了巨大的经济损失(Chen, 2003; Mu, 2014; 陈洪清, 2019; Li, 2020)。因此, 解析大黄鱼应对病原感染的免疫应答机制将有助于制定有效的病害防治措施。本研究克隆并鉴定了大黄鱼基因(), 利用荧光定量PCR、蛋白免疫印迹、免疫荧光等技术, 检测了其在健康大黄鱼组织或器官以及免疫细胞中的表达水平, 分析了溶藻弧菌()感染后大黄鱼头肾和脾脏中STAT6的表达变化, 这些结果表明STAT6可能在大黄鱼抗细菌感染的免疫应答中发挥重要作用。
1 材料与方法
1.1 样品采集
将购自宁德市富发水产有限公司的大黄鱼[体长: (15.0±1.3) cm; 体质量: (60.0±15.2) g]适应性养殖7 d, 水温为25 °C左右, 溶解氧为7.6 mg/L左右。将大黄鱼分为正常组、对照组和实验组, 每组40尾。实验组大黄鱼腹腔注射100 μL (1.0×108CFU)的溶藻弧菌, 对照组大黄鱼注射等体积无菌的磷酸盐缓冲液(phosphate buffered saline, PBS; pH=7.4), 分别于注射后 6、12、24和48 h 采集大黄鱼的头肾和脾脏组织样品, 每个时间点采集9尾。同时采集正常组大黄鱼的心脏、肝脏、脾脏、头肾、肠、血液、鳃、脑、皮肤和肌肉组织, 放入液氮中速冻, 于–80 °C超低温冰箱保存。
1.2 总RNA提取和cDNA合成
使用Eastep® Super Total RNA Extraction Kit (Promega, 美国)提取大黄鱼组织的总RNA, 再使用Eastep® RT Master Mix Kit (Promega, 美国)将提取的总RNA反转录成第一链cDNA, 具体操作步骤参照试剂盒的说明书。
1.3 LcSTAT6基因克隆与序列分析
从大黄鱼基因组数据库中查找到6基因的编码序列(GenBank登录号: XM_010748295.3), 根据预测序列设计特异引物(表1), 以大黄鱼脾脏cDNA为模板, PCR扩增其开放阅读框(open reading frame, ORF)序列, 并测序验证。生物信息学分析: 使用DNAMAN8进行多序列比对分析; 使用Simple Modular Architecture Research Tool (SMART)在线软件预测STAT6蛋白质的功能结构域; 利用MEGA7.0软件, 采用邻接法(Neighbor-joining)构建系统进化树, 其他物种的STAT6序列均来自GenBank数据库(序列信息详见表2)。
1.4 抗LcSTAT6多克隆抗体制备
利用在线软件BepiPred 1.0 Server (http://www. cbs.dtu.dk/services/BepiPred/)预测STAT6的抗原表位选取预测分值最高的区域QQPFSPSESLPPEGC (第691~704位氨基酸), 利用Fmoc固相合成法合成多肽, 合成的多肽再偶联血蓝蛋白(Keyhole Limpet Hemocyanin, KLH)制备成抗原, 浓度为1 mg/mL。按1︰1比例将抗原与弗氏完全佐剂混合, 免疫2只新西兰兔, 初次免疫使用抗原剂量为500 μg/只。2周后, 按1︰1比例将抗原与弗氏不完全佐剂混合, 加强免疫3次, 间隔时间为一周, 加强免疫使用抗原剂量为250 μg/只。最后一次免疫后第7天, 收集兔血清, 使用Protein A亲和层析柱(碧云天, 中国)纯化血清中多克隆抗体, 多克隆抗体效价采用间接酶联免疫吸附实验(Enzyme linked immunosorbent assay, ELISA)检测。ELISA方法如下: 以制备的多肽为包被抗原(浓度为20 μg/mL), 96孔板每孔加抗原100 μL, 4 °C包被过夜, 再使用2%的脱脂奶粉进行封闭; 以阴性兔血清为阴性对照, 将待测多克隆抗体梯度稀释, 每孔加100 μL, 37 °C孵育1 h, 经PBST缓冲液洗涤后, 加入偶联辣根过氧化物酶(HRP)的羊抗兔IgG (H+L)多克隆抗体(1:3 000)孵育1 h; 洗涤后加入显色液显色(索莱宝, 中国), 最后使用酶标仪测定OD450nm处的吸光值, 当测得的吸光值是阴性对照吸光值2倍时判定为阳性(多克隆抗体效价即是最大稀释度)。
表1 引物序列信息

Tab.1 Primer information
表2 大黄鱼STAT6与其他物种STAT6氨基酸序列的一致性分析

Tab.2 The identity between LcSTAT6 and other known STAT6 proteins
1.5 LcSTAT6在大黄鱼组织中的表达分析
利用针对基因的特异性引物-RT-F和-RT-R (表1), 并以大黄鱼基因作为内参基因, 进行荧光定量PCR实验, 检测在正常状态下和细菌感染后大黄鱼组织或器官中的表达水平。荧光定量PCR反应体系如下: 2×SYBR Green I (诺唯赞, 中国) 10 µL, 上下游引物(10 µmol/L)各0.1 µL, cDNA模板0.2 µL, 无菌水9.6 µL。反应条件: 95 °C预变性2 min, 95 °C变性15 s, 57 °C退火20 s, 72 °C延伸20 s, 共40个循环。采用2–ΔΔCt方法计算的相对表达水平(Livak, 2001), 并使用SPSS 18.0软件进行统计学分析。
1.6 蛋白质免疫印迹(Western Blot)
在组织匀浆器中加入1 mL组织裂解液和约100 mg大黄鱼组织, 利用组织匀浆器裂解组织, 匀浆液经4 °C, 15 000离心10 min, 收集上清。上清内蛋白经12% SDS-PAGE电泳后, 转移到聚偏氟乙烯(PVDF)膜(Millipore, 德国)上, 在含有5% ()脱脂奶粉的TBST缓冲液中封闭1 h, 然后使用本实验制备的抗STAT6多克隆抗体(1︰1 000)孵育1 h, 经TBST缓冲液洗涤后, 再用偶联辣根过氧化物酶(HRP)的羊抗兔IgG(H+L)多克隆抗体(Abmart,中国; 1:5 000)孵育1 h, 最后使用化学发光检测试剂(新赛美, 中国)进行显色。β-微管蛋白(β-tubulin)作为蛋白内参, 所用抗体为鼠抗人β-tubulin单克隆抗体(Abmart, 中国; 1︰3 000)。
1.7 间接免疫荧光实验(Indirect immunofluorescence assay, IFA)
取健康大黄鱼的头肾组织, 置于70 µm细胞滤网(BD, 美国)上轻轻研磨, 用含1%肝素钠的PBS冲洗制成细胞悬液, 再将细胞悬液添加到34%/51% Percoll溶液(Thermo, 美国)表面, 4 °C, 650离心30 min。离心后, 吸取中间细胞层, 使用L-15培养基(HyClone, 美国)洗涤3次, 再使用5 mL L-15培养基重悬细胞, 按照每孔2.0×106个细胞接种到6孔板, 即获得大黄鱼头肾原代白细胞(Mu, 2018)。向大黄鱼头肾原代白细胞中加入500 μL预冷的4%组织细胞固定液(索莱宝, 中国), 室温固定30 min, 再加入2 μg鼠抗人β-tubulin抗体和制备的抗STAT6多克隆抗体, 清洗之后加入Alexa Fluor 488标记羊抗鼠IgG (H+L) (Abmart, 中国)和Alexa Fluor 647羊抗兔IgG (H+L) (1:200), 最后使用激光共聚焦显微镜(徕卡DMI8, 德国)观察结果。
2 结果
2.1 大黄鱼STAT6分子特征与进化分析
基因ORF全长2 211个核苷酸, 编码1个含有736个氨基酸(amino acid, aa)的蛋白质(图1), 该蛋白的分子量为83.5 kDa, 等电点为7.33。氨基酸序列分析结果显示:STAT6与哺乳动物STAT6类似, 具有5个保守的功能结构域: 氨基端结构域(1~106 aa)、卷曲螺旋结构域(126~288 aa)、DNA结合结构域(290~535 aa)、SH2结构域(544~631 aa)和转录激活结构域(632~736 aa) (图2)。序列一致性分析发现,STAT6与棘头梅童鱼() STAT6的序列一致性最高, 达到89.76%, 其次为豹纹鳃棘鲈()、乌鳢()、奥利亚罗非鱼()以及虹鳟(), 序列一致性分别为85.21%、78.09%、70.88%和64.83% (表2)。系统进化分析显示,STAT6 与其他鱼类的STAT6聚为一支, 而哺乳类、两栖类和鸟类的STAT6聚为一支;STAT6与棘头梅童鱼STAT6的亲缘关系最近(图3)。

图1 大黄鱼STAT6核苷酸与氨基酸序列
注: 单下划线指示氨基端结构域, 阴影指示卷曲螺旋结构域, 方框指示DNA结合结构域, 虚线指示SH2结构域, 双下划线指示转录激活结构域, 星号代表终止密码子
2.2 LcSTAT6在正常大黄鱼组织或器官中的表达谱
采用荧光定量PCR技术检测了正常大黄鱼血液、鳃、心脏、脾脏、脑、头肾、肌肉、肝脏、肠和皮肤等器官或组织中的表达水平。结果显示:mRNA在所有检测的器官或组织中均有表达, 其中在血液中的表达量最高, 其次为鳃、心脏和脾脏, 皮肤中的表达量最低(图4a)。为了研究STAT6蛋白在不同组织或器官中表达水平, 我们制备了兔抗STAT6的多克隆抗体, 获得抗体2.7 mg, 浓度为1.6 mg/mL, 效价约为 1×107(图4b)。使用该抗体进行蛋白免疫印迹实验, 结果显示:STAT6蛋白在大黄鱼头肾、脾脏、皮肤和鳃中均有表达, 在鳃组织中蛋白水平显著高于头肾、脾脏和皮肤(图4c, 4d)。

图2 大黄鱼STAT6与其他物种同源蛋白的氨基酸序列比对
注: 序列上方的直线分别指示氨基端结构域、卷曲螺旋结构域、DNA结合结构域、SH2结构域和转录激活结构域

图3 邻接法构建的STAT6系统进化树
注: 基于大黄鱼和其他脊椎动物STAT6氨基酸序列构建了系统进化树, 使用的软件是MEGA 7.0
注: a. 荧光定量PCR检测在大黄鱼组织中的表达谱; b. 间接ELISA分析抗STAT6多克隆抗体效价; c. 蛋白免疫印迹检测STAT6蛋白在大黄鱼头肾、脾脏、皮肤和鳃组织中表达; d. 蛋白免疫印迹结果的灰度值分析
2.3 溶藻弧菌感染后LcSTAT6转录与蛋白水平变化
为了了解STAT6是否参与大黄鱼免疫应答, 使用溶藻弧菌感染大黄鱼, 检测大黄鱼头肾和脾脏中的转录和蛋白表达水平变化。结果显示: 溶藻弧菌感染后, 大黄鱼头肾和脾脏中的转录水平均从6 h开始上调, 在24 h达到最高值, 分别是对照组的3.82倍和6.54倍, 而48 h时其表达量回落至对照组的1.49倍和2.01倍(图5a)。通过蛋白免疫印迹分析发现, 溶藻弧菌感染后48 h, 大黄鱼头肾组织中磷酸化的STAT6蛋白明显增加, 是对照组的1.43倍(图5b, 5c), 同时大黄鱼头肾白细胞细胞核内红色荧光明显多于对照组, 说明溶藻弧菌感染后细胞核内STAT6蛋白量也显著增加(图5d)。
2.4 溶藻弧菌感染后LcSTAT6下游基因表达变化
如图6所示, 溶藻弧菌感染后, 大黄鱼脾脏和头肾中STAT6下游基因的转录水平在12 h均有所下调, 24 h开始升高, 分别于24 h和48 h达到最高值, 是对照组的1.39倍和1.63倍(图6a)。相对于, 大黄鱼脾脏和头肾中的转录水平变化更为明显, 表达量从12 h就开始增加, 分别于24 h和48 h达到峰值, 是对照组的6.07倍和2.38倍(图6b)。
3 讨论
JAK-STAT信号通路参与多种细胞因子和生长因子信号转导的途径, 在细胞增殖、分化、凋亡、炎症等过程都发挥重要作用(吴平, 2014)。STAT蛋白是细胞质转录因子, 与激活的受体复合物结合后被激活, 形成二聚体后转移到细胞核, 在核内激活靶基因的转录(Rawlings, 2004)。在哺乳动物中, 有7种具有不同功能的STAT蛋白, 其中STAT6不仅参与调节免疫系统, 而且与细胞增殖、凋亡及肿瘤的发生密切相关(宋舟等, 2012)。目前, 已经在多种鱼类中鉴定了基因, 发现其具有相对保守的结构特征(Guo, 2009; Sung, 2010; 吴平, 2014;于小娜等, 2016), 但是关于鱼类STAT6在病原感染过程中表达模式的报道仍相对较少。

图5 溶藻弧菌感染后大黄鱼LcSTAT6转录与蛋白表达水平变化
注: a. 荧光定量PCR检测溶藻弧菌感染后大黄鱼头肾和脾脏中基因的转录水平变化; b. 蛋白免疫印迹检测溶藻弧菌感染后大黄鱼头肾白细胞中STAT6的蛋白水平变化; c. 蛋白免疫印迹结果的灰度值分析; d. 使用激光共聚焦显微镜观察溶藻弧菌感染后大黄鱼头肾白细胞中STAT6的蛋白分布情况
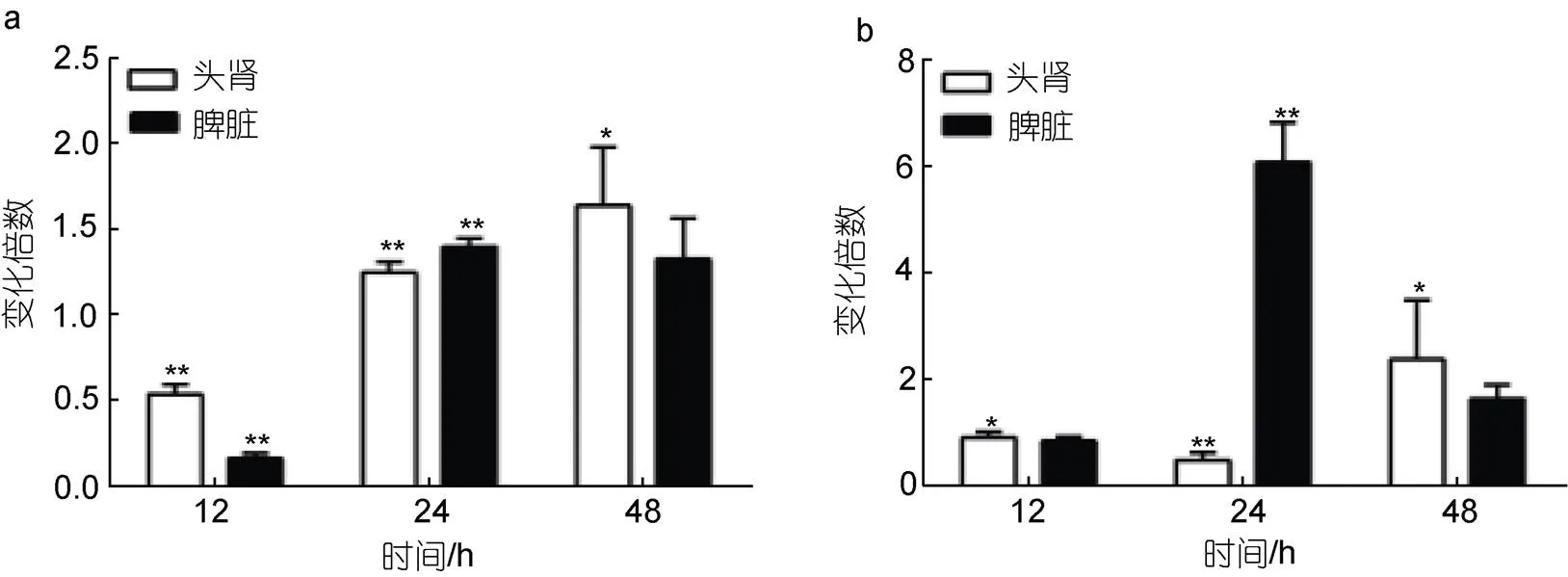
图6 溶藻弧菌感染后LcSTAT6下游基因表达变化
注: 荧光定量PCR检测溶藻弧菌感染后STAT6下游基因mRNA表达情况。a.; b.。*代表显著性差异(<0.05), **代表差异极显著(<0.01)
本研究从大黄鱼脾脏中克隆得到了基因的ORF序列, 包含2 211个核苷酸, 编码1个含有736个氨基酸的蛋白质。经序列比对分析发现,STAT6与哺乳类STAT6相似, 具有5个保守的功能结构域, 包括氨基端结构域、卷曲螺旋结构域、DNA结合结构域、SH2结构域和转录激活结构域。这些结构域的作用在哺乳类中已经研究得较为清楚, 其中氨基端结构域有助于DNA结合域与DNA的结合, 卷曲螺旋结构域对整个蛋白的结构维持起刚性骨架作用(吴平, 2014); DNA结合结构域主要作用是在蛋白发生磷酸化入核后与特异的DNA序列结合, 促进相应基因转录(宋舟等, 2012); SH2结构域是STAT蛋白序列上最保守和功能上最重要的区域, 对其二聚化起关键作用(宋伦等, 2000); 羧基端转录激活结构域主要介导与转录起始复合物中的其他成分相互作用(张颖芬, 2009)。系统进化分析表明,STAT6与其他鱼类STAT6聚为1支, 独立于哺乳类、两栖类和鸟类的STAT6形成的分支, 表明鱼类STAT6和其他物种STAT6存在共同的祖先, 预示着鱼类STAT6可能具有与哺乳动物STAT6相似的功能, 但在进化上又有一定的差异, 可能演化出鱼类特有的功能特性。
组织表达分析表明,在所检测的组织中均有表达, 但在血液、鳃和心脏组织中表达量相对较高, 在肝脏、肠和皮肤中表达量相随较少。斑点绿河豚的组织分布模式与类似, 也是在心脏中表达量较高, 但在肠道、肝脏和睾丸中表达量也相对较高, 这与有所不同(Sung, 2010)。鳜和黄颡鱼()mRNA在脾脏中表达量最高, 其次为心脏、鳃和肾脏(Guo, 2009; Wu, 2016)。花鲈mRNA在脾、头肾和肠组织中高表达, 但在心脏、眼和肌肉中表达量相对较低(于小娜等, 2016)。虽然不同鱼类的组织表达模式略有差异, 但都在免疫器官如头肾、脾脏和血液中表达量相对较高, 可能由于这些免疫器官中含有大量免疫细胞, 如巨噬细胞、淋巴细胞、粒细胞等(母尹楠等, 2020),在免疫器官中高表达可能是在某些免疫细胞中表达量较高所致。
为了探明STAT6在大黄鱼免疫应答中的作用, 我们检测了溶藻弧菌感染后STAT6在两个重要免疫器官头肾和脾脏中的表达变化。结果发现溶藻弧菌感染后, 大黄鱼脾脏和头肾中的转录水平都显著上调, 头肾组织中磷酸化的STAT6蛋白明显增加, 头肾白细胞细胞核内STAT6蛋白的累积量也显著增加, 表明溶藻弧菌感染激活了STAT6信号转导通路。相似的结果在其他鱼类中也有报道, 当花鲈腹腔注射哈维氏弧菌后,在脾和头肾组织中表达水平也显著上调(于小娜等, 2016); 除此之外, 研究还发现鳜表达也能被poly I:C诱导(Guo, 2009); 这些结果表明STAT6在鱼类抗病原感染过程中起着重要作用。此外, 我们还发现, 溶藻弧菌感染后STAT6下游基因(和)表达水平显著升高, 说明入核后的STAT6可能与其特定的DNA结合位点结合, 调控效应基因转录。
4 结论
综上所述, 本研究鉴定了大黄鱼的分子特征, 通过荧光定量PCR、蛋白免疫印迹、免疫荧光等技术发现大黄鱼在所有检测的组织或器官中呈组成型表达, 溶藻弧菌感染后, 其转录水平、蛋白水平、磷酸化水平以及细胞核内累积水平都显著升高, 同时其下游效应基因表达水平也显著上调, 这些研究结果表明STAT6可能在大黄鱼抗病原感染的免疫应答中发挥重要作用, 为今后阐明STAT6在鱼类免疫应答中的调控机制提供基础数据。
于小娜, 刘艳杰, 钱云霞, 2016. 鲈鱼stat6 cDNA克隆及表达分析[J]. 生物学杂志, 33(5): 53-57.
母尹楠, 李婉茹, 何亮华, 等, 2020. 大黄鱼HIF-1α基因的克隆鉴定与表达分析[J]. 水生生物学报, 44(2): 296-302.
吴平, 2014. 鲤鱼JAK/STAT分子的基因克隆及组织表达模式分析[D]. 武汉: 华中师范大学: 5-11.
宋伦, 沈倍奋, 2000. Jak/STAT信号转导途径研究新进展[J]. 免疫学杂志, 16(1): 68-71.
宋舟, 张立艳, 董海兵, 等, 2012. JAK-STAT信号通路研究进展[J]. 中国畜牧兽医, 39(6): 128-132.
张颖芬, 2009. 鳜鱼JAK、STAT家族的分子克隆和JAK-STAT通路功能的初步鉴定[J]. 广州: 中山大学: 4-7.
陈洪清, 2019. 一株大黄鱼致病性溶藻弧菌的分离鉴定与毒力相关基因分析[J]. 渔业研究, 41(6): 487-493.
霍振华, 张晓林, 李葳帅, 等, 2018. 传统“弓鱼”技术对延长大黄鱼存活时间的探讨[J]. 渔业研究, 40(5): 393-398.
BHATTARAI P, THOMAS A K, COSACAK M I,, 2016. IL4/STAT6 signaling activates neural stem cell proliferation and neurogenesis upon amyloid-β42 aggregation in adult zebrafish brain [J]. Cell Reports, 17(4): 941-948.
CHEN X H, LIN K B, WANG X W, 2003. Outbreaks of an iridovirus disease in maricultured large yellow croaker,(Richardson), in China [J]. Journal of Fish Diseases, 26(10): 615-619.
GUO C J, ZHANG Y F, YANG L S,, 2009. The JAK and STAT family members of the mandarin fish: molecular cloning, tissues distribution and immunobiological activity [J]. Fish & Shellfish Immunology, 27(2): 349-359.
KELLY-WELCH A, HANSON E M, KEEGAN A D, 2005. Interleukin-4 (IL-4) pathway [J]. Science's STKE, 2005(293): cm9.
LI C W, WANG S L, REN Q L,, 2020. An outbreak of visceral white nodules disease caused byat a water temperature of 12°C in cultured large yellow croaker () in China [J]. Journal of Fish Diseases, 43(11): 1353-1361.
LIVAK K J, SCHMITTGEN T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod [J]. Methods, 25(4): 402-408.
MITRA S, ALNABULSI A, SECOMBES C J,, 2010. Identification and characterization of the transcription factors involved in T-cell development,,and, within the zebrafish,[J]. FEBS Journal, 277(1): 128-147.
MU Y N, LI M Y, DING F,, 2014.characterization of the spleen transcriptome of the large yellow croaker () and analysis of the immune relevant genes and pathways involved in the antiviral response [J]. PLoS One, 9(5): e97471.
MU P F, WANG Y H, AO J Q,, 2018. Molecular cloning and bioactivity of an IL-2 homologue in large yellow croaker () [J]. Fish & Shellfish Immunology, 81: 309-317.
RAWLINGS J S, ROSLER K M, HARRISON D A, 2004. The JAK/STAT signaling pathway [J]. Journal of Cell Science, 117(8): 1281-1283.
SATOH T, TAKEUCHI O, VANDENBON A,, 2010. The Jmjd3-axis regulates M2 macrophage polarization and host responses against helminth infection [J]. Nature Immunology, 11(10): 936-944.
SUNG S C, CHENG C H, CHOU C M,, 2010. Expression and characterization of a constitutively active STAT6 from[J]. Fish & Shellfish Immunology, 28(5/6): 819-828.
WILLS-KARP M, FINKELMAN F D, 2008. Untangling the complex web of IL-4- and IL-13-mediated signaling pathways [J]. Science Signaling, 1(51): pe55.
WU K, TAN X Y, XU Y H,, 2016. JAK and STAT members of yellow catfishand their roles in leptin affecting lipid metabolism [J]. General and Comparative Endocrinology, 226: 14-26.
ZHU L Y, PAN P P, FANG W,, 2012. Essential role of IL-4 and IL-4Rα interaction in adaptive immunity of zebrafish: insight into the origin of Th2-like regulatory mechanism in ancient vertebrates [J]. Journal of Immunology, 188(11): 5571-5584.
MOLECULAR CHARACTERIZATION AND EXPRESSION ANALYSIS OFIN LARGE YELLOW CROAKER () AFTERINFECTION
YUAN Xiao-Qin1, CHEN You1, RONG Yi1, MENG Yu-Fan1, REN Chao-Qun1, MU Yin-Nan1, CHEN Xin-Hua1, 2
(1. Key Laboratory of Marine Biotechnology of Fujian Province, College of Marine Sciences, College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China)
Signal transducers and activators of transcription (STAT) is a type of protein with both signal transduction and transcription activation function, and plays an important role in cell proliferation, differentiation, migration and apoptosis. In recent years,has been identified in several fish species. However, very few information is available about its expression pattern during pathogen infection. We cloned the full length of open reading frame (ORF) ofgene () in large yellow croaker (), which contained 2 211 nucleotides encoding a peptide of 736 amino acids. The deducedSTAT6 protein contained five typical functional domains: N-terminal interaction domain, coiled-coil domain, DNA binding domain, SH2 domain, and transcriptional activation domain. Phylogenetic analysis showed thatSTAT6 formed a separate clade with sequences from other fish species and was far from the clades of avian, amphibian, and mammalian STAT6 proteins. TheSTAT6 was most closely related toSTAT6.mRNA was constitutively expressed in all examined tissues of large yellow croaker, especially higher in blood, gill, and spleen. The Western blot showed thatSTAT6 was highly expressed in gills and spleen. After being infected with, the mRNA expression level ofwas elevated in head kidney and spleen, and its phosphorylated protein level in head kidney of large yellow croaker were significantly up-regulated. Indirect immunofluorescence assay showed thatSTAT6 was activated and transferred into the nucleus of leukocytes from head kidney afterinfection. Moreover, the transcriptional levels of the downstream genes (and) ofSTAT6 were also up-regulated in head kidney and spleen tissues afterinfection. These results indicate thatSTAT6 may play important roles in the immune response to pathogen infection of large yellow croaker, and provide valuable information for understanding the regulation mechanism of STAT6 in fish immune defense.
large yellow croaker (); STAT6; polyclonal antibody; expression pattern; immune response
Q789; S965
10.11693/hyhz20211200326
*国家自然科学基金面上项目, 32073007号; 福建省自然科学基金杰青项目, 2021J06016号; 财政部和农业农村部: 国家现代农业产业技术体系资助, CARS-47号; 福建农林大学优博项目, 324-1122YB063号。袁晓琴, 博士研究生, E-mail: 1825639283@qq.com
陈新华, 博士生导师, 教授, E-mail: chenxinhua@tio.org.cn; 母尹楠, 博士, 硕士生导师, E-mail: muyinnan@ 163. com
2021-12-15,
2022-01-26
