鲤疱疹病毒2型(CyHV-2)灭活疫苗制备及其免疫效力测定*
2022-09-21潘晓艺蔺凌云姚嘉赟尹文林刘忆瀚沈锦玉
潘晓艺 蔺凌云 朱 悦 姚嘉赟 尹文林 刘忆瀚 陈 凡 沈锦玉, ①
鲤疱疹病毒2型(CyHV-2)灭活疫苗制备及其免疫效力测定*
潘晓艺1蔺凌云1朱 悦2姚嘉赟1尹文林1刘忆瀚1陈 凡3①沈锦玉1, 2①
(1. 浙江省淡水水产研究所 农业农村部淡水渔业健康养殖重点实验室 浙江省鱼类健康与营养重点实验室 浙江湖州 313001; 2. 浙江海洋大学水产学院 浙江舟山 316022; 3. 杭州市农业技术推广中心 浙江杭州 310001)
鲫造血器官坏死病是由鲤疱疹病毒2型(CyHV-2)引起的危害我国养殖鲫鱼()最严重的病毒性疾病。为制备有效预防鲫造血器官坏死病的灭活疫苗, 以CyHV-2代表流行株CNDF-TB2015为疫苗株, 以CSC细胞系进行病毒增殖, 并采用不同浓度的病毒对不同规格鲫鱼进行攻毒, 建立攻毒模型。结果表明, 培养的病毒滴度达1010TCID50/mL, 以4×107TCID50/尾的剂量腹腔注射感染体重300 g的鲫鱼可造成100%的死亡率。对病毒灭活剂甲醛、β-丙内酯和BEI灭活条件进行筛选优化, 对疫苗免疫佐剂763A、IMS1312、铝胶和M402进行筛选, 结果表明, 浓度为108.3TCID50/mL的病毒液最佳灭活条件为终浓度10 mmol/L的BEI 37 °C灭活72 h, 疫苗制备最佳佐剂为水佐剂IMS1312。对灭活疫苗的最小免疫剂量、最佳免疫剂量和有效免疫产生期进行测定, 结果表明, 要获得70%以上保护率的最小免疫剂量为8×106TCID50/尾, 最佳免疫剂量为4×107TCID50/尾, 在免疫4周后保护率可达80%, 5周后保护率达到100%。制备的灭活疫苗为鲫造血器官坏死病的免疫预防提供了有力手段, 也为其他水产动物病毒灭活疫苗的制备提供了借鉴。
鲤疱疹病毒2型; 鲫造血器官坏死病; 灭活疫苗; 免疫效力
鲤疱疹病毒2型(Cyprinid herpesvirus 2, CyHV-2)是造成鲫造血器官坏死病的病原, 可感染鲫鱼及其变种。自1992年在日本金鱼养殖场首次发现该病以来, 至今已在21个国家被报道(Jung, 1995; Thangaraj, 2021)。2010年传入我国以来, 该病已在我国大部分的鲫鱼养殖区相继发生, 死亡率高达80%以上(Xu, 2013; 袁雪梅等, 2019), 已成为影响我国鲫鱼养殖业最严重的疾病, 虽没被列入动物疫病名录, 但2020年在全国监测的15个省范围内, 监测到的样品阳性率达到3.8% (农业农村部渔业渔政管理局等, 2021), 表明对该病的防控迫在眉睫。
针对水产动物病毒性疾病的治疗, 疫苗的免疫预防是最为有效的手段之一。廖红等(2016)以CyHV-2的ORF5的截短基因表达的蛋白制作成亚单位疫苗, 进行异育银鲫的免疫, 按50 μg/ind.每7 d连续免疫三次后进行攻毒, 获得了35%的保护率。周勇等(2018)利用CyHV-2 ORF25蛋白的抗原表位, 制备了重组蛋白亚单位疫苗, 免疫鲫鱼后, 相对免疫保护率能达到47%。李坤(2018)构建的ORF66和ORF72的重组杆状病毒疫苗, 免疫后没有获得免疫应答。然而, 串联ORF66、ORF72、ORF81、ORF82四个基因构建的重组杆状病毒, 对鲫鱼分别进行注射和口服免疫, 攻毒保护率分别达到80%和40.69%。以上针对CyHV-2抗原蛋白的亚单位疫苗都获得了一定的免疫保护率。
然而, 由于敏感细胞系对CyHV-2病毒增殖效率不是很高, 因此在灭活疫苗上的研究较少。最近几年针对CyHV-2, 马杰和魏钰娟等分别建立了可稳定增殖CyHV-2病毒的鲫脑组织细胞系(GiCB) (Ma, 2015)和鲫鱼脊髓组织细胞系(CSC) (魏钰娟等, 2020), 传代病毒滴度分别可达到10(7.5±0.37)TCID50/mL和109.33TCID50/mL, 这为灭活疫苗的制备提供了高效的病毒增殖细胞。根据Zhang等(2016)采用GiCB细胞扩增病毒, 制备了β-丙内酯灭活的CyHV-2灭活疫苗, 免疫鲫鱼后能同时诱导鱼体产生非特异性和特异性的抗病毒免疫反应, 免疫保护率达到了71.4%。
本研究采用建立的CSC细胞系扩培CyHV-2, 优化灭活条件和最小免疫剂量, 建立攻毒模型, 免疫鲫鱼后测定免疫产生期和攻毒保护率, 评价疫苗的免疫效力, 以期为鲫造血器官坏死病的免疫预防提供有效的灭活疫苗。
1 材料与方法
1.1 试验材料
100~500 g的健康鲫鱼()购于浙江省淡水水产研究所八里店基地, 于室内循环水养殖系统暂养, 水温为(24±1) °C。鲤疱疹病毒2型(CyHV-2)敏感细胞系CSC (CCTCC No.: C2018211)由本实验室建立并保存(沈锦玉等, 2019), CyHV-2疫苗株选取区域流行代表毒株CNDF-TB2015 (GenBank: MN201961.1), 本实验室保存。胎牛血清、双抗、胰酶和M199培养基购自Gibco公司, 甲醛(Formaldehyde)、β-丙内酯(β-Propiolactone)、二乙烯甲胺(BEI)、硫代硫酸钠溶液、铝胶佐剂、脑心浸液培养基(BHI)购自北京索莱宝科技有限公司, ISA 763A和IMS1312佐剂由SEPPIC公司提供, 纳米级氢氧化铝佐剂M402由成都依思康医药科技有限公司提供。
1.2 CyHV-2病毒液制备
采用含体积分数为10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的M199培养液, 24 °C培养CSC细胞系至长满单层, 接种CNDF-TB2015毒株病毒液, 24 °C吸附1 h后, 弃去病毒稀释液, 换成血清浓度为2%的M199维持液继续培养, 逐日观察细胞病变情况, 细胞病变达到60%以上时收获病毒液, 取少量病变细胞采用2%戊二醛进行固定、制样和透射电镜观察, 并对病毒液进行半数组织培养感染剂量TCID50测定(魏钰娟等, 2020)。
1.3 攻毒模型建立
1.3.1 鱼体规格对病毒的敏感性 分别取100、200、300、400、500 g的健康鲫鱼, 每组20尾, 各种规格同时设置1个平行组, 用108.3TCID50/mL的病毒液进行攻毒试验, 每尾0.2 mL, 记录每天的死亡情况, 从而筛选出最适实验用鱼的体重。
1.3.2 病毒致死剂量确定 挑选300 g左右的鲫鱼,分为4组, 每组设置1个平行组, 分别注射浓度为108.3、107.6、106.9TCID50/mL的病毒液和生理盐水, 每尾鲫鱼腹腔注射0.2 mL; 养殖水槽常规充氧, 水温控制在(24±1) °C, 连续观察14 d, 记录死亡情况。
1.4 CyHV-2灭活条件优化
选择病毒灭活疫苗最常用的甲醛、β-丙内酯和BEI三种灭活剂, 按表1设置灭活剂终浓度、灭活时间、灭活温度等条件组合对108.3TCID50/mL的病毒液进行灭活处理, 共27组。其中BEI灭活后, 加入同等终浓度的硫代硫酸钠溶液终止灭活。
将上述27组灭活后的病毒液各取0.5 mL接入CSC细胞, 并设立一组阳性对照和阴性对照, 连续观察细胞病变情况, 未出现细胞病变则再盲传1次。
表1 灭活剂及灭活条件
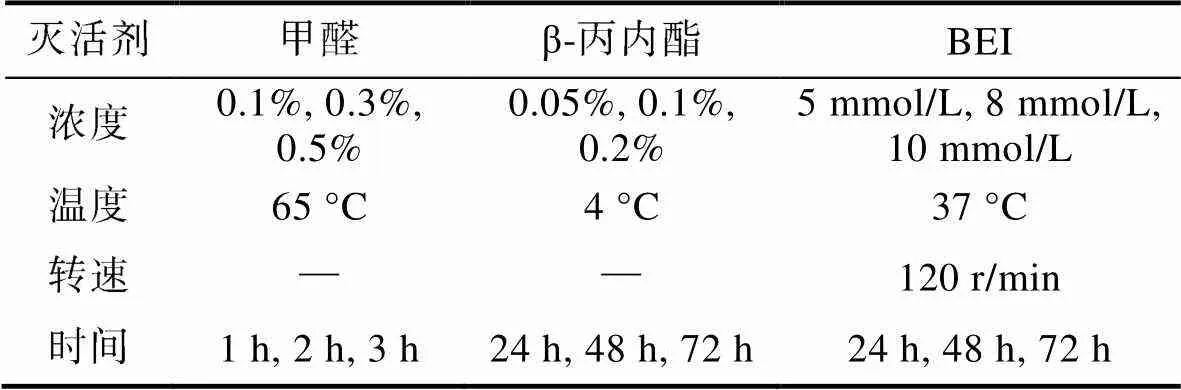
Tab.1 Inactivator and inactivation conditions
1.5 佐剂筛选
选取4种常用佐剂(油佐剂763A, 水佐剂IMS1312, 铝胶, 纳米佐剂M402)分别对CYHV-2灭活疫苗进行乳化, 配制成相当于最终病毒载量浓度108.3TCID50/mL, 并分别免疫规格为300 g左右的健康鲫鱼, 定期进行攻毒试验, 筛选最佳佐剂。
1.6 灭活疫苗免疫保护率测定
利用109TCID50/mL的CyHV-2病毒液灭活后, 用IMS1312佐剂乳化制成不同抗原浓度的灭活疫苗(108.3, 107.6, 106.9, 106.2, 105.5TCID50/mL), 同时设IMS1312佐剂对照组, 共6组, 每组30尾300 g健康鲫鱼, 每尾腹腔注射疫苗0.2 mL, 免疫4周后攻毒, 每日统计死亡鱼数, 依下列公式计算相对保护率(relative percentage survival, RPS):
相对保护率(RPS)=[1 – (免疫组死亡率/对照组死亡率)]×100%. (1)
1.7 免疫产生期测定
利用终浓度108.3TCID50/mL的IMS1312佐剂疫苗免疫150尾300 g健康鲫鱼, 每隔7 d取20尾进行攻毒保护率测定, 14 d内观察发病死亡情况, 计算保护率。
2 结果
2.1 CyHV-2病毒液制备
CSC细胞接种CNDF-TB2015毒种后, 在第8 d细胞病变达到70%以上(图1b)收获病毒, 并进行扩培,制得一批经测定浓度为1010TCID50/mL的病毒培养液, 分装于液氮中保存。病变细胞固定后透射电镜观察, 可以看到大量的疱疹病毒分布在细胞核中(图1c), 表明毒株CNDF-TB2015可在CSC细胞中大量复制, 获得的病毒培养液含有高浓度的病毒粒子, 为灭活疫苗的抗原制备提供了高效的培养体系。
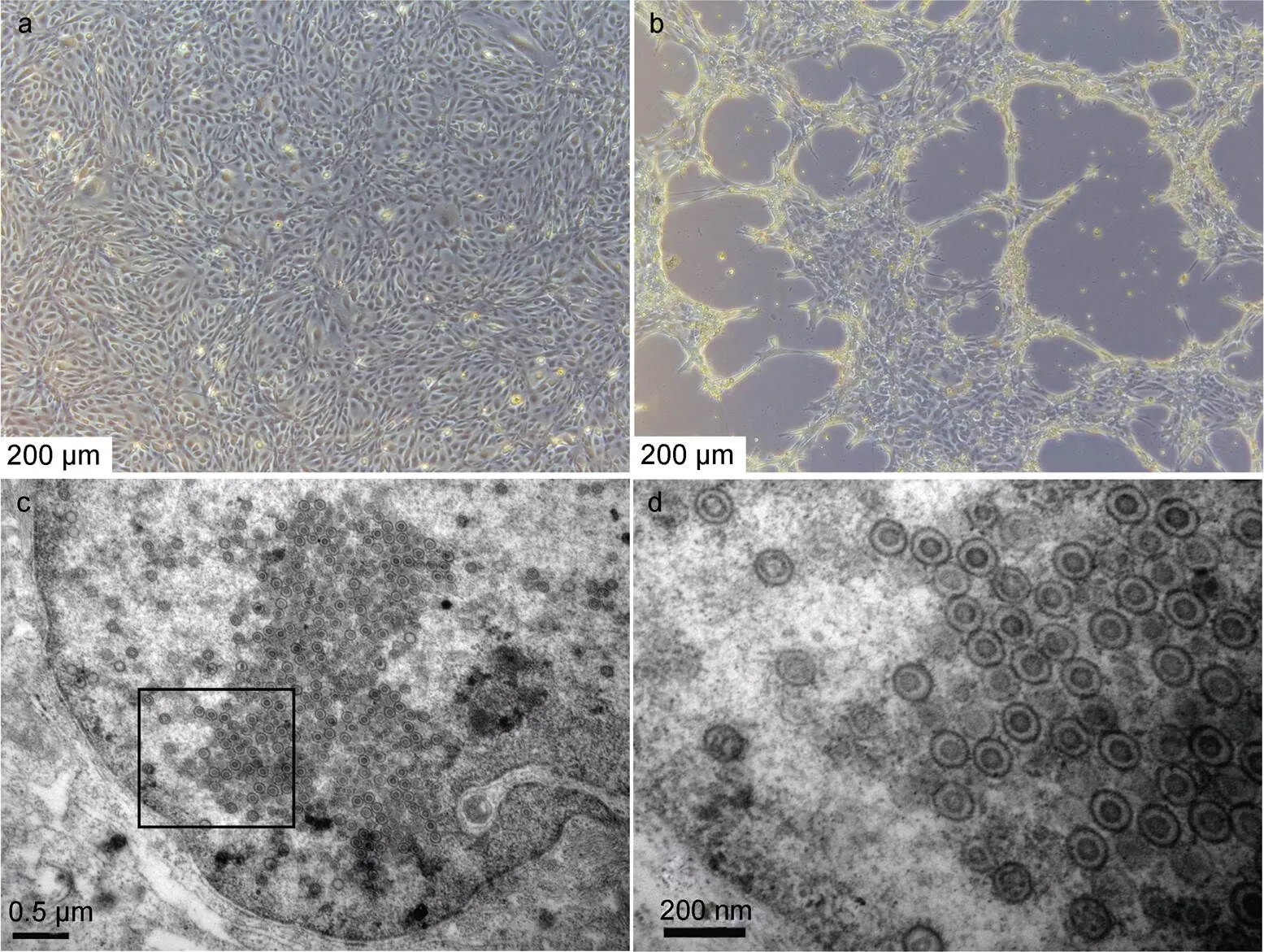
图1 CSC病变细胞特征及电镜图
注: a. 正常CSC细胞; b. 受CyHV-2感染的CSC细胞; c, d. 病毒电镜图, d表示c图中的框线内区域
2.2 攻毒模型建立
2.2.1 不同规格鱼体对病毒敏感性 以浓度为108.3TCID50/mL的病毒液0.2 mL/尾进行腹腔注射攻毒, 相当于4×107TCID50/尾, 连续观察14 d, 记录死亡率, 结果显示, 200 g及以上的鲫鱼攻毒后14 d内全部发病死亡, 并表现出典型的鲫鱼造血器官坏死病临床症状(图2)。而规格100 g组死亡率仅为20%, 表明小规格鲫鱼对CyHV-2具有一定的耐受性。因此, 根据攻毒情况, 选取300 g作为攻毒模型中鲫鱼规格大小的标准。
2.2.2 病毒致死剂量确定 通过不同浓度的病毒进行鲫鱼的腹腔注射攻毒试验, 由图3可知, 攻毒后, 108.3TCID50/mL浓度组最早出现死亡情况, 并于7 d内全部死亡, 而107.6TCID50/mL浓度组出现死亡时间后延, 至第11 d全部死亡。106.9TCID50/mL浓度组最终致死率为35%。综合考虑, 以107.6TCID50/mL的浓度作为攻毒模型的攻毒浓度。
2.3 CyHV-2灭活条件筛选优化
各组灭活后的病毒液经无菌检测后, 接种CSC细胞进行细胞毒性检测, 结果见表2。甲醛组最佳灭活条件为终浓度0.3%, 65 °C灭活3 h; β-丙内酯组最佳条件为终浓度0.2%, 4 °C灭活72 h; BEI组最佳条件为终浓度10 mmol/L, 37 °C灭活72 h。虽然甲醛具有最好的灭活性能, 但甲醛去除增加了不少程序和时间, 因此, 综合考虑, 选取BEI的最佳灭活条件(BEI浓度10 mmol/L, 37 °C灭活72 h)作为灭活条件。
2.4 免疫佐剂筛选
采用4种不同佐剂制备的灭活疫苗同等条件下免疫鲫鱼后, 在第5、7、9周对各免疫组鲫鱼进行免疫保护率测定, 结果见表3。表明IMS1312、铝胶佐剂组和M402组都具有较高免疫保护率, 分别为70%、60%和60%, 其中佐剂IMS1312对提高免疫保护率更具优势, 并且IMS1312为一种水佐剂, 注射后对机体的刺激和病理损伤更低, 因此选择IMS1312作为本疫苗制备的佐剂。
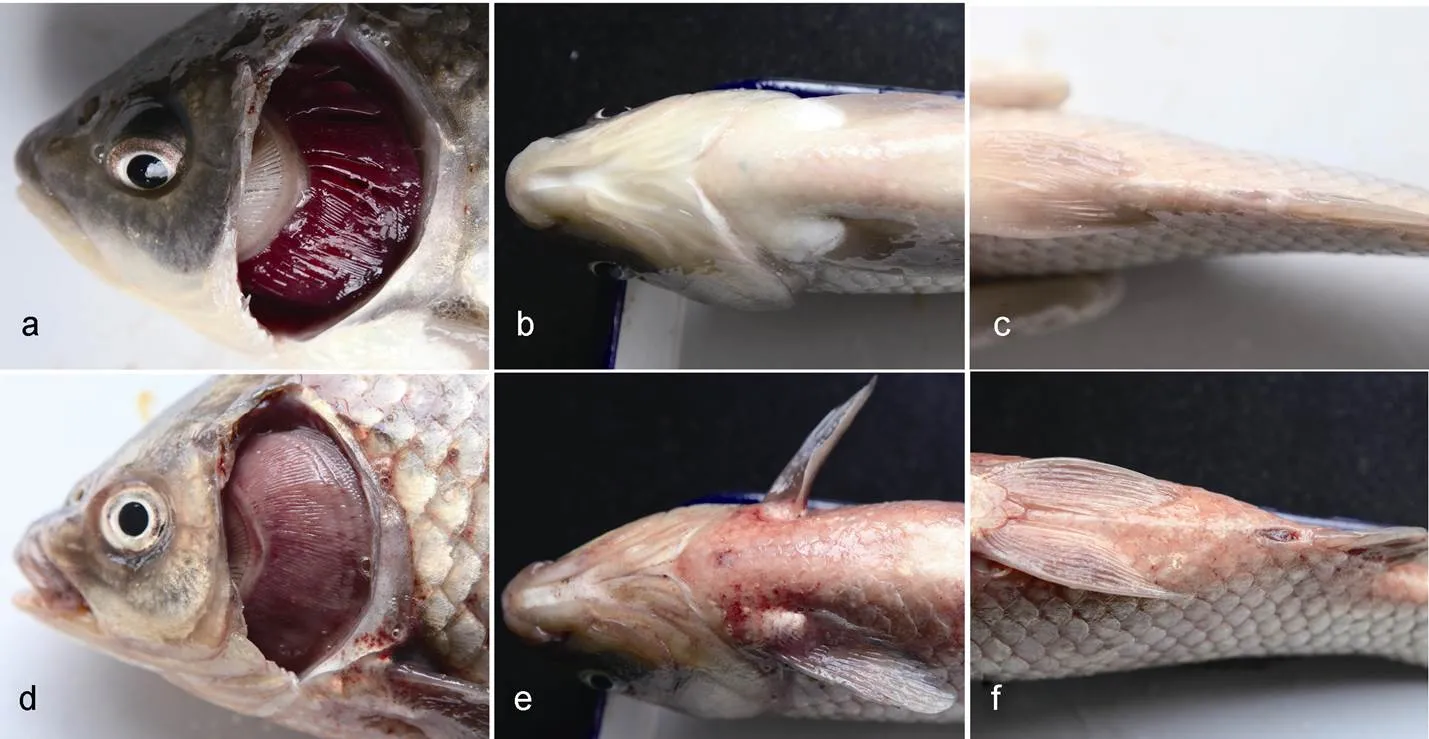
图2 鲫鱼受CyHV-2感染的发病症状
注: a, b, c分别为正常鱼; d, e, f为发病鱼的鳃、腹部和肛门出血症状

图3 不同病毒浓度致死率
表2 灭活剂灭活条件优化

Tab.2 Optimization of inactivation conditions
注: +++表示直接出现CPE (细胞病变效应, cytopathic effect); ++表示盲传1次后出现CPE; +表示盲传2次后出现CPE; –表示3次盲传均未出现CPE
表3 不同佐剂制备的疫苗的免疫保护率
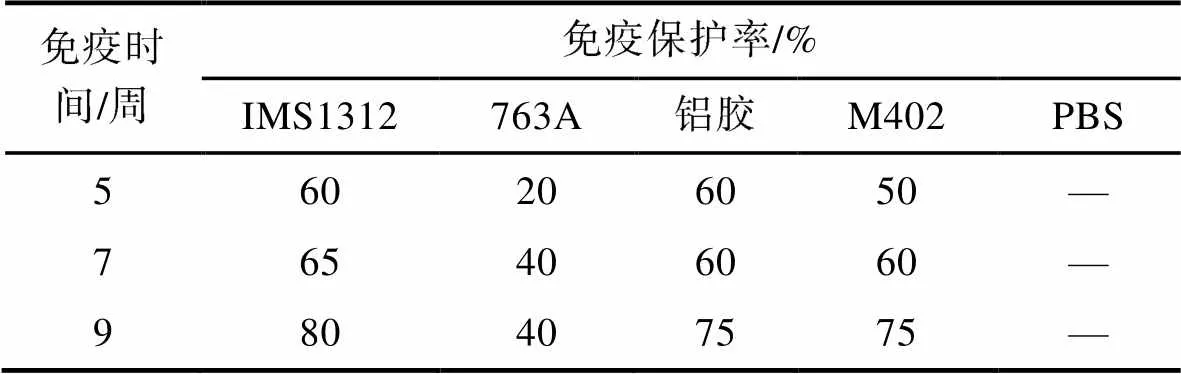
Tab.3 Immune protection rate of vaccines prepared with different adjuvants
2.5 灭活疫苗免疫保护率测定
按不同TCID50浓度灭活的病毒, 用IMS1312佐剂乳化配制成灭活疫苗, 免疫健康鲫鱼4周后, 按浓度107.6TCID50/mL的病毒液进行攻毒, 连续观察14 d后统计免疫保护率, 见图4, 保护率达到70%以上的最小免疫剂量为107.6TCID50/mL×0.2 mL/尾, 相当于8.0×106TCID50/尾。而免疫剂量为108.3TCID50/mL× 0.2 mL/尾的时候, 即4.0×107TCID50/尾, 攻毒保护率可达到100%, 因此选取4.0×107TCID50/尾的免疫剂量作为最佳免疫剂量。
2.6 免疫产生期测定
对免疫后的鲫鱼, 在第1周~第6周采用攻毒的方式评价免疫保护的产生期, 攻毒后观察14 d, 相对保护率如图5。从结果中可以发现, 免疫后的鲫鱼在第3周产生了30%的保护率, 之后保护率逐渐升高, 至第5周获得了100%的免疫保护率, 第4周也可获得高达80%的免疫保护率。通过对免疫产生期的分析表明, 养殖鲫鱼应在鲫造血器官坏死病发病季35 d之前进行疫苗免疫, 以获得对发病季节鲫鱼最佳的免疫保护。
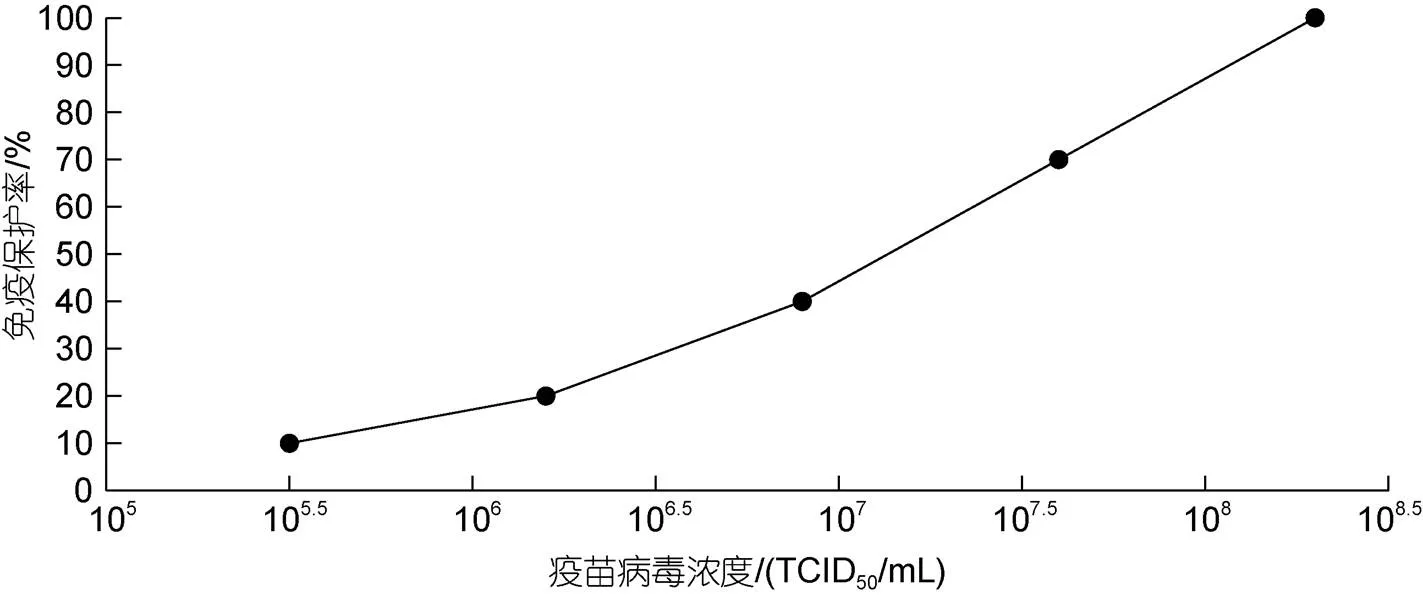
图4 不同剂量疫苗免疫后的相对保护率
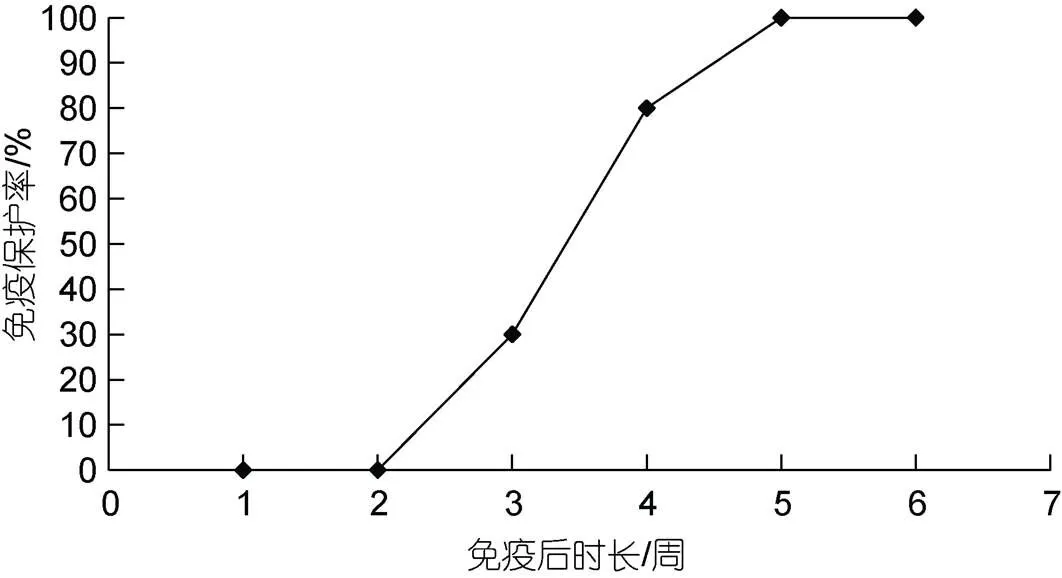
图5 疫苗免疫后不同时期的保护率
3 讨论
3.1 各种CyHV-2疫苗免疫效力分析
疫苗接种可以刺激鱼体产生对病原体强烈和较长的免疫保护力。近年来, 由于鲫造血器官坏死病对鲫鱼养殖业巨大的负面影响, 研制该病的免疫制剂较为迫切。国内一些研究机构已对CyHV-2的相关疫苗进行了研究, 并取得了进展。其中, 研制的CyHV-2基因工程亚单位疫苗表现出了一定的保护率(廖红等, 2016; 李坤, 2018; 周勇等, 2018)。
然而, CyHV-2结构蛋白和外膜蛋白种类多样, 主要保护性抗原至今未明, 全病毒的灭活疫苗在抗原的完整性上表现出了绝对优势, 并且与全病毒的弱毒苗相比, 灭活疫苗还避免了因毒力返强引发的风险。该病在我国暴发初期, 由于缺乏病毒敏感的细胞系, 灭活疫苗迟迟未能被研究, 但随着近年CyHV-2敏感细胞系的建立(Ma, 2015; 魏钰娟等, 2020), CyHV-2的细胞培养与灭活疫苗也被进行了研究(Zhang, 2016)。王维玲(2017)利用β-丙内酯制备了CyHV-2灭活疫苗, 通过疫苗浸泡免疫健康异育银鲫鱼种, 发现在免疫后第8周, 相对免疫保护率为61.6%, 在第4周加强免疫组相对保护率达到了73.1%。而本研究采用灭活剂BEI制备的毒株CNDF-TB2015的灭活疫苗, 以IMS1312为佐剂(抗原量相当于108.3TCID50/mL), 注射免疫4周后, 攻毒免疫保护率达到100%, 相比已报道的几种灭活疫苗和亚单位疫苗具有更高的保护率, 可以用于鲫造血器官坏死病的免疫预防。
3.2 不同病毒灭活剂对灭活CyHV-2的效果分析
灭活疫苗在制备过程中, 如何对病毒进行彻底灭活的同时, 最大限度地保护抗原的完整性是其关键点。通常抗原在不同灭活剂作用下, 抗原完整性和稳定性会受到不同程度的影响。甲醛虽然已被广泛应用于疫苗的制备, 大多数鱼类细菌灭活疫苗都通过甲醛灭活制备而成(王璐瑶等, 2018), 但用甲醛过度灭活会导致对相应抗原的意外修饰, 从而降低疫苗抗原性和保护效力(Herrera-Rodriguez, 2019)。为了选择一种能灭活病毒又能很好保全抗原的灭活剂, 本研究在制备灭活苗的过程中, 选取以破坏病毒核酸来灭活病毒的灭活剂β-丙内酯和BEI作为筛选目标。
β-丙内酯已被应用于CyHV-2的灭活(Zhang, 2016; 王维玲, 2017), 也有研究者发现其在灭活流感病毒和保全抗原完整性上要优于甲醛(Mondal, 2005), β-丙内酯在灭活流感病毒过程中, 以0.1%的浓度在高于18 °C的温度下孵育6~18 h, 能够完全灭活流感病毒。若在4 °C下, 则需要72 h以上的灭活时间才能完全灭活流感病毒(Pawar, 2015)。本研究采用不同浓度的β-丙内酯在4 °C灭活CyHV-2, 发现也需灭活72 h以上才能完全灭活CyHV-2, 与文献报道相符。
而核酸烷化剂BEI, 早在1959年就被用作灭活病毒材料的杀病毒剂(Brown, 1959)。BEI浓度是影响病毒灭活效果的关键因素之一。根据先前BEI对手足口病毒灭活效果的研究, 灭活所需的时间随着BEI浓度的增加而减少(Aarthi, 2004)。本研究采用不同浓度的BEI灭活CyHV-2, 也表现出了灭活时间的差异, 其中BEI最高浓度10 mmol/L需要72才能完全灭活CyHV-2病毒。
在选择最佳灭活剂时, 为了保护病毒效价, 在同等条件下, 优先选择低浓度、较低温度和较短处理时间就达到灭活效果的灭活剂。甲醛虽然价格低, 但其灭活温度高, 易造成抗原降解, 免疫原性下降, 并有致癌作用(徐守振等, 2010); β-丙内酯在使用时需要较大体积比, 单价高, 对于市场价格低的水产疫苗, 不利于推广; 而BEI具有成本低、毒性低, 且保存方便的优点, 其灭活机制是, 通过烷化病毒核酸中的鸟嘌呤和腺嘌呤达到破坏该核酸并阻止其复制的效果, 但不损坏病毒表面蛋白, 也不破坏抗原蛋白空间结构, 病毒的抗原决定位置也不受影响(Mudasser, 2006)。并且, 利用BEI进行灭活时, 最终会加入硫代硫酸钠中和, 从而消除灭活剂的残留, 进一步保证了疫苗的安全性(Mondal, 2005), 至今未有因BEI残留引起中毒事件的发生(Tang, 2016)。因此, 本研究最终选取了BEI作为CyHV-2疫苗制备的灭活剂。
3.3 不同佐剂对疫苗免疫效果影响的分析
在疫苗佐剂的筛选过程中, 选取的4种常用佐剂中, IMS1312、铝胶和纳米佐剂都表现出了较好的刺激免疫保护性的作用, 其中水佐剂IMS1312制备的灭活苗免疫组, 表现出了最高的免疫保护率。IMS1312与水互溶, 制备的疫苗对机体的刺激更小, 并且该水佐剂中含有缓释剂, 能让疫苗的免疫效果更加持久。以BEI作为灭活剂, IMS1312为佐剂制备的灭活疫苗, 免疫鲫鱼后, 在第4周获得了80%的免疫保护率, 在第5周就可获得100%的免疫保护率, 在免疫保护率上远高于已报道的CyHV-2灭活疫苗。
4 结论
在CyHV-2灭活疫苗制备过程中, 通过对病毒浓度、灭活剂浓度、灭活温度、灭活时间和佐剂种类的比较分析, 结果表明, 采用BEI灭活CyHV-2病毒株CNDF-TB2015, 以水佐剂IMS1312进行乳化获得的终浓度为108.3TCID50/mL的CyHV-2灭活疫苗, 免疫鲫鱼28 d后可获得80%的免疫保护率, 免疫35 d后可获得100%的免疫保护率, 具有良好的应用前景。
王维玲, 2017. 鲤疱疹病毒II型微载体培养技术与灭活疫苗浸泡免疫效果研究[D]. 上海: 上海海洋大学: 30-38.
王璐瑶, 李宁求, 张鹏, 等, 2018. 渔用疫苗灭活剂研究进展[J]. 中国生物制品学杂志, 31(12): 1402-1408.
农业农村部渔业渔政管理局, 全国水产技术推广总站, 2021. 2021中国水生动物卫生状况报告[M]. 北京: 中国农业出版社: 18-19.
李坤, 2018. 鲤疱疹病毒Ⅱ型的DNA疫苗、卵黄抗体的研制及鱼卵中鲤疱疹病毒Ⅱ型的检测技术[D]. 苏州: 苏州大学: 16-47.
沈锦玉, 曹铮, 潘晓艺, 等, 2019. 一种异育银鲫脊髓组织细胞系及其构建方法与其应用: 201811231823.X [P]. 2019-02-01.
周勇, 史玉恒, 范玉顶, 等, 2018. 鲤疱疹病毒Ⅱ型ORF25截短蛋白的多克隆抗体制备与免疫原性分析[J]. 淡水渔业, 48(6): 40-45.
袁雪梅, 潘晓艺, 郝贵杰, 等, 2019. 一例异育银鲫()暴发性出血病病原分析[J]. 海洋与湖沼, 50(4): 913-920.
徐守振, 尹燕博, 王新, 2010. 动物疫苗中常用抗原灭活剂的研究进展[J]. 中国畜牧兽医, 37(9): 162-167.
廖红, 林华, 郝中香, 等, 2016. 鲤疱疹病毒2型ORF5截短基因的克隆表达及免疫原性研究[J]. 中国兽医科学, 46(11): 1394-1400.
魏钰娟, 潘晓艺, 蔺凌云, 等, 2020. 异育银鲫()脊髓组织细胞系的建立及对CyHV-2的敏感性[J]. 海洋与湖沼, 51(5): 1232-1238.
AARTHI D, ANANDA RAO K, ROBINSON R,, 2004. Validation of binary ethyleneimine (BEI) used as an inactivant for foot and mouth disease tissue culture vaccine [J]. Biologicals, 32(3): 153-156.
BROWN F, CRICK J, 1959. Application of agar-gel diffusion analysis to a study of the antigenic structure of inactivated vaccines prepared from the virus of foot-and-mouth disease [J]. Journal of Immunology, 82(5): 444-447.
HERRERA-RODRIGUEZ J, SIGNORAZZI A, HOLTROP M,, 2019. Inactivated or damaged? Comparing the effect of inactivation methods on influenza virions to optimize vaccine production [J]. Vaccine, 37(12): 1630-1637.
JUNG S J, MIYAZAKI T, 1995. Herpesviral haematopoietic necrosis of goldfish,(L.) [J]. Journal of Fish Diseases, 18(3): 211-220.
MA J, JIANG N, LAPATRA S E,, 2015. Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2 (CyHV-2) [J]. Veterinary Microbiology, 177(3/4): 315-325.
MONDAL S K, NEELIMA M, REDDY K S R,, 2005. Validation of the inactivant binary ethylenimine for inactivating rabies virus for veterinary rabies vaccine production [J]. Biologicals, 33(3): 185-189.
MUDASSER H, IFTIKHAR H, HAMID I,, 2006. Immunogenicity of formaldehyde and binary ethylenimine inactivated infectious bursal disease virus in broiler chicks [J]. Journal of Zhejiang University Science B, 7(8): 660-664.
PAWAR S D, MURTADAK V B, KALE S D,, 2015. Evaluation of different inactivation methods for high and low pathogenic avian influenza viruses in egg-fluids for antigen preparation [J]. Journal of Virological Methods, 222: 28-33.
TANG L J, KANG H Y, DUAN K X,, 2016. Effects of three types of inactivation agents on the antibody response and immune protection of inactivated IHNV vaccine in rainbow trout [J]. Viral Immunology, 29(7): 430-435.
THANGARAJ R S, NITHIANANTHAM S R, DHARMARATNAM A,, 2021. Cyprinid herpesvirus-2 (CyHV-2): a comprehensive review [J]. Reviews in Aquaculture, 13(2): 796-821.
XU J, ZENG L B, ZHANG H,, 2013. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp,in China [J]. Veterinary Microbiology, 166(1/2): 138-144.
ZHANG L L, MA J, FAN Y D,, 2016. Immune response and protection in gibel carp,, after vaccination with β-propiolactone inactivated cyprinid herpesvirus 2 [J]. Fish & Shellfish Immunology, 49: 344-350.
PREPARATION AND EFFICACY OF INACTIVATED VACCINE AGAINST CYPRINID HERPESVIRUS-2
PAN Xiao-Yi1, LIN Ling-Yun1, ZHU Yue2, YAO Jia-Yun1, YIN Wen-Lin1, LIU Yi-Han1, CHEN Fan3, SHEN Jin-Yu1, 2
(1. Ministry of Agriculture and rural areas Key Laboratory of Healthy Freshwater Aquaculture, Key Laboratory of Fish Health and Nutrition of Zhejiang Province, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China; 2. School of Fishery, Zhejiang Ocean University, Zhoushan 316022, China; 3. Hangzhou Centre for Agricultural Technology Extension, Hangzhou 310001, China)
Herpesviral haematopoietic necrosis (HVHN) is a viral disease of crucian carp caused by Cyprinid herpesvirus-2 (CyHV-2), which causes huge losses on aquaculture in China. To prevent from the outbreak of HVHN, the inactivated vaccine was developed using vaccine strain CNDF-TB2015 and the immune efficacy was assessed. The CyHV-2 culture showed that the titer of virus cultured with CSC cells reached 1010TCID50/mL, and the challenge model test showed the dose of 4×107TCID50/ind could cause 100% mortality in crucian carp within 14 d post injection with the CyHV-2 CNDF-TB2015. The inactivated vaccine preparation test showed that the optimal inactivation condition for CyHV-2 at 108.3TCID50/mL was 10 mmol/L BEI at 37 °C for 72 h and the best adjuvant was IMS1312. The minimum immune dose was 8×106TCID50/ind, and the optimal immune dose was 4×107TCID50/ind. The protection rate reached 80% in 4 weeks and 100% in 5 weeks after immunization with dose of 4×107TCID50/ind. This study presents that the inactivated CNDF-TB2015 strain of CyHV-2 could serve as a potential vaccine candidate to prevent the prevalence of HVHN, and provides a reference for the preparation of other inactivated viral vaccines for fish in aquaculture.
CyHV-2; HVHN; inactivated vaccine; immune efficacy
S942.5
10.11693/hyhz20211200329
* 浙江省重点研发计划, 2019C02058号; 浙江省科研院所扶持专项, 2021YSZX001号。潘晓艺, 研究员, E-mail: panxiaoyi@163.com
沈锦玉, E-mail: sjinyu@126.com; 陈 凡, E-mail: chenfan101@163.com
2021-12-16,
2022-01-22
