血清CysC及IL-17A与脑梗死患者血管内介入治疗预后的相关性
2022-09-21孟庆军水少锋时会敏
孟庆军 水少锋 时会敏
1)河南省第二人民医院,河南 新郑 451191 2)郑州大学第一附属医院,河南 郑州 450052 3)郑州市第一人民医院,河南 郑州 450000
通信作者:孟庆军
脑梗死多由脑动脉血栓阻塞脑动脉造成相应供血区脑组织缺血缺氧,引起长久的损伤,导致脑组织软化、坏死。血管内介入治疗是脑梗死患者重要的治疗手段,如动脉溶栓术,能帮助患者动脉再通,促进脑血供的恢复和神经功能的改善,得到广泛的应用[1]。但部分患者治疗后仍遗留严重的神经功能障碍,预后不佳,与患者自身体质、发病至入院时间等多种因素有关,应快速准确诊断患者病情和预测预后,以改善治疗方案。影像学检查是脑梗死常用评估方法,但对症状不明显的患者诊断效果有限[2]。血管事件总体健康风险是脑梗死患者血管内介入治疗后常用的预测模型,但主要用于评估患者颅内出血和病死风险,均在脑梗死预后预测方面有一定的局限[3]。因此,分析与脑梗死患者血管内介入治疗预后相关的生化指标,为临床治疗、患者预后评估提供参考。胱抑素C(cystatin C,CysC)存在于人体各种体液、组织中,在脑部的表达较高。研究证实,CysC 是急性腔隙性脑梗死的影响因素,而且对脑梗死患者认知功能不利,可能与脑梗死患者血管内介入治疗预后有关。同时,脑梗死后炎症反应会引起和加重局部脑组织损伤,对预后不利。白细胞介素(interleukin,IL)-17A 是IL-17 家族成员,主要由辅助性T细胞(helper T cells,Th)17分泌,发挥促炎作用,可能与加重炎症反应、影响脑梗死预后有关[4]。本研究探讨血清CysC、IL-17A 水平对脑梗死患者血管内介入治疗预后的影响。
1 资料与方法
1.1 一般资料经医院医学伦理委员会审核通过,选取2018-02—2020-02 多介入中心的115 例拟行血管内介入治疗的脑梗死患者为研究对象,患者或家属均签署同意书。男68 例,女47 例;年龄41~72(57.29±6.02)岁;发病至入院时间1.1~5.3(2.66±0.29)h;脑梗死部位:基底节区60 例,小脑23 例,脑叶22 例,其他10 例;入院时美国国立卫生院神经功能缺损量表(National Institutes of Health stroke scale,NIHSS)评分[5]为4~19(8.03±0.87)分。
1.2 入选标准(1)纳入标准:①符合《中国脑梗死中西医结合诊治指南(2017)》中脑梗死诊断标准;②经颅脑CT 或MRI 检查证实为脑梗死;③具有动脉溶栓治疗指征,即年龄18~80 岁,前循环患者发病至入院时间≤6 h,后循环患者发病至入院时间≤24 h,NIHSS 评分4~24 分,血糖、血压控制良好;④完成阿替普酶溶栓治疗;⑤预计生存期≥3个月。(2)排除标准:①伴脑动脉炎、脑创伤等其他脑疾病;②合并感染性疾病,如乙型肝炎;③既往颅内出血或近3 个月内头颅外伤史;④合并心、肝、肾功能不全;⑤活动性出血;⑥近3 个月内发生脑梗死、心肌梗死;⑦2 周内进行大型外科手术;⑧近期(2 周内)接受抗炎治疗、抗凝治疗,2 d 内接受肝素治疗。
1.3 方法
1.3.1实验室指标检测方法:(1)血压:入院时使用动态血压监测仪(Aicanfi,ACF-D1 型)检测收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)。(2)血糖:入院时采集2 mL空腹静脉血,使用全自动生化分析仪(贝克曼,AU5800 型)测定空腹血糖(fasting blood-glucose,FBG)水平;(3)血脂:入院时采集2 mL 空腹静脉血,使用血脂检测仪(日立,7180型)检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL-C)、高密度脂蛋白(high density lipoprotein,HDL-C)水平;(4)入院时采集2 mL 空腹静脉血,4 000 r/min(半径15 cm)离心10 min,采用美国Biolegend 公司提供的试剂盒,以透射比浊法测定血清CysC 水平;(5)采集2 mL 空腹静脉血,2 000 r/min(半径8 cm)离心10 min,试剂盒同上,以酶联免疫测定血清IL-17A水平。
1.3.2 资料收集方法:收集患者资料,包括年龄、性别、发病至入院时间、入院时NIHSS评分、发病部位。1.3.3 治疗方法:参考《中国缺血性脑血管病血管内介入诊疗指南》[6]标准,实施血管内介入治疗。
1.3.4 预后评估方法与分组方法:血管内介入治疗后3 个月,参考改良Rankin 评分(modified Rankin Scale,mRS)[7]评估预后,0分:完全无症状;1分:尽管有症状,但无明显功能障碍,能完成所有日常工作和生活;2 分:轻度残疾,不能完成病前所有活动,但不需帮助,能照料自己的日常事务;3 分:中度残疾,需部分帮助,但能独立行走;4 分:中重度残疾,不能独立行走,日常生活需别人帮助;5 分:重度残疾,不能独立行走,日常生活需别人帮助。mRS≤2分纳入预后良好组,mRS>2分纳入预后不良组。
1.4 统计学方法采用SPSS 25.0 软件进行数据处理,计数资料用百分率(%)表示,采用χ2检验,若期望值<5,采用连续校正卡方检验;计量资料均经Shapiro-Wilk 正态性检验,正态分布计量资料以均数±标准差(±s)表示,组间用独立样本t 检验,采用Logistic回归分析脑梗死患者血管内介入治疗预后不良的相关因素,采用GraphPad Prism 软件处理数据,绘制森林图。采用R4.1.0统计分析软件和“rmda”软件包,以高风险阈值为横坐标,净受益率为纵坐标,绘制决策曲线,分析联合血清CysC、IL-17A预测脑梗死患者血管内介入治疗预后不良的净受益率。
2 结果
2.1 预后结局血管内介入治疗后3 个月,应用mRS 评估115 例脑梗死患者预后,mRS 评分0~4(2.20±0.55)分,其中73例患者mRS≤2分,42例患者mRS>2分,预后不良发生率36.52%(42/115)。
2.2 不同预后结局的脑梗死患者基线资料及实验室指标对比对比2 组基线资料、实验室指标发现,预后不良患者发病至入院时间长于预后良好患者,入院时NIHSS评分、SBP、DBP和血清CysC、IL-17A水平高于预后良好患者,差异均有统计学意义(P<0.05);其余资料对比,差异无统计学意义(P>0.05)。见表1。
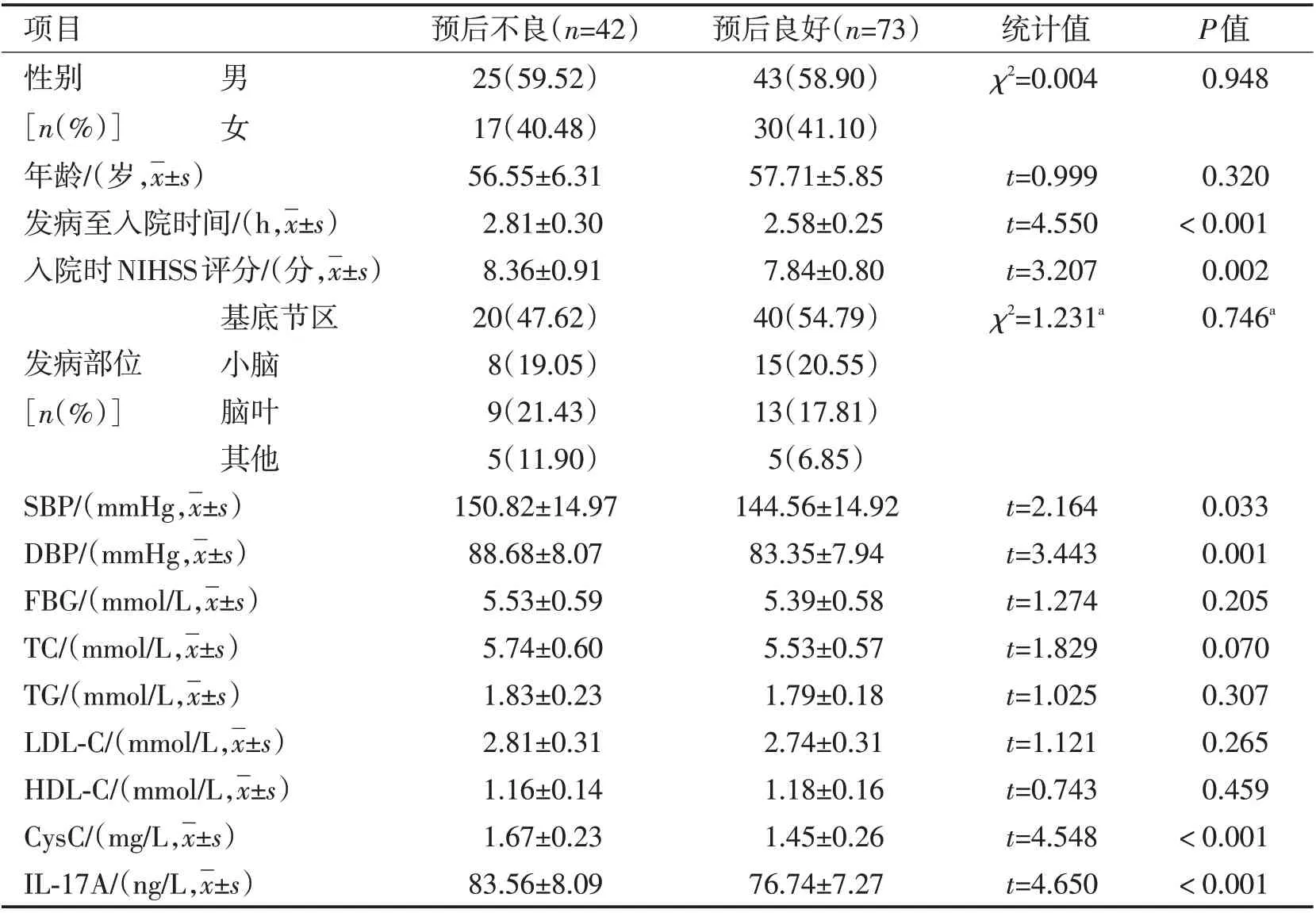
表1 不同预后结局的脑梗死患者基线资料及实验室指标对比Table 1 Comparison of baseline data and laboratory indicators of cerebral infarction patients with different prognosis outcomes
2.3 脑梗死患者血管内介入治疗预后相关因素的Logistic回归分析 将发病至入院时间、入院时NIHSS评分、SBP、DBP、CysC、IL-17A(均为连续变量)作为自变量,将血管内介入治疗预后情况作为因变量(1=预后不良,0=预后良好),经Logistic回归分析,结果显示,发病至入院时间、入院时NIHSS 评分、DBP、CysC、IL-17A 与脑梗死患者血管内介入治疗预后不良有关(OR>1,P<0.05)。见表2。森林图显示,在脑梗死患者血管内介入治疗预后相关因素中,发病至入院时间、CysC 与血管内介入治疗预后的关联度最强。见图1。
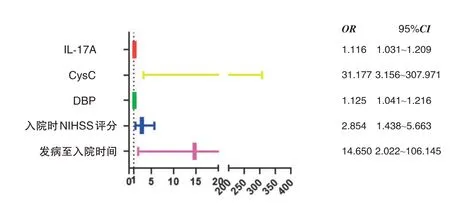
图1 脑梗死患者血管内介入治疗预后相关因素的森林图Figure 1 Forest plot of prognostic factors for endovascular intervention in patients with cerebral infarction

表2 脑梗死患者血管内介入治疗预后相关因素的Logistic回归分析Table 2 Logistic regression analysis results of prognostic factors of endovascular interventional therapy in patients with cerebral infarction
2.4 血清CysC、IL-17A 水平预测脑梗死患者血管内介入治疗预后不良的决策曲线分析以高风险阈值为横坐标,净受益率为纵坐标,绘制决策曲线(图2),结果显示,当高风险阈值为0~0.8 时,净受益率>0,最大净受益率0.365,有临床意义,且高风险阈值取值越小,净受益率越大;在阈值0.3~0.8范围内,联合入院时血清CysC、IL-17A 水平预测脑梗死患者血管内介入治疗预后不良的净受益率优于单纯某一指标。使用combination 模型预测1 000 人的风险分层,联合入院时血清CysC、IL-17A水平的预测模型预测脑梗死患者血管内介入治疗预后不良与实际基本符合。见图3。

图2 血清CysC、IL-17A水平预测脑梗死患者血管内介入治疗预后不良的决策曲线Figure 2 Decision curve of serum CysC and IL-17A levels in predicting poor prognosis of patients with cerebral infarction after endovascular interventional therapy
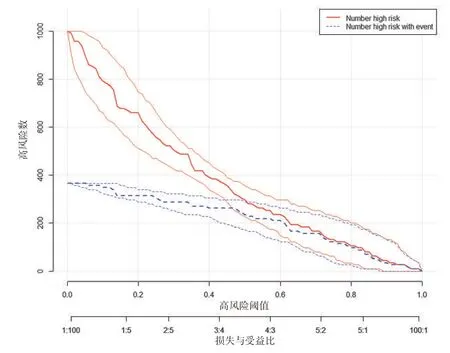
图3 combination模型预测1 000人的风险分层Figure 3 The combination model predicts the risk stratification of 1 000 people
3 讨论
血管内介入治疗脑梗死效果相对较好,可实现血管再通,促进患者神经功能恢复,但急性进展性脑梗死患者的病情发展快,即使经血管内介入治疗后仍存在严重的神经功能障碍,对于预后仍不理想[8]。
本研究显示,115例脑梗死患者血管内介入治疗后3 个月,预后不良发生率36.52%,说明,脑梗死患者血管内介入治疗预后不良发生率较高,有必要分析相关因素,为后续的治疗和预后评估提供参考。CysC 是一种蛋白酶抑制剂,在人体内含量丰富,其水平失衡可能引起血管损害,与动脉粥样硬化的发生发展具有紧密的联系,而动脉粥样硬化是脑梗死的主要致病原因之一。研究表明,CysC 水平异常和心脑血管疾病相关,是心血管事件发生的危险因素[9]。由此推测,CysC 可能影响脑梗死患者血管内介入治疗预后。IL-17A 是Th17 细胞来源的炎症因子,也是Th17的主要效应因子,能通过结合自身受体,促进炎症反应进展,在炎症反应中起到重要作用[10]。炎症反应会加重脑梗死患者脑组织缺血和损伤,可能影响血管内介入治疗的预后,可见IL-17A 可能与脑梗死患者血管内介入治疗预后有关。本研究显示,发病至入院时间、入院时NIHSS 评分、DBP、CysC、IL-17A 与脑梗死患者血管内介入治疗预后不良有关,且发病至入院时间、CysC 与血管内介入治疗预后的关联度最强。发病至入院时间、NIHSS 评分、血压是脑梗死患者预后常见相关因素,本研究重点分析CysC、IL-17A 对脑梗死患者血管内介入治疗预后的影响。
动脉粥样硬化是脑梗死发生发展的重要原因,增加脑部动脉壁脂质聚集,引起炎症反应刺激血管平滑细胞,大量增加半胱氨酸蛋白酶的分泌,机体释放大量的CysC以抑制半胱氨酸蛋白酶,造成CysC 水平异常升高[11]。CysC对血管平滑细胞的增殖、分化及迁移均具有刺激作用,诱导硫基氧化过程,增加氧自由基的生成,促进泡沫细胞的形成,造成血管内膜增厚,导致血管管腔发生硬化和狭窄,可能影响脑梗死预后[12]。CysC 及其降解产物对粒细胞具有调节作用,能诱导粒细胞趋化功能增强,趋化炎症因子聚集于血管内壁,加重脑梗死病情,增加预后不良的发生风险[13]。研究证实,CysC 和急性脑梗死预后有关,与本研究相符。因此,临床工作中应加强脑梗死患者CysC检测并分析,利于脑梗死治疗方案的改进。同时,脑梗死患者脑部存在缺血性损伤,激活巨噬细胞和小胶质细胞,而这些细胞具有较高的吞噬、分化作用,可诱导多种炎症因子分泌,如IL-17A[14-20]。IL-17A水平升高会加重炎症反应,造成缺血损伤的进展,可能不利于血管内介入治疗后患者损伤组织的再生和修复,影响预后[21-24]。脑梗死发生后引起IL-17A 应激性增高,IL-17A 调节炎症反应,刺激IL-6、IL-8 等其他促炎因子的释放,造成多种细胞因子协同放大炎症反应,加重脑部缺血缺氧和神经功能损伤,不利于脑梗死患者的预后,而且IL-17A对内皮细胞的刺激和损伤可能加重动脉粥样硬化,加重脑梗死,增加不良预后发生风险。因此,IL-17A与脑梗死预后有关,IL-17A 或可作为未来神经保护治疗靶点。
绘制决策曲线显示,高风险阈值在0~0.8 区间时有临床意义,且高风险阈值取值越小,净受益率越大;阈值在0.3~0.8 区间,联合入院时血清CysC、IL-17A水平预测脑梗死患者血管内介入治疗预后不良的净受益率优于单纯某一指标。
本研究也存在一定的局限性,如非多中心研究,结果可能受地域性差异的影响;同时,观察脑梗死患者血管内介入治疗3个月后的预后情况,缺乏对远期预后的观察和分析。后续应增加多中心样本,分析脑梗死患者远期预后情况和相关因素。
