新生大鼠缺氧缺血性脑损伤后内质网应激相关因子的表达及意义
2022-09-21于海侠刘文强
于海侠,刘文强,吴 铭,王 军
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)主要是因为围产期发生的缺氧窒息引起的脑缺氧缺血性损害,是临床上引起新生儿急性死亡和慢性神经系统损伤的主要原因之一[1]。儿童HIBD的病死率高达60%[2],虽然目前较为有效的治疗方法为亚低温治疗,但在损伤早期有效果[3],所以深入研究HIBD的损伤机制,这对于HIBD的治疗具有重要意义。
内质网应激(endoplasmic reticulum stress,ERS)是指由于缺氧、缺血等损伤导致细胞内质网稳态失衡、生理功能发生紊乱及障碍的一种亚细胞器的病理过程[4]。ERS可以诱导未折叠蛋白反应(unfolded protein response,UPR),以恢复细胞内环境的稳定,但是剧烈或者持久的ERS可导致细胞凋亡,而细胞凋亡是引起缺氧缺血性脑损伤的主要机制之一[5]。该研究通过观察新生大鼠HIBD后ERS相关因子激活转录因子6(activated transcription factor 6,ATF6)、肌醇需求因子1(inositol demand factor 1,IRE1)、双链RNA依赖的蛋白激酶样内质网激酶(PKR-like ER kinase,PERK)的表达、分布及神经元损伤情况,进一步探讨ERS在HIBD发病机制中的相关作用。
1 材料与方法
1.1 实验动物15只健康成年SD大鼠由徐州医科大学实验动物中心提供,饲养条件为室温(20~26 ℃),光照为12 h/12 h明暗交替。动物合格证号:SYXK(苏)2020-0048。按照1 ∶2雄雌比例进行交配繁殖,孕鼠单独喂养,待产子后选用7 d龄SD大鼠作为实验对象。
1.2 试剂与仪器ATF6一抗(兔)、IRE1一抗(兔)、PERK一抗(兔)、β-actin一抗及β-actin二抗购自美国Affinity公司,羊抗兔二抗购自上海碧云天生物技术有限公司,HE染色试剂盒购自大连美伦生物技术有限公司等。荧光显微镜(BX-43)、数字切片扫描系统(VS120)购自日本 Olympus公司。
1.3 动物模型制备参照相关文献[6]制作新生大鼠缺氧缺血性脑损伤模型(HIBD组):7 d龄SD大鼠无水乙醚吸入麻醉,仰卧位固定,沿颈正中线切开皮肤,游离出右侧颈总动脉,碘伏浸泡丝线进行结扎,缝合切口后回窝休息2 h,再置入缺氧箱中,设置37 ℃恒温水浴箱,以1~2 L/min的速度输入含8%氧气、92%氮气的混合气体,持续2 h,造成缺氧缺血性脑损伤。假手术组(Sham组)切开颈部皮肤,游离右颈总动脉后缝合切口,不结扎,也不缺氧,缝合切口后呼吸正常空气。
1.4 动物分组清洁级7 d龄新生SD大鼠,12~18 g,随机分为Sham组、HIBD组,每组按照术后时间点不同进一步分为6、24、72 h三个亚组,6 h、24 h每个亚组8只,72 h每个亚组16只,6、24、72 h各8只大鼠用于蛋白检测,72 h的余8只大鼠用于HE染色、免疫组化及尼氏染色。
1.5 方法
1.5.1标本制备新生大鼠脑组织的获取 各组新生大鼠在各时间点断头取脑,称取右侧新鲜脑组织约100 mg,置于匀浆管中并加入含有蛋白酶抑制剂的RIPA裂解液裂解蛋白,匀浆结束后,将液体转移至新的EP管中,4 ℃、15 000 r/min离心10 min,吸取上清液,使用 BCA法测定蛋白浓度后于-80 ℃保存。
新生SD大鼠于72 h取材,开胸后充分暴露心脏,从心尖部插入灌注针头至左心室,剪开右心耳,快速灌注50 ml 0.9%NaCl,同时观察肝、肺组织颜色变白、右心耳流出处液体为无色透明后,灌注4 ℃预冷的4%多聚甲醛50 ml,待其四肢抽动及全身组织变硬后取材,打开乳鼠颅腔,仔细摘取其脑组织,固定于4%多聚甲醛中,置于4 ℃冰箱过夜。
1.5.2HE染色 取缺氧缺血72 h后大脑常规固定、脱水、石蜡包埋,统一取海马区行冠状位脑组织切片,切片常规脱蜡、复水,进行HE染色,于光学显微镜下观察各组神经细胞的形态改变并拍摄组织图片。
1.5.3尼氏染色 取石蜡切片行尼氏染色液染色,光学显微镜下观察存活神经元数量和胞质出现的尼氏小体并拍摄组织图片。
1.5.4免疫组化 取石蜡切片脱蜡至水,放入预热的柠檬酸缓冲液进行抗原修复。取适量3%过氧化氢覆盖组织,室温孵育10 min,3%BSA室温封闭30 min,孵育一抗(1 ∶400)切片平放于湿盒内4 ℃孵育过夜。次日孵育二抗(1 ∶400),室温孵育1 h,DAB显色,苏木精染色细胞核,脱水、封片,显微镜镜检,采集图像分析。
1.5.5Western blot 实验 实验前取出部分蛋白样品,通过10%SDS-PAGE电泳分离,并转移至PVDF 膜,封闭,一抗ATF6、IRE1、PERK(1 ∶1 000)于4 ℃孵育过夜,洗膜3次,每次5min,二抗(1 ∶5 000)室温孵育2 h,洗膜3次,每次5min,使用凝胶成像系统拍照并保存图片,ImageJ软件分析相对灰度值,以β-actin为内参标化相关蛋白表达量。

2 结果
2.1 脑组织病理改变Sham组脑组织的神经细胞排列正常、整齐,层次清晰、形态及数量正常,包膜完整,核居中且圆,核仁深,异染色质少。HIBD组可见皮质及海马区脑组织的神经细胞数量减少,排列紊乱,细胞间隙增大,结构不清,细胞质疏松,淡染,细胞胞质空泡化,表现为核固缩,并伴有细胞坏死,部分细胞膜破裂等。见图1。
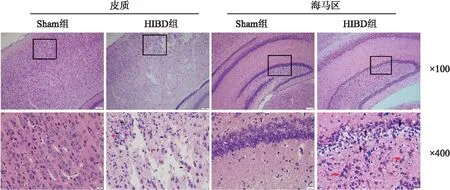
图1 各组脑组织病理学改变
2.2 各组大鼠皮质及海马区凋亡情况比较尼氏染色结果显示Sham组神经元细胞体呈圆形,核仁清晰,胞质深染,存在染色较深的尼氏小体。与Sham组比较,HIBD组大脑皮质及海马区细胞皱缩、细胞核固缩,部分胞核偏位或溶解,空泡样表现,尼氏小体染色稀释且色浅,尼氏体数量减少,神经元变性严重,差异有统计学意义(P<0.001)。提示缺氧缺血性脑损伤新生大鼠神经元受损增加,神经元凋亡率增加。见图2、表1。
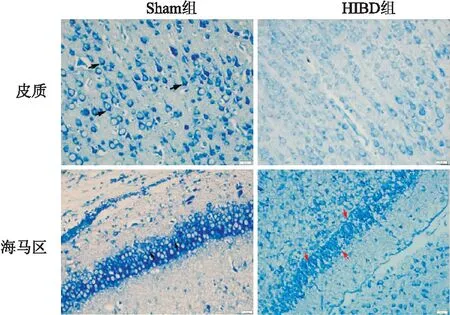
图2 各组脑组织尼氏染色结果 ×400
表1 两组大脑皮质及海马区尼氏体染色阳性神经元数占神经元总数比值(n=8,个/高倍视野,
2.3 各组新生大鼠脑组织ATF6、IRE1、PERK表达情况ATF6、IRE1、PERK阳性染色均呈棕黄色,阳性表达主要在损伤侧皮质及海马区,Sham组新生大鼠损伤侧大脑皮质及海马区胞质有少量ATF6表达,胞核中有少量IRE1表达,胞质中有少量PERK表达,而HIBD组损伤侧皮质及海马区胞质及核内ATF6表达均增加,且核内表达增加明显,胞核内IRE1表达增加,胞质内PERK表达增加,表明缺氧缺血后,3个ERS感受因子功能均活化并启动UPR,并激活3个因子介导的凋亡通路造成脑损伤。与Sham组比较,HIBD组新生SD大鼠大脑皮质及海马中ATF6、IRE1、PERK阳性细胞数(棕黄色)增加(P<0.05)。见图3和表2、3。
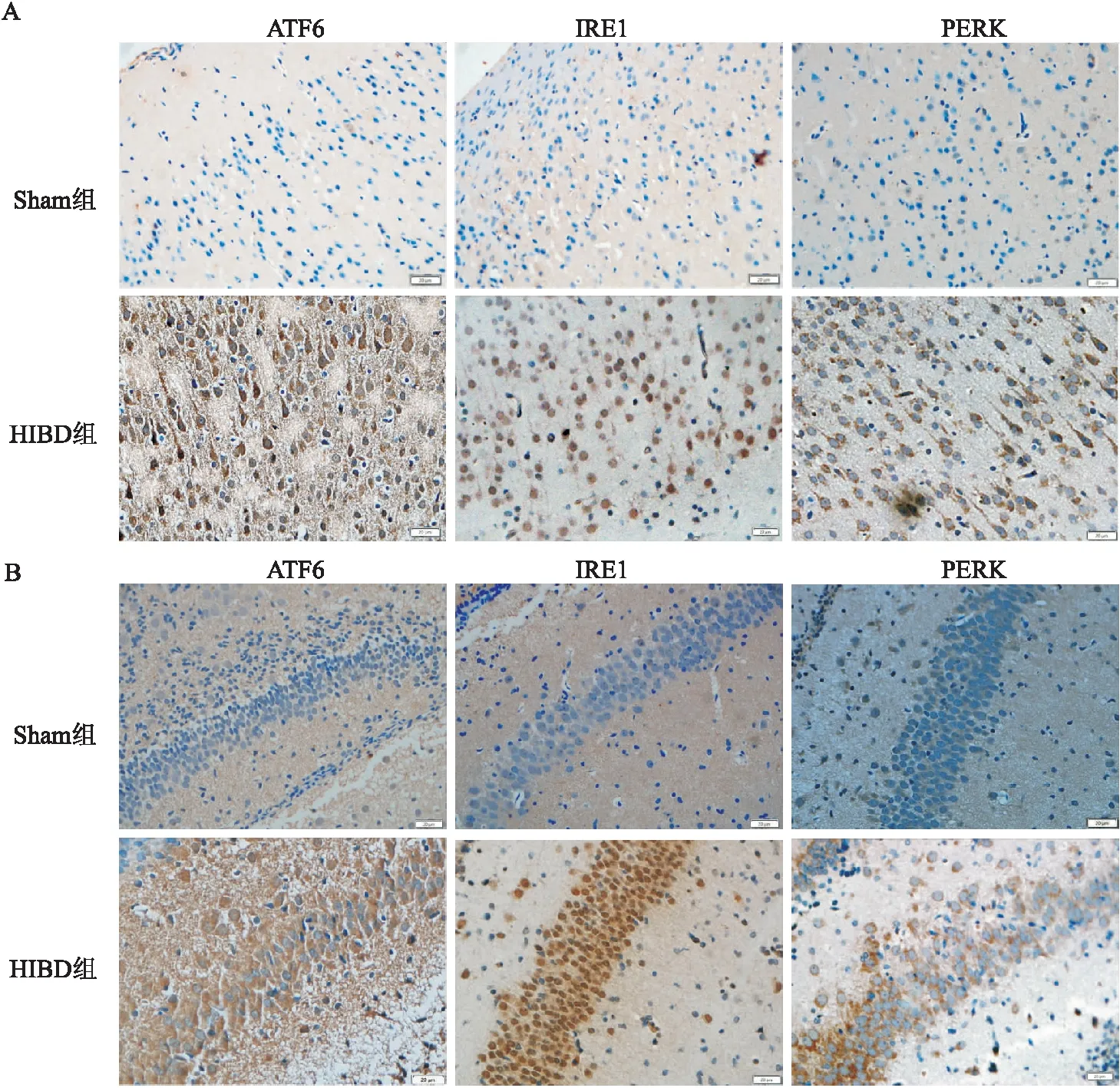
图3 各组脑组织免疫组化染色 ×400

表3 各组海马区ATF6、IRE1、PERK的表达免疫组化阳性细胞数比值(n=8)
2.4 各组大鼠脑组织不同时间点ATF6、IRE1、PERK蛋白表达比较与Sham组比较,HIBD组各时间点损伤侧脑组织中ATF6、IRE1、PERK蛋白表达随造模时间延长呈显著增高趋势,以72 h时间点表达量最高,见图4A。Western blot结果显示,ATF6、IRE1、PERK蛋白在6、24、72 h时间点,HIBD组较Sham组升高,差异有统计学意义(P<0.05)。见图4B~D。
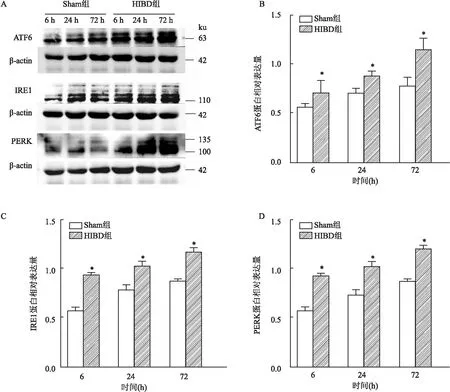
图4 各组新生大鼠大脑组织免疫印迹蛋白表达情况
3 讨论
新生儿HIBD是围产期发生的严重疾病[7],可导致患儿出现智力低下、学习障碍、癫痫、脑瘫等神经功能受损症状,甚至死亡,给家庭及社会带来巨大的经济负担。在我国HIBD是导致新生儿死亡及儿童致残的主要原因,相关研究[8]显示,新生儿缺氧缺血性脑损伤在发达国家中大约每1 000例存活的新生儿中有1~8例患病,而在发展中国家每1 000例存活的新生儿中患病者高达26例。目前唯一公认有效的治疗方法为亚低温治疗[9],且仅在6 h之内使用对于中度的HIBD有效,重度HIBD无明显疗效。因此研究缺氧缺血性脑损伤的发病机制,降低HIBD引起的死亡及致残率是儿科领域急需解决的重要问题。
研究[10]表明凋亡是新生大鼠缺氧缺血性脑损主要机制之一。而ERS通路是介导细胞凋亡的重要途径。内质网作为细胞内最大的细胞器,在蛋白质合成、加工和转运等过程中发挥重要作用。内质网对细胞内外环境的改变非常敏感,缺氧缺血等损伤可导致ERS。有研究[11]证实在缺氧缺血环境下,ERS会激活内质网的未折叠蛋白反应(unfolded protein response,UPR),以适应缺氧缺血损伤,但长时间以及表达过强的ERS可启动细胞凋亡。正常情况下内质网分子伴侣葡萄糖调节蛋白78 (glucose-regulated protein 78,GRP78)和3个ERS感受蛋白PERK、ATF6、 IRE1结合,处于无活性状态[12],一旦ERS发生,UPR激活导致未折叠的蛋白在内质网内积聚,使GRP78从3种跨膜蛋白上解离出来,与未折叠的蛋白结合,促进其折叠,并激活这上述3种跨膜蛋白,使上述三种蛋白功能活化,启动细胞凋亡途径[13]。研究[14]表明,ERS与许多急慢性神经系统疾病如脑梗死、癫痫、神经退行性疾病等相关。但ERS在缺氧缺血性脑损伤中的确切作用机制尚未阐明。
本研究显示,HE染色、尼氏染色显示HIBD后脑损伤的神经细胞数目增多,神经元内尼氏体数量减少,提示神经元损伤增加,且主要的损伤部位在损伤侧的皮质和海马区。免疫组化结果显示Sham组新生大鼠损伤侧大脑皮质及海马区胞质中有少量ATF6表达,胞核中有少量IRE1表达,胞质中有少量PERK表达,而HIBD组损伤侧皮质及海马区胞质及核内ATF6表达增加,且核内表达增加明显,胞核内IRE1表达增加,胞质内PERK表达增加,表明新生大鼠缺氧缺血时,3个ERS感受因子功能均活化并启动UPR,结合脑组织神经元损伤及凋亡增加的结果,表明3个ERS感受因子最终启动凋亡通路造成脑损伤。 Western blot检测显示,新生大鼠缺氧缺血性脑损伤后6 h,ERS相关因子ATF6、IRE1、PERK的表达量开始增加,72 h表达最高,进一步提示新生大鼠缺氧缺血性脑损伤后,发生ERS,且3个ERS感受因子介导的凋亡通路被激活,凋亡途径主要是CHOP通路、Caspases通路及JNK通路[15],CHOP在生理条件下表达较低,而ATF6、IRE1、PERK均能诱导CHOP的转录,使CHOP表达增加,从而诱导细胞凋亡。
综上所述,新生大鼠缺氧缺血性脑损伤后导致内质网功能受损,进一步启动ERS介导的神经元凋亡,ERS介导的细胞凋亡是一种新的凋亡途径,由此可见ERS在缺氧缺血性脑损伤中起重要作用,因此减少ERS可能是早期阻断新生儿缺氧缺血性脑损伤细胞凋亡的有效靶点。
