GP73中和抗体抑制MCD饮食诱导的非酒精性脂肪肝机制研究
2022-09-21刘家茏杨晓莉张雪苗杨小盼魏从文
刘家茏,杨晓莉,张雪苗,杨小盼,魏从文
截至2019年,非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)在亚洲的总患病率已经超过29.62%[1]。 NAFLD与肝细胞癌(hepatocellular carcinoma,HCC)的发生密切相关,每年罹患HCC的患者不断增多,使其一度成为全球癌症相关死亡的主要原因之一[2]。因此,寻找更有效的治疗方式或药物是解决NAFLD的主要手段。
肝脏处于病理状态时,其高尔基体蛋白73(golgi protein 73,GP73)往往会有较高的表达水平[3-4],它能调控TGF-β1/Smad2信号通路促进肝癌细胞的侵袭和转移[5],也具有辅助诊断低浓度甲胎蛋白(alpha-fetoprotein,AFP)原发性肝癌(primary hepatic carcinoma,PHC)的潜力[6]。GP73可通过促进SCAP/SREBPs的表达,参与脂质代谢途径,调控肝细胞脂肪变性[7],而NAFLD的发生与多种代谢综合征密不可分[8]。该研究通过饲喂蛋氨酸和胆碱缺乏(methionine-choline deficient,MCD)饮食,构建小鼠NAFLD模型,探讨GP73中和抗体在治疗NAFLD方面的价值。
1 材料与方法
1.1 实验动物SPF级C57BL/6小鼠,购于北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK 2016-0002。
1.2 试剂TriQuick Reagent 总RNA提取试剂(北京索莱宝科技有限公司);改良油红O染色液(北京索莱宝科技有限公司);EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金生物技术股份有限公司);PerfectStart®Green qPCR SuperMix(北京全式金生物技术股份有限公司);SREBP1一抗(英国Abcam公司);GP73一抗(美国Santa Cruz公司);α-SMA一抗(美国SAB公司);α-Tubulin一抗(美国Proteintech公司);GP73中和抗体(北京热景生物技术股份有限公司)。
1.3 仪器NanoDropTMLite 分光光度计(美国Thermo Fisher公司);QuantStudioTM3 Real-Time PCR System(美国Thermo Fisher公司);生物样品均质仪(杭州奥盛仪器有限公司)。
1.4 NAFLD模型的构建选择周龄性别一致的C57BL/6小鼠,其体质量情况和健康状况无明显差异,周龄6~8周。所有小鼠按照随机分配的方式被均分至模型组和对照组中,每组6只小鼠。模型组喂以MCD饮食,其中一组按照80 μg/2 d的规格尾部注射GP73中和抗体,另一组注射同体积IgG抗体(immunoglobulin G,IgG)。对照组喂养蛋氨酸和胆碱充足(methionine-choline sufficient,MCS)饮食,其它条件与模型组相同。连续干预1个月之后,摘取眼球收集小鼠血液和肝脏组织。
1.5 血清生化指标分析收集小鼠血清送至解放军总医院第三医学中心检验科利用全自动生化分析仪检测血清中的总胆固醇(total cholesterol,TC)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、三酰甘油(triglyceride,TG)和丙氨酸氨基转移酶(alanine aminotransferase,ALT)等指标。
1.6 ORO染色和HE染色采集模型组和对照组小鼠部分肝组织用10%福尔马林过夜固定,切片后置入恒冷箱。待冰冻后将切片取出,去离子水洗一次,然后置入60%异丙醇浸洗30 s。将切片放入ORO染色液中密闭染色15 min,再置入60%异丙醇浸洗30 s,经去离子水稍洗一次后,用苏木精复染核30 s,再用1%的盐酸溶液进行分化,然后经去离子水浸泡10 min,最后用滤纸吸干水分,用甘油明胶封片[9];HE染色切片由北京赛维尔生物科技有限公司负责制作[10]。
1.7 RNA提取利用生物样品均质仪研磨组织,按照TriQuick Reagent 总RNA提取试剂盒说明书提取模型组和对照组小鼠肝组织的总RNA,RNA浓度经分光光度计进行测定,琼脂糖凝胶电泳鉴定RNA完整无降解后用于后续实验。
1.8 qRT-PCR以上述RNA为样本,按照EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明书将RNA逆转录合成cDNA,并以此cDNA为模板,按照PerfectStart®Green qPCR SuperMix试剂盒说明书配制反应体系,利用QuantStudioTMReal-Time PCR System仪器进行qRT-PCR扩增,具体方法为先将PCR温度提高到94 ℃用以预热反应体系30 s,然后保持94 ℃变性5 s,再将PCR温度降低至55 ℃退火15 s,最后将温度升至72 ℃延伸10 s,1个反应循环包括变形、退火和延伸3个步骤,重复40个循环后即可根据荧光信号判断是否扩增出目的基因。引物序列见表1。

表1 qRT-PCR扩增引物序列表
1.9 Western blot取等质量模型组和对照组小鼠肝脏组织按照每20 mg组织加入200 μl裂解液的比例分别加入RIPA裂解液,裂解后再12 000 r/min离心5 min,收集上清液即为提取的组织蛋白。取各组适量蛋白上清行SDS-PAGE电泳,转膜,用5%脱脂奶粉封闭1 h,一抗4 ℃摇床过夜,经TBST洗涤后,二抗孵育1 h、洗涤、显影。利用Image J软件分析相对表达量。

2 结果
2.1 MCD饮食促使小鼠发生NAFLD分别取3只小鼠用MCD饮食和MCS饮食喂养,1个月后取小鼠血清和肝脏组织。研究发现模型组小鼠血清中AST、ALT水平均增高(图1A、B);TG、TC 水平降低(图1C、D);ORO染色的结果也显示MCD饮食后小鼠肝脏出现大量脂肪累积(图1E)。以上结果均与NAFLD症状一致,说明MCD诱导的小鼠NAFLD模型构建成功。
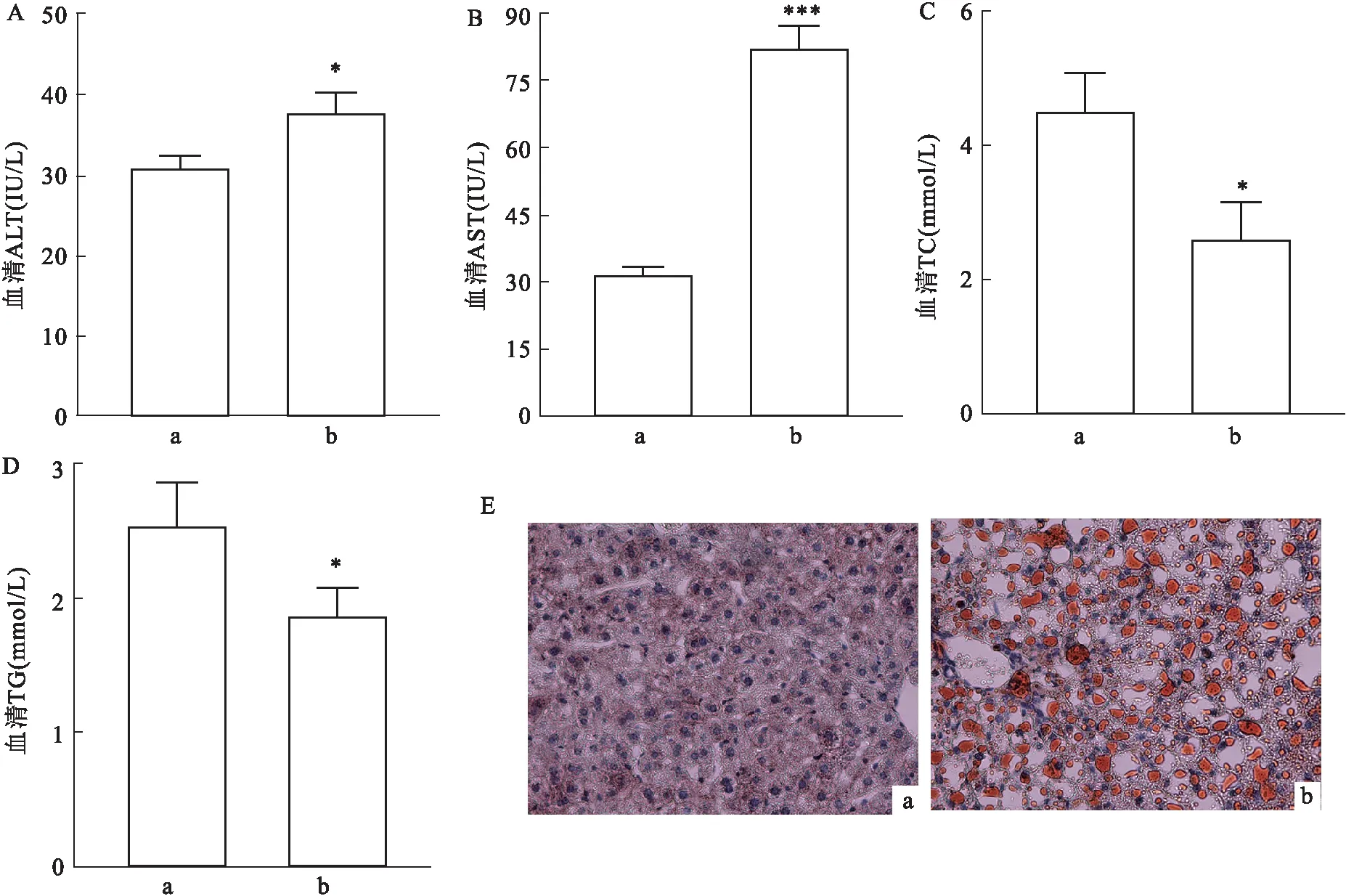
图1 MCD饮食促使小鼠发生NAFLD
2.2 GP73中和抗体抑制MCD诱导的小鼠NAFLD为了研究GP73中和抗体在肝脏病变中的功能,在构建MCD-NAFLD模型过程中按照80 μg/2 d的剂量给其中一组小鼠尾静脉注射GP73中和抗体,同时给另一组小鼠尾静脉注射等量的IgG作为对照。MCD饮食喂养4周后,针对各组小鼠血清中AST、ALT、TG、TC 等肝功能指标的变化情况进行分析。结果显示,在注射IgG的情况下,MCD饮食组小鼠血清AST和ALT水平高于MCS组,TG和TC 水平低于MCS组;GP73中和抗体的注射则会降低由MCD饮食诱导的血清AST和ALT增高,以及提高由MCD饮食诱导的血清TG和TC 降低。该结果说明在MCD诱导NAFLD过程中注射GP73中和抗体可有效抑制NAFLD的发展。见图2。
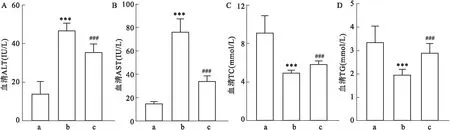
图2 GP73中和抗体抑制MCD诱导的小鼠NAFLD
2.3 GP73中和抗体降低脂肪酸的合成和抑制肝纤维化的进展NAFLD的发生是从肝细胞脂肪变性开始的,其中脂蛋白和载脂蛋白的缺少,以及脂肪酸和胆固醇的积累又是细胞脂肪变性的关键原因。为了深入了解GP73中和抗体抑制NAFLD的机制,本研究对模型组和对照组小鼠肝脏中的脂肪酸和胆固醇合成的关键酶ACC1、HMGR和SREBP1的表达水平进行分析。qRT-PCR结果显示,模型组GP73、ACC1、HMGR的转录水平相比对照组升高,但在MCD-NAFLD模型构建过程中注射GP73中和抗体则会降低GP73、ACC1、HMGR(图3A~C)的转录水平。蛋白水平的分析结果表明,MCD饮食会增加小鼠肝脏中蛋白SREBP1的表达水平,注射GP73中和抗体则会使其降低(图3D)。肝脏的ORO染色和HE染色的结果表明,MCD饮食会造成肝脏脂肪的大量累积,GP73中和抗体的注射会降低肝内脂滴的形成(图3E、F)。综上所述,GP73中和抗体降低了NAFLD过程中脂肪的累积。
此外,NAFLD发生过程中往往伴随着肝纤维化,肝纤维化离不开肝星状细胞在组织炎症部位的活化以及TGF-β、TIMP1表达水平的增加[11-12]。为了研究GP73中和抗体对肝纤维化的影响,检测了肝星状细胞活化的标志物α-SMA以及TGF-β、TIMP1的表达水平。MCD-NAFLD模型构建后,α-SMA的蛋白水平明显增加,注射GP73中和抗体则会使其降低(图3D),GP73中和抗体抑制NAFLD发生过程中肝星状细胞的活化;与之相一致,NAFLD发生后TGF-β、TIMP1转录水平均升高,GP73中和抗体虽未能改变TIMP1的转录水平,但降低了TGF-β的转录水平(图3G、H)。综上所述,GP73中和抗体抑制NAFLD过程中的肝纤维化。
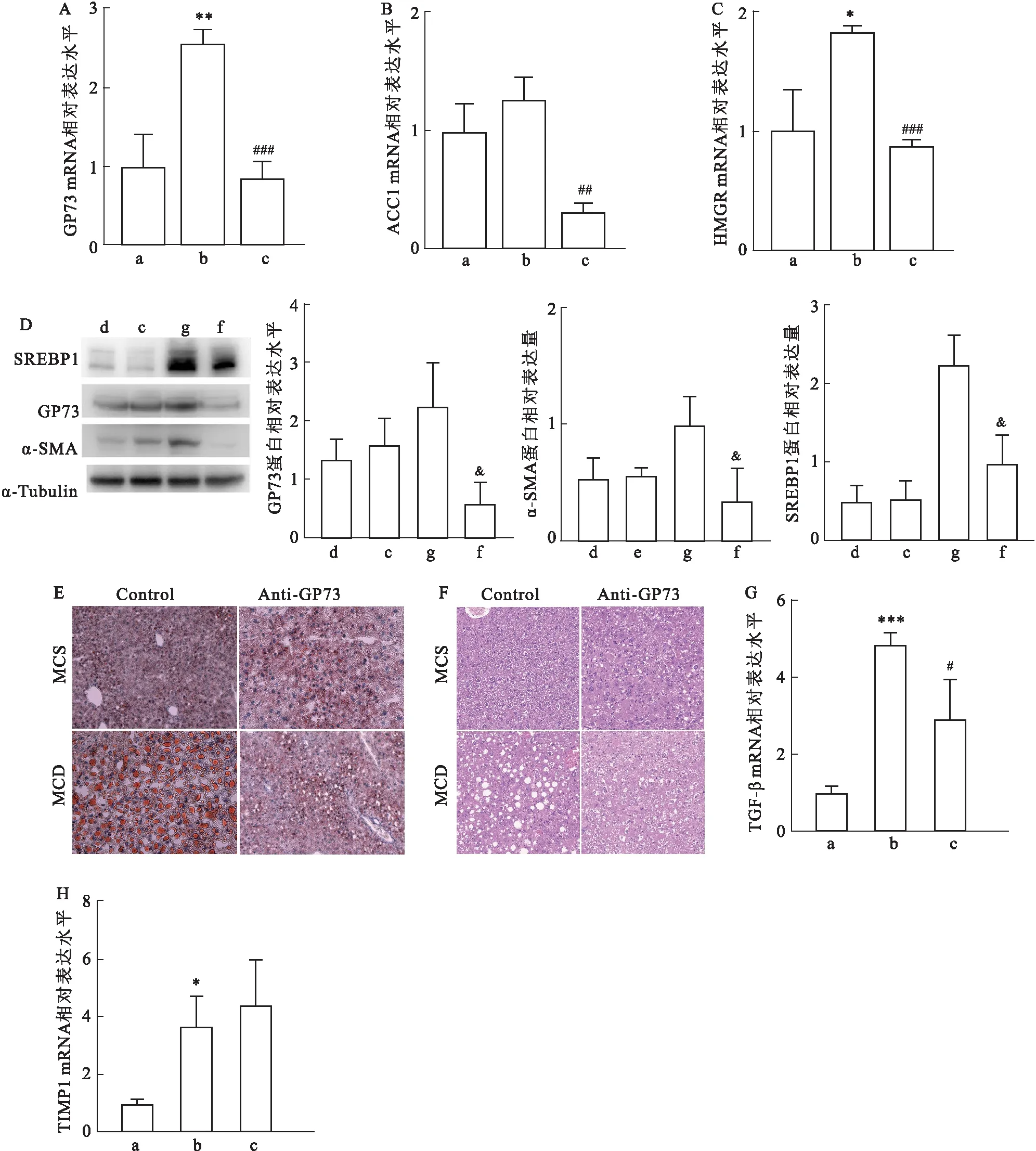
图3 GP73中和抗体降低脂肪酸的合成和抑制肝纤维化的进展
MCD饮食会增加小鼠肝脏中α-SMA、SREBP1的蛋白表达水平和HMGR、TGF-β、TIMP1的转录水平,而在此过程中注射GP73中和抗体则会降低蛋白α-SMA、SREBP1的蛋白表达水平以及ACC1、HMGR和TGF-β的转录水平。因此,GP73中和抗体对MCD诱导的NAFLD的抑制作用可能与肝细胞脂肪酸积累和纤维化受到抑制有关。
3 讨论
MCD饮食通过减少小鼠对蛋氨酸和胆碱的摄入,导致极低密度脂蛋白(very low density lipoprotein,VLDL)合成减少,脂肪无法得到分解利用,脂肪不断积累,最终形成NAFLD[13]。这一过程模拟NAFLD的形成,并且效果显著,因此MCD饮食被广泛应用于小鼠NAFLD模型的构建。本研究发现MCD饮食会使模型组小鼠血清AST、ALT水平升高,TG、TC 水平降低,ORO染色和HE染色中模型组小鼠肝组织切片出现大量气球样脂滴。以上结果均符合MCD诱导NAFLD的模型特点。除此以外,模型组小鼠在注射GP73中和抗体后,肝组织中GP73的mRNA转录水平和蛋白表达水平均降低,即证明此抗体符合实验需求。
在以上述结果为基础的情况下,本研究发现注射GP73中和抗体后能逆转MCD导致的小鼠血清AST、ALT水平升高以及血清TG、TC 水平降低,即GP73中和抗体能抑制MCD对小鼠肝脏的影响,证明当肝脏处于病理状态时,GP73与MCD有类似的功能或GP73能促进MCD对小鼠肝脏的影响。在针对肝组织中脂肪、胆固醇合成相关基因,以及肝纤维化相关指标的mRNA表达量的检测中发现,相较于MCS,MCD会造成HMGR、TGF-β、TIMP1的转录水平升高,而当GP73被拮抗以后,ACC1、HMGR、TGF-β的转录水平下降。同时,Western blot也证明GP73中和抗体会降低MCD组小鼠肝组织内α-SMA和SREBP1蛋白的表达量,减缓肝细胞脂肪堆积和纤维化进程,与上述结果一致。ORO染色和HE染色结果表明,由MCD喂养的小鼠普遍存在脂肪堆积和肝细胞气球样变,当有GP73中和抗体参与时,脂肪堆积减少,肝细胞气球样变减少,脂肪病变的情况得以改善。
综上所述,GP73可能参与调节肝细胞的病理进程,同时也证明了GP73中和抗体在治疗NAFLD方面具有巨大潜力。在MCD诱导小鼠NAFLD模型的过程中,将模型组小鼠GP73拮抗后上述相关基因和蛋白的表达趋势的变化并不能在对照组中重现,意味着仅当肝脏处于病理状态时,GP73的减少会减缓NAFLD的进展,并且这种效果并不能在正常肝组织中体现。GP73可通过上调SCAP来激活SREPBs,进而促进肝细胞脂肪变性[7],而当GP73被抗体中和之后,SREBP1蛋白水平随之降低,表明SCAP-SREPBs的相互作用被抑制,脂肪合成受阻。同时,由于脂肪堆积是肝细胞脂肪变性和纤维化的基础,当脂肪合成减少后,肝细胞脂肪变性和纤维化相关指标的表达水平也会降低。具体原因将通过多组学分析的方法,对GP73作用的基因调控靶点做更深层次的研究。
