不同暴露方式下利奈唑胺联合磷霉素对金黄色葡萄球菌抗菌效应研究
2022-09-21张贵军沈陈林刘艳艳江丽芳李家斌黄晓晖
张贵军,黄 宏,沈陈林,刘艳艳,谢 娜,江丽芳,李家斌,黄晓晖
抗菌药物联合体外研究中绝大部分在实验设计时通常是以药物同时暴露于受试菌的方式进行[1-2]。而这并不一定与临床实践中的情况完全相符,如由于药物半衰期不同进而给药的频次不同[3];或因为理化性质的差异并不能混合给药,如将氨基糖苷类和β-内酰胺类混合给药时,会导致彼此丧失抗菌效应。故有些抗菌药物联合时会采用序贯给药方式。
利奈唑胺(linezolid,LZD)联合磷霉素(fosfomycin,FOS)对金黄色葡萄球菌在体内和体外均具有良好的抗菌效应[4-5]。但是,蛋白合成抑制剂联合细胞壁合成杀菌药尚存在一定的不确定性[6];且现有文献关于LZD联合FOS的研究均采用的是同时给药方式,尚未有研究二者在序贯给药下的药效学关系。因此,该研究重点探讨两药在不同暴露顺序、间隔下对抗菌后效应(post-antibiotic effect,PAE)和杀菌效应的影响。
1 材料与方法
1.1 实验菌株受试菌株为金黄色葡萄球菌ATCC29213,由安徽细菌耐药监测中心提供。
1.2 药物与试剂LZD购自美国Selleck Chemicals公司,FOS购自中国食品药品检定研究院。 MH琼脂(mueller-hinton agar,MHA)购自英国Oxoid公司, MH肉汤(mueller-hinton broth,MHB)购自青岛高科园海博生物技术有限公司,6-磷酸葡萄糖购自北京索来宝科技有限公司。FOS的实验均添加6-磷酸葡萄糖(终浓度为25 mg/L),药物均配成合适浓度的应用液分装并储存在-20 ℃冰箱中备用(有效期2个月)。
1.3 方法
1.3.1菌悬液制备 从接种待测菌的培养皿上取2~3个大小相似的待测菌落于3 ml无菌肉汤中,37 ℃震荡培养箱中过夜培养后,取20 μl细菌培养液于2 ml无菌肉汤中继续在37 ℃震荡培养箱中培养2~3 h,使细菌进入对数生长期。然后调整细菌浓度为(1~2)×108CFU/ml,再以无菌肉汤稀释10倍得到细菌应用液(1×107CFU/ml)。
1.3.2最低抑菌浓度(minimal inhibitory concentration,MIC)测定 参照美国临床与实验室标准委员会推荐的琼脂稀释法测定[7]。所有实验均重复3次。
1.3.3PAE测定 取上述细菌应用液0.5 ml加入含4 ml MHB的试管中(T管),再加入0.5 ml LZD或FOS应用液,此时试管中药物终浓度分别为4 mg/L和2 mg/L。最终细菌浓度在1.5×106CFU/ml左右。另设未接触药物的空白对照组(C管),加0.5 ml浓度为1×107CFU/ml菌液和4.5 ml的MHB。混合均匀后均置于37 ℃恒温培养箱中同步震荡孵育1 h。
所有实验均重复3次。首先测定LZD与FOS单药及联合暴露1 h的PAE;再测定两药在不同的给药顺序及间隔下的PAE值。具体如下:将受试菌首先暴露于LZD 1 h,然后在其PAE起始期(Tb=0 h,洗去LZD后立即加入FOS),中间期(Tm=0.5 h,洗去LZD后间隔0.5 h)和结束期(Te=2 h,洗去LZD后间隔2 h)分别给予FOS暴露1 h后测定PAE。改变给药顺序和间隔,即先暴露FOS,在其PAE的起始期(Tb=0 h),中间期(Tm=1 h)和结束期(Te=2 h)分别给予LZD暴露1 h后测定PAE。本实验采用洗涤离心法除去药物,即在每个孵育终点时,用适量MHB冲洗培养物,以3 000 r/min离心5 min去除药物,连续洗涤3次,再用MHB稀释成所需体积。
于0、1、2、4、6、8、10 h分别采样0.1 ml,用无菌生理盐水进行10倍系列稀释后,取适当稀释度菌液涂布于空白琼脂板,倒置于37 ℃恒温培养箱中孵育18~24 h后进行菌落计数。PAE的计算根据标准公式:PAE=T-C,其中T为稀释后实验管中细菌增加1 log10所需时间,C为稀释后对照管中细菌增加1 log10所需时间。PAE运用于联合抗菌效应研判时,是指联合PAE比两药单药PAE之和更长、相似或更短时,则两药判断为协同、相加或拮抗作用。在间隔给药中,在PAE中间期和结束期,为防止对照组细菌过度生成,需分别进行10倍和100倍稀释处理。
序贯给药实验中,后暴露药物的净PAE值是从实际测得的PAE值减去先暴露药物的残留PAE。此外,先暴露药物和后暴露药物之间存在一个暴露时间差(Tb、Tm和Te)。而残留PAE是通过在第一项实验中得到的单药PAE减去暴露时间差计算得出。以LZD的PAE中间期 (Tm) 暴露FOS为例,LZD的残留PAE等于单药LZD的PAE减去Tm,则FOS的净PAE等于实际测得的PAE减去LZD的残留PAE。
1.3.424 h杀菌实验 取上述细菌应用液和药液分别加入实验管中,最终细菌浓度在1×106CFU/ml左右,药物浓度均为2×MIC。分3种暴露方案:① 同时暴露;② 先暴露LZD 1 h后再暴露FOS;③ 先暴露FOS 1 h后再暴露LZD。同步设空白对照组,于0、2、4、8、10、24 h分别取样50 μl,用无菌生理盐水进行10倍系列稀释后,取适当稀释度菌液涂布于空白琼脂板,倒置于37 ℃恒温培养箱中孵育24 h后进行菌落计数,绘制杀菌曲线。所有实验均重复3次。
1.4 统计学处理采用SPSS 23.0版统计软件进行数据分析。采用单因素方差分析(One-way ANOVA)比较4、8、10、24 h细菌生长的变化,再进行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 MICLZD和FOS对ATCC29213的MIC分别为2 mg/L和1 mg/L。
2.2 PAELZD暴露1 h的PAE为(1.2±0.1)h,FOS暴露1 h的PAE为(1.6 ±0.1)h,同时暴露1 h的PAE为(2.9±0.1)h,两药联合呈相加效应。3种暴露方式下的细菌生长曲线见图1。
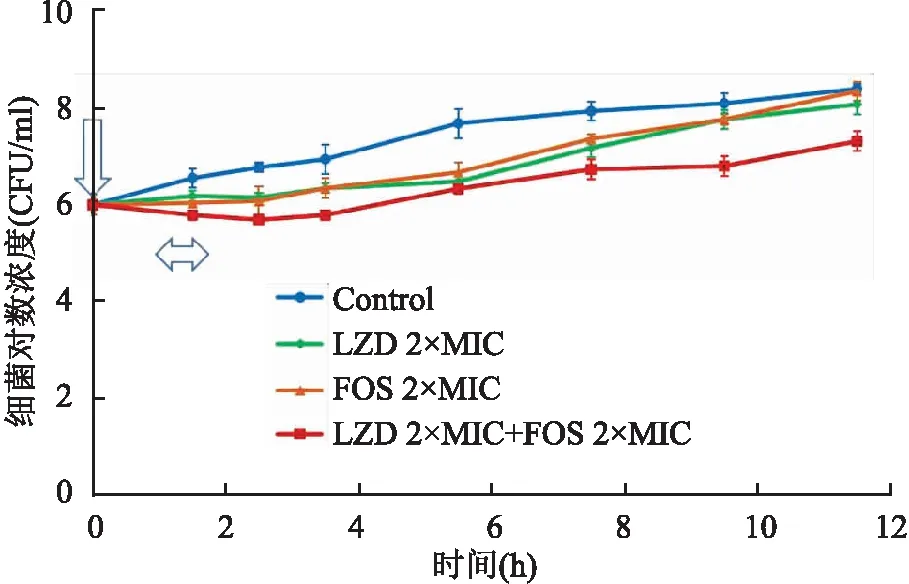
图1 ATCC29213暴露于LZD和FOS单药及联合1 h的PAE细菌生长曲线
序贯给药实验中,先暴露LZD后,分别在其PAE的Tb、Tm和Te暴露FOS,实测PAE值分别为(0.9±0.1)、(0.7±0.3)和(0.9±0.1)h;对应LZD的PAE残留值分别为1.2、0.7和0 h,则FOS的净PAE平均值分别为-0.3、0和0.9 h。3种暴露条件下的细菌生长曲线见图2。
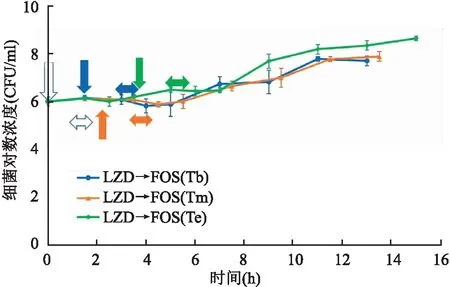
图2 ATCC29213暴露于LZD 1 h后,分别在其PAE的Tb、Tm和Te给予FOS暴露1 h细菌生长曲线
当先暴露FOS时,在其PAE的Tb、Tm和Te暴露LZD后,分别测得PAE值为(2.8±0.1)、(2.0±0.2)和(1.3±0.1)h;对应FOS的PAE残留值分别为1.6、0.6和0 h,则LZD的净PAE平均值分别为1.2、1.4和1.3 h。3种暴露条件下的细菌生长曲线见图3。
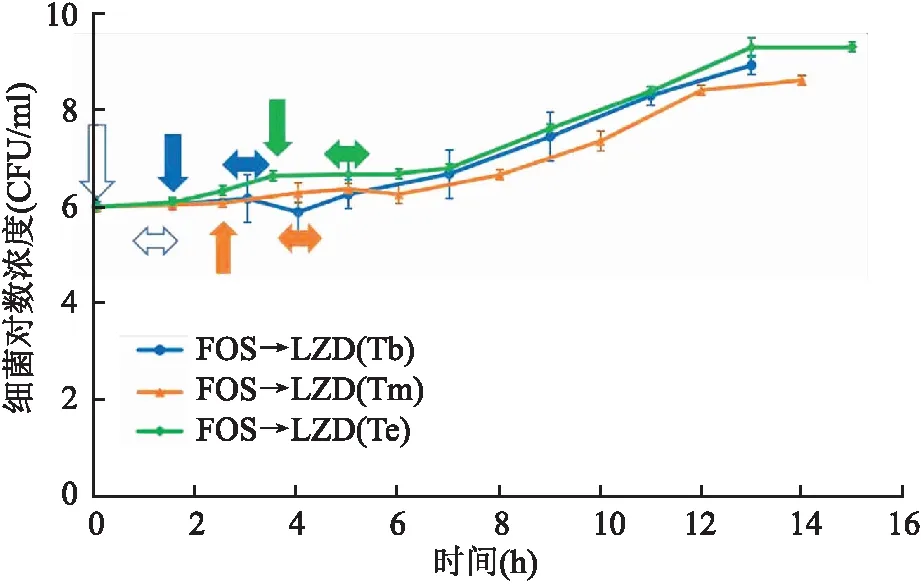
图3 ATCC29213暴露于FOS 1 h后,分别在其PAE的Tb、Tm和Te给予LZD暴露1 h细菌生长曲线
2.3 24 h杀菌实验效果分析先暴露LZD和同时暴露时,给药10 h时二者细菌减少的程度几乎一致,持续24 h后差异无统计学意义(P=0.198)。而相较于先暴露FOS,给药4 h后,细菌下降的程度即出现了明显分化,即先暴露FOS后细菌减少明显强于先暴露LZD (P=0.002)和同时暴露(P=0.012),且持续至24 h的差异更为明显,相差1 log10左右。统计分析结果显示给药方式不同,24 h杀菌效果差异有统计学意义(F=13.325,P=0.006),见图4。
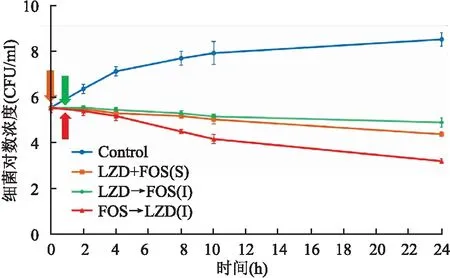
图4 LZD联合FOS三种暴露方式下对金黄色葡萄球菌ATCC29213的杀菌曲线
3 讨论
PAE作为一种时间药效学参数,在单药中进行了广泛而深入的研究,但其在抗菌联合中的相关研究性文献较少。据Li et al[8]研究发现PAE反映的抗菌联合药效学关系取决于药物的暴露模式、顺序和间隔。这表明暴露方式对某些抗菌联合的药效学行为起着不可忽视的作用;如在利福平或红霉素的PAE相内,β-内酰胺和氨基糖苷类对大肠杆菌和肺炎克雷伯菌的杀菌活性明显降低,且与PAE的持续时间相关[9]。
本研究序贯给药下,在LZD的PAE相内给予FOS暴露,其几乎没有产生PAE,这表明受试菌在受到LZD的作用后,对FOS的敏感性降低,前者对后者产生了拮抗作用;并且这种拮抗越是在LZD的PAE早期越明显。有学者提出蛋白质合成抑制剂产生的停滞作用可能会抑制需在细胞分裂期发挥作用来阻断细胞壁合成的抗菌药物的活性[10-12]。LZD是一种恶唑烷酮类蛋白合成抑制剂,其首先接触受试菌后,对受试菌的繁殖行为产生了停滞作用,导致受试菌处于细胞分裂静止期;而破坏细胞壁合成的杀菌剂FOS发挥杀菌作用需要受试菌处于细胞分裂繁殖期时达到最佳[13]。这可能导致FOS与受试菌的结合能力下降,使得进入菌体内的FOS量减少,而PAE的持续时间是细胞内有效抗菌药物残存的量度[14]。这表明先暴露LZD的给药方式在二者联合时可能不是一种可取的选择。
据体外和临床研究报道,先暴露FOS的给药方式可以显著提高联合药物的抗菌效应[15-16]。而在本研究的24 h杀菌实验中,先暴露FOS给药方式比同时暴露和先暴露LZD产生更早更强的抗菌作用;而同时暴露方式在联合抗菌时间更长的情况下并未体现杀菌优势。推测产生这种差异的原因可能是由于FOS具有独特的阻断细胞壁合成的抗菌机制[17-18];当首先接触受试菌后,在早期抑制肽聚糖的合成,破坏了细菌的外部结构,并最终阻断细菌细胞壁的合成,这使得LZD更容易进入菌体内发挥抗菌作用,进而两药联合产生了增强的抗菌效应。
综上所述,本研究的结果支持LZD联合FOS的药效学行为与药物的暴露方式密切相关。同时暴露可能并未发挥最佳抗菌效应,而先暴露FOS的方式可能是更优的给药方案。进一步的研究包括耐药菌、体内实验以及临床研究等来探讨序贯给药对联合药动学和药效学的影响可能是需要的。
