羊毛固醇合成酶杂合敲除小鼠全脑转录组学分析
2022-09-21李艳玲李昱昊孙晓梅张素梅张胜权
李艳玲,李昱昊,孙晓梅,张 军,张素梅,张胜权
胆固醇是哺乳动物细胞中重要的脂质分子,可以调节生物膜的流动性[1]。胆固醇在体内可以转化成类固醇激素、胆汁酸和氧化固醇调控机体的生长发育等生理过程。胆固醇代谢异常参与了动脉粥样硬化、癌症、阿尔茨海默病和其他神经退行性疾病的发生发展。羊毛固醇合成酶(lanosterol synthase,LSS)催化(S)-2,3-氧化喹烯环化合成羊甾醇形成甾醇核的反应[2]。Mori et al[3]证实LSS基因的错义突变可导致先天性白内障。羊毛固醇转化为胆固醇有两种途径:Bloch途径和Kandutsch Russell途径。在小鼠中,Bloch途径介导了睾丸、脾脏和肾上腺中90%或更多的胆固醇生物合成,而大脑70%以上的胆固醇生物合成来自脑星型胶质细胞[4]。该研究通过LSS(+/-)小鼠与野生型(wide type,WT)小鼠全脑基因表达谱分析,经过数据筛选和基因表达谱的聚类分析,找出差异表达基因,为进一步研究胆固醇代谢对动物行为学的影响及在神经系统疾病中的作用奠定基础。
1 材料与方法
1.1 实验动物委托南京生物医药研究所构建LSS(+/-)小鼠,回交繁殖,取8周龄LSS(+/-)雌鼠及WT雌鼠全脑组织委托华大基因公司进行RNA-Seq分析(n=3),同时取全脑组织进行实时定量荧光PCR及Western blot分析。动物实验方案符合安徽医科大学动物伦理委员会相关规定。
1.2 试剂裂解液 RIPA、SDS-PAGE(5×)、Trizol、蛋白预染 Mark 购自美国Thermo Fisher Scientific公司;Tris、甘氨酸、SDS 购自上海生物工程有限公司;Tween-20 购自美国Sigma公司;抗体稀释液购自美国TOYOBO 公司;10×Loading Buffer、 DL2000 DNA Ladder 购自美国TAKARA 公司;蛋白胨、琼脂粉、蛋白胨购自美国OXOID公司;EB购自赛百盛基因技术有限公司;鼠尾基因鉴定试剂盒购自上海碧云天生物有限公司。
1.3 小鼠基因组DNA提取剪取小鼠尾尖3~5 mm放入1.5 ml EP管中,实验试剂按照比例将DNA Extraction Solution 和 Enzyme Mix 充分混匀,取0.5 ml消化液加入EP管中,55 ℃,3~5 h。15 000 r/min离心,10 min。取上清液0.4 ml,加入异丙醇,上下颠倒10次,4 ℃,15 000 r/min离心,5 min。去上清,滤纸吸干,加入70%乙醇溶液,将管底沉淀弹起,洗涤。离心,去上清液,空气干燥5~10 min,加入1×TE约100 μl,震荡30 min,于4 ℃保存。具体方法按试剂盒说明书操作。
1.4 PCR扩增反应PCR是以单链DNA为模板,4种dNTP为底物,在有引物存在的情况下,进行互补链的延伸,反复的循环能使模板DNA得到极大的扩增。于离心管中,加入Premix Taq(TaKaRaTaq Version 2.0 Plus dye) 15 μl、R引物1 μl孔 DNA模板1 μl、F 引物1 μl、加入双蒸水补足至30 μl。在Taq DNA聚合酶的催化下,以dNTP为原料,引物沿5′→3′方向延伸,形成新的DNA片段,如此重复改变温度,使目的基因得以迅速扩增。引物是由南京大学南京生物医药研究所设计,由生工生物工程(上海)股份有限公司合成,LSS基因引物分别是ACCTGGGCGGAGTCTAAGGAAG(上游)和AAGGCTCTCCACTGTTTCAGAGCT(下游)。
1.5 琼脂糖凝胶电泳和基因型结果判断取0.24 g琼脂糖加入25 ml 1×TAE电泳缓冲液中,加热至完全溶解,稍冷却至不烫手,加入2 μl EB,上样DNA样本5 μl,电泳电压90 V,时间90 min,于化学发光凝胶成像系统中拍照观察。扩增产物长度为328 bp左右条带为WT小鼠;扩增产物有282 bp和328 bp两条电泳条带则为杂合敲除小鼠LSS(+/-)。
1.6 RNA-Seq分析取8周龄LSS敲除(+/-)小鼠与WT C57BL/6雌鼠各3只,水合氯醛麻醉处死,取全脑,提取总RNA,委托华大基因公司进行RNA-Seq分析。
1.7 实时定量荧光PCR分析取小鼠尾部组织,提取和反转录RNA,PCR扩增。配置PCR反应液,冰上操作。考虑到加样误差,PCR反应液应比实际需要多配置一些体积。将配完的反应液分装至反应板或微量离心管中。盖上管盖,确保封严。为避免干扰PCR仪读取荧光信号,应谨慎选择在反应板或离心管上标记的位置,使用离心机高速瞬离。将反应板放入实时定量荧光 PCR扩增仪中。根据说明书设定反应程序。反应结束后确认扩增曲线和融解曲线。导出、拷贝数据,计算、统计结果。结果以2-ΔΔCt方法计算。
1.8 Western blot 检测脑组织中LSS蛋白的表达取全脑组织置于离心管中,加入裂解液和蛋白酶抑制剂,匀浆机破碎组织,提取全脑组织总蛋白。用蛋白浓度测定试剂(BCA法)进行蛋白定量,取蛋白样品加入上样缓冲液,煮沸。保存于-20 ℃冰箱。配置10%聚丙烯酰胺凝胶,蛋白样品上样,电泳1 h后转膜,转膜后牛奶封闭,一抗(1 ∶1 000) 4 ℃过夜,次日用1×TBS-T 洗膜3次,加二抗室温2 h,1×TBS-T洗膜3次。 ECL 化学发光试剂进行显影,软件测定吸光度值以计算蛋白表达。
1.9 基因表达谱分析技术以biotinylated oligo(dT)为引物反转录合成cDNA,用限制性内切酶酶切。通过链霉抗生物素蛋白珠收集cDNA 3′端部分。对每一个mRNA只收集其polyA尾与最近的酶切位点之间的片段。将cDNA等分为A和B两部分,分别连接接头A或接头B。接头的结构为引物A/B序列+标签酶识别位点+锚定酶识别位点。用标签酶酶切产生连有接头的短cDNA片段(约9~10碱基),混合并连接两个cDNA池的短cDNA片段,构成双标签后,用引物A和B扩增。

2 结果
2.1 C57BL/6小鼠基因型鉴定LSS敲除(+/-)小鼠回交繁殖的子代8周龄雌鼠,剪尾提取基因组DNA、PCR及琼脂糖电泳分析结果见图1。LSS敲除(+/-)小鼠的PCR扩增产物为两条带,大小分别为282 bp和328 bp,而WT小鼠仅一条带为328 bp。图1中3、4、7、10号为LSS(+/-)小鼠,而2、6、8及11~18号为WT小鼠;1、5、9号小鼠需重新鉴定。
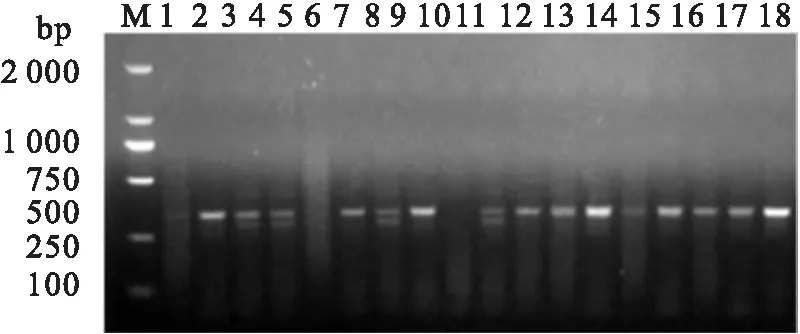
图1 小鼠基因型鉴定PCR扩增产物琼脂糖电泳结果
2.2 RNA-Seq分析结果选取8周龄LSS敲除(+/-)小鼠及C57BL/6小鼠各3只,取全脑提取总RNA进行RNA-Seq分析。结果发现两组间存在320个差异基因(P<0.05),见图2,其中上调基因 145个,下调175个。使用 R 软件中的 phyper 函数进行富集分析,计算 P值,然后对P值进行 FDR 校正得到Q值,Q≤0.05的功能视为显著富集。KEGG 通路富集及网络互作分析发现,差异基因表达与神经活化的受体与配体通路(16个基因)、河马信号途经(7个基因)及谷氨酸能突触途径(9个基因)有关,见图3、4。
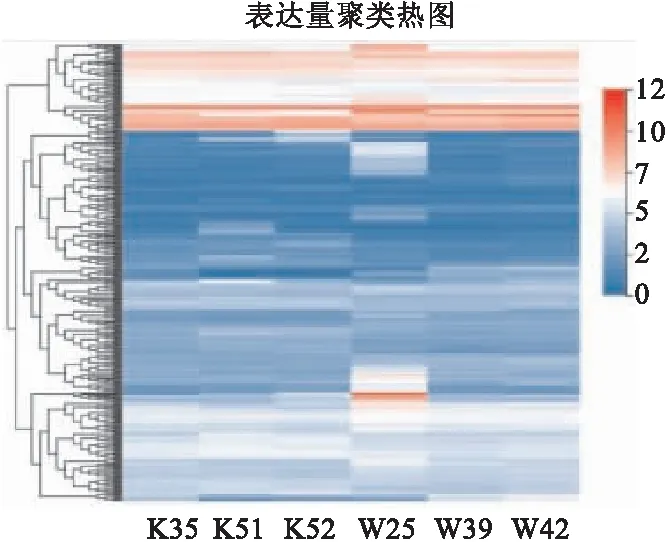
图2 LSS敲除(+/-)小鼠及C57BL/6小鼠差异表达基因热图

图3 差异基因KEGG富集结果
2.3 实时定量荧光PCR技术分析LSS(+/-)及WT小鼠全脑RNA-Seq为了进一步验证RNA-Seq分析的结果,本实验通过实时定量荧光PCR技不同形状表示不同的内容(节点,node),方块表示KEGG Pathway,圆形表示mRNA;颜色和大小都表示与该节点连接的基因或转录本数;颜色越深、方块越大,表示与该节点连接的基因或转录本越多术分析LSS(+/-)小鼠及WT C57BL/6小鼠全脑mRNA,结果提示,与WT小鼠比较,LSS(+/-)小鼠中CCKBR与Htr5b的表达分别上调约8倍及6倍, 而Gri2c、Drd2、Grm4及Adora2d表达均下调,这些基因中大部分与情绪相关,提示其可能影响小鼠的情绪,见图5。
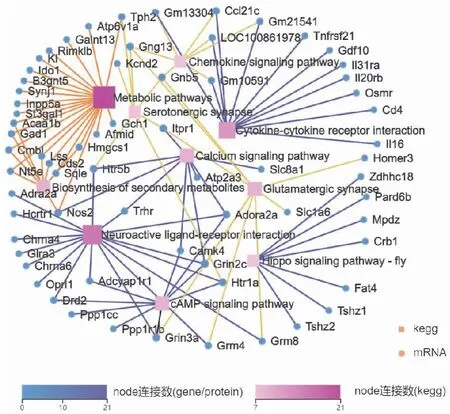
图4 差异表达基因网络互作图

图5 实时荧光定量PCR分析结果
2.4 CCKBR基因在LSS(+/-)小鼠脑中高表达选取8周龄WT C57BL/6小鼠及LSS敲除(+/-)小鼠各3只,分别提取小鼠全脑组织总蛋白,CCKBR基因在LSS(+/-)小鼠中明显高表达,见图6。总ERK无变化,p-ERK在LSS(+/-)组表达较高,总AKT在LSS(+/-)组表达较低。

图6 小鼠全脑组织Western blot分析结果
3 讨论
胆固醇代谢对大脑功能影响十分重要,胆固醇合成的LSS,其催化环氧鲨烯环化成第1个固醇类化合物——羊毛固醇,因此,LSS是胆固醇合成过程中的关键酶之一[5]。通过RNA-Seq分析LSS敲除(+/-)小鼠及WT C57BL/6小鼠差异表达基因提示:LSS杂合敲除,导致了小鼠大脑中320个基因表达发生改变,其中上调基因 145个,下调175个,这些差异基因涉及了神经活化的受体与配体通路、河马信号通路及谷氨酸能突触相关通路,提示LSS杂合敲除可能影响小鼠大脑功能及行为。
胆固醇对脑功能的影响至今在动物模型及人类临床研究中没有取得一致的结果,有研究[6]提示高胆固醇饮食损害动物及人的学习记忆能力,而有研究[7]却取得了相反的结果。由于血脑屏障的关系,血液中的胆固醇并不能进入大脑,大脑中的胆固醇主要由脑星型胶质细胞合成[8-9]。本研究建立的LSS杂合敲除小鼠模型,理论上会导致大脑胆固醇合成的减少,有助于探讨胆固醇对大脑功能的影响,但LSS杂合敲除理论上还导致了羊毛固醇及其下游产物的减少,而这些中间产物对大脑的功能也有一定影响,因此,LSS杂合敲除对脑功能的影响可能不仅仅能用胆固醇的减少来解释,这是本模型在研究胆固醇对大脑功能影响的不足之处。 研究[10-11]表明人类LSS基因突变导致白内障、少毛症等疾病,通常伴有智力障碍,提示LSS基因突变影响大脑功能。本研究发现LSS杂合敲除导致了大脑中320个表达差异基因,这些基因与大脑的神经信号通路有关。荧光定量PCR验证发现与情绪有关基因表达显著升高。其中CCKBR表达显著上调,该受体活化参与调节多种神经生物学过程,包括:焦虑、痛觉、突触传递等活动[12],同时全脑中AKT与ERK活化成相反趋势,研究表明ERK 活化促进神经元的分化,而AKT活化诱导神经元祖细胞增长和存活,提示这两条信号途径对神经细胞生理功能均具有重要作用[13],但CCKBR上调与AKT及ERK信号通路的关系等分子机制有待进一步研究。
本研究仅分析了LSS杂合敲除导致小鼠大脑差异表达基因及其通路分析,给出了LSS基因功能异常及胆固醇水平变化可能影响大脑功能的分子水平的初步证据,下一步需要重点探讨其中一些重要的基因对小鼠行为学的影响,并阐明LSS杂合敲除及胆固醇水平变化对大脑功能影响的分子机制,为人类疾病如阿尔茨海默病等发病机制的研究提供帮助。
