长白猪Plin3、Plin5基因克隆及表达规律研究
2022-09-21李鑫月郭振清李红强
李鑫月 郭振清 张 寒 李红强,2,*
(1 河北科技师范学院动物科技学院,河北 昌黎 066000;2 河北省特色动物种质资源挖掘与创新重点实验室,河北 昌黎 066000)
猪肉是我国居民的主要肉食来源,其产量在肉类总产量中占主导地位,是我国生产和消费最多的肉类品种。脂肪沉积性状是养猪生产中重要的经济性状,既与生猪生产效率和繁殖性状密切相关,还影响猪肉品质和消费者对猪肉的选择。脂肪沉积是一个动态平衡过程,包括脂肪合成、脂肪分解和脂肪转运等过程。沉积在肌束间和肌纤维间的脂肪,即肌内脂肪,其含量直接影响猪肉的感官品质、风味、多汁性、嫩度和色泽[1],因此将肌内脂肪含量作为判断猪肉品质的重要指标之一。
脂滴作为肌内脂肪细胞存储脂肪的细胞器,受到研究人员的普遍关注。不同组学研究发现,脂滴形成和发育受多种脂肪生成相关基因、转录因子以及表观遗传因子共同调控。PAT(perilipin-adipophilin-tail interacting protetin of 47 ku)家族蛋白是最早被发现的脂滴相关蛋白,在脂滴合成和分解过程中起作用,包括Plin1、Plin2、Plin3、Plin4和Plin5[2]共5个成员。Plin1和Plin4在白色脂肪细胞和棕色脂肪细胞中表达[3-4];Plin2和Plin3在动物体内普遍表达[5];而Plin5在心脏、肝脏和脂肪等氧化修饰的组织中高度表达[6]。Plin3和Plin4均在脂滴初步合成中发挥作用[7]。目前已知脂肪组织中Plin4缺失没有影响脂肪组织的脂代谢功能[8]。Plin3可快速促进新脂滴的合成,在胞质和脂滴表面之间具有转运功能,并参与调节脂质代谢;使用siRNA敲除Plin3发现,甘油三酯水平降低,脂滴形成受到抑制[9];据报道,Plin3分别参与了肥胖诱导的肝脏和骨骼肌中脂质代谢和胰岛素敏感性的失调[10],如Plin3在肌肉中过表达可增加肌肉细胞中甘油三酯的含量[11],Plin3缺失可降低肌肉细胞中甘油三酯的含量,并抑制脂滴成熟[12];以上研究表明Plin3在甘油三酯稳定储存方面发挥了作用。在心肌细胞中,Plin2和Plin5位于脂滴表面;而在棕色脂肪组织的脂肪细胞中,Plin1和Plin5覆盖在脂滴表面。尽管在上述脂滴均有Plin蛋白表达,但Plin5在调节脂解和脂滴合成中起主导作用。有研究表明,禁食可以诱导Plin5的表达,通过与过氧化物酶体增殖物激活受体α (peroxisome proliferator-activated receptorα,PPARα)相互作用调节脂质代谢;由Plin5缺陷小鼠模型可知,脂肪合成受到抑制,但加快了脂肪酸代谢和线粒体的增殖[13]。Plin5通过结合比较基因识别-58(comparative gene identification-58,CGI-58)抑制脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)活性,从而干扰ATGL介导的脂肪分解代谢的过程[14]。可见,Plin5在脂肪合成代谢中起到重要作用。另外,Laurens等[15]证明Plin5在脂肪分解过程中,可通过促进脂肪酸氧化来满足代谢加快的需求。Plin5敲除小鼠经高脂饮食后,导致轻微的肝功能受损[16],可见Plin5是肝脏稳态的多效性调节因子[15]。此外,研究显示Plin5的缺失可干扰线粒体的功能,从而加剧肥胖小鼠心肌的氧化应激损伤,最终引起小鼠心脏功能的进一步损害[17]。相反,在小鼠心肌细胞中过表达Plin5会大量增加脂滴中三酰基甘油的储存[18]。也有研究表明,Plin5可能调节激素敏感性脂肪酶活性,进而影响肌肉的生长发育[19]。由上可知,Plin3和Plin5在脂代谢调节中发挥直接作用。
河北科技师范学院猪种质资源挖掘课题组前期对长白猪转录组测序[20]鉴定出多个与脂质代谢相关的差异表达基因,如Plin3、Plin5、诱导细胞死亡的DFF45样效应因子B基因(cell death-inducing DFF45-like effector B,CIDEB)和诱导细胞凋亡DFF45样效应因子C基因(cell death-inducing DFF45-like effector C,CIDEC)等。进一步将Cidec转染细胞分析脂滴形态,发现Plin3和Plin5在此过程中表达量差异明显。此外,目前对于Plin3和Plin5在调控长白猪肌肉生长发育方面鲜有研究[21]。鉴于此,本试验通过构建这2个基因表达载体并研究其在长白猪各个组织中的表达规律,探究其在调节脂肪代谢过程中的潜在作用,旨在为鉴定调控猪肌内脂肪细胞生成的关键调节因子提供理论依据。
1 材料与方法
1.1 试验动物
试验所用样品来自河北省秦皇岛市昌黎县肉联厂,选取营养条件相同体重相似的3头6月龄雄性长白猪,3头猪的平均胴体重为79 kg。屠宰采集其心脏、肝脏、脾脏、肺脏、肾脏、胃、皮下脂肪、大肠、小肠、背长肌和膀胱11种组织,包装编号,并迅速置于液氮中。
1.2 主要试剂
TrQuick Reagent、Methylidyne trichloride、异丙醇,河北科技师范学院动物实验室;焦碳酸二乙酸、Goldenview,北京拜尔迪生物科技有限公司;2×Es Taq MasterMix,武汉莫纳生物科技有限公司;反转录试剂盒、qPCR SYBR Green Master Mix,上海翊圣生物科技有限公司;DNA凝胶回收试剂盒、DL2000 DNA Ladder,北京索莱宝生物科技有限公司。
1.3 载体和菌株
pcDNA3.1+载体由河北省秦皇岛市昌黎县河北科技师范学院动物实验室保存,DH5α菌株购自北京索莱宝生物科技有限公司。
1.4 试验方法
1.4.1 引物设计与合成 根据GenBank中收录的猪的Plin3、Plin5基因序列,使用Primer 5.0软件设计引物(表1),并由北京天一辉远生物科技有限公司合成。

表1 PCR引物序列信息Table 1 PCR primer sequence information
1.4.2 总RNA提取和cDNA合成 根据Trizol法[22]提取长白猪11个组织的总RNA,用NanoDrop2000超微量分光光度计(Bio-Rad,美国)检测其RNA浓度和纯度。参照反转录试剂盒说明书对11个组织的总RNA进行反转录。
1.4.3 基因扩增 以1.4.2得到的cDNA为模板进行普通PCR扩增,扩增反应体系为10 μL:H2O 3 μL、2×Taq MasterMix 5 μL、100 ng·μL-1cDNA 1 μL、10 μmol·L-1上游引物0.5 μL、10 μmol·L-1下游引物0.5 μL。扩增程序为:95℃预变性5 min;95℃变性30 s,57℃退火30 s,72℃延伸1 min,35个循环;72℃再延伸5 min,20℃ 终延伸5 min,4℃条件下保存2 h备用。将产物通过1%琼脂糖凝胶电泳检测并用胶回收试剂盒回收PCR片段,随后与PMD®18-T载体连接后转化到DH5α感受态细胞,涂布到含Amp+的LB培养基上,并挑取单克隆菌株进行PCR鉴定,送至生工生物工程(上海)股份有限公司测序。
1.4.4 实时荧光定量PCR检测 根据SYBR Green荧光染料法[23]进行实时荧光定量PCR,反应总体系为20 μL。利用GAPDH为内参基因,按照2-△△Ct算法计算Plin3、Plin5基因在各个组织中的相对表达量。每组试验重复3次,数据以平均值±标准差表示,并利用Graphpad Prim 8软件将表达量进行单因素方差分析,不同小写字母表示存在显著差异(P<0.05)。
1.4.5 生物信息学分析 利用表2的生物信息学分析软件[22-23]对长白猪的Plin3和Plin5进行分析。Plin3的物种类型分别为人(Homosapiens,登录号:NP_001157661.1)、猪(Susscrofa,登录号:NP_001026948.1)、家鼠(Musmusculus,登录号:NP_080112.1)、斑马鱼(Daniorerio,登录号:NP_001373243.1)、家犬(Canislupusfamiliaris,登录号:XP_038284951.1)、家猫(Feliscatus,登录号:XP_023106648.1)、山羊(Caprahircus,登录号:NP_001272524.1)、大猩猩(Gorilla,登录号:XP_018871611.1)、家牛(Bostaurus,登录号:NP_001070514.1)、家马(Equuscaballus,登录号:XP_023500242.1);Plin5的物种类型有人(Homosapiens,登录号:NP_001013728.2)、猪(Susscrofa,登录号:NP_001116607.1)、家鼠(Musmusculus,登录号:NP_001070816.1)、家犬(Canislupusfamiliaris,登录号:XP_038284970.1)、家猫(Feliscatus,登录号:XP_011286089.1)、山羊(Caprahircus,登录号:XP_017906367.1 )、大猩猩(Gorilla,登录号:XP_030862323.1)、家牛(Bostaurus,登录号:NP_001094606.1)、家马(Equuscaballus,登录号:XP_023500224.1)、鳉鱼(Poeciliareticulata,登录号:XP_008405304.1)。

表2 生物信息学软件Table 2 Bioinformatics software
2 结果与分析
2.1 长白猪Plin3、Plin5基因克隆
利用表1设计的特异PCR引物进行PCR克隆,PCR扩增产物经电泳检测后,Plin3基因在约1 400 bp有明亮的扩增条带,Plin5基因在1 357 bp左右有明亮的扩增条带。图1说明PCR扩增产物为单一特异性条带,片段大小与预测片段大小几乎一致,可通过回收DNA片段进行载体转化。
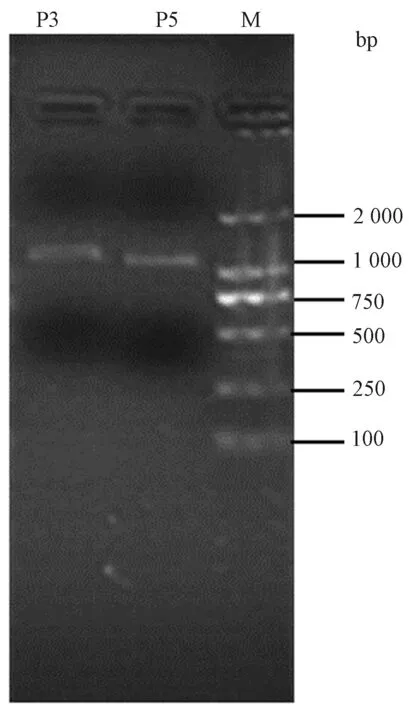
注:P3、P5分别表示Plin3、Plin5的PCR扩增产物;M表示2 000 bp DNA Ladder Marker。Note: P3 and P5 represent the PCR amplification products of Plin3 and Plin5, respectively. M stands for 2 000 bp DNA ladder marker.图1 PCR扩增凝胶电泳检测图Fig.1 Detection of GEL electrophoresis by PCR amplification
2.2 生物信息学分析
2.2.1 与其他物种系统进化树的构建 由图2可知,长白猪Plin3、Plin5氨基酸序列与山羊和家牛的亲缘关系近,Plin3与斑马鱼亲缘关系远;Plin5氨基酸序列与鳉鱼的亲缘关系远。同时,将长白猪Plin3、Plin5与其他物种序列比对分析其同源性可知,Plin3与山羊的同源性最高(89.98%),与斑马鱼的同源性最低(39.60%);Plin5与山羊的同源性也最高(90.17%),与鳉鱼的同源性最低(26.94%)。此结果与进化树的结果一致。

注:A为Plin3系统进化树图;B为Plin5系统进化树图。Note: A is the phylogenetic tree of Plin3 system. B is the phylogenetic tree of Plin5 system.图2 猪Plin3、Plin5系统进化树Fig.2 Phylogenetic tree of pig Plin3 and Plin5
2.2.2 长白猪Plin3、Plin5蛋白质理化性质预测 经克隆得到的Plin3蛋白质分子式是C2067H3354N596O675S17,其分子量为47 899.98 Da,理论等电点为5.60,编码439个氨基酸,编码的氨基酸数量见表3,缬氨酸(V)个数为49,比例最高,为11.2%,不含吡咯赖氨酸和硒半胱氨酸,消光系数是29 575,推测半衰期为30 h,不稳定指数46.22,为不稳定蛋白,脂肪系数为81.91,总平均亲水性为-0.245。Plin5的蛋白质分子式为C2205H3532N654O670S19,其分子量为50 533.42 Da,理论等电点为5.50,编码458个氨基酸,编码氨基酸数量见表4,亮氨酸(L)个数为59,比例最高,为12.9%,不含吡咯赖氨酸和硒半胱氨酸,消光系数是48 970,推测半衰期为30 h,不稳定指数57.69,为不稳定蛋白,脂肪系数为87.77,总平均亲水性为-0.382。

表3 Plin3编码的蛋白质氨基酸组成Table 3 Amino acid composition of proteins encoded by Plin3
2.2.3 蛋白质二级结构和三级结构 经预测长白猪Plin3二级结构见图3-A,其中无规则卷曲占21.13%、延伸链占3.19%、α-螺旋占74.03%、β-转角占1.59%;Plin5二级结构见图3-B,其中无规卷曲占26.64%、延伸链占2.84%、α-螺旋占68.12%、β-转角占2.40%。Plin3蛋白质三级结构建模预测如图3-C所示,全面模型评估值是0.41,序列相似性为0.52,模型构建符合要求,该三级结构显示其存在多个α-螺旋结构;Plin5蛋白三级结构建模预测如图3-D所示,全面模型评估值是0.38,序列相似性为0.40,模型构建符合要求,该三级结构显示其存在多个α-螺旋结构。用STRING数据库预测与Plin3相互作用的蛋白(图3-E),结果显示,Plin3可能与M6PR、PNPLA2和ABHD5等蛋白存在相互作用。用STRING数据库搜索与Plin5蛋白可能相互作用的蛋白(图3-F),结果显示Plin5可能与ABHD5、PNPLA2和PNPLA3等蛋白存在相互作用。

表4 Plin5编码的蛋白质氨基酸组成Table 4 Amino acid composition of protein encoded by Plin5

注:A:Plin3蛋白质二级结构,h为α-螺旋,e为延伸链,t为β-转角,c为无规则卷曲;B:Plin5蛋白质二级结构;C:Plin3蛋白质三级结构;D:Plin5蛋白质三级结构;E:Plin3相互作用蛋白预测;F:Plin5相互作用蛋白预测。Note: A: The secondary structure of Plin3 protein. h is α -helix. e is extended chain. t is β-turn angle. c is random crimp. B: The secondary structure of Plin5 protein. C: The tertiary structure of Plin3 protein. D: The tertiary structure of Plin5 protein. E: The prediction of Plin3 interacting protein. F:The predicted of Plin5 interacting protein. 图3 长白猪Plin3、Plin5蛋白结构预测Fig.3 Protein structure prediction of Plin3 and Plin5 in landraces
2.2.4 蛋白质疏水性、信号肽及跨膜区分析 由图4-A可知,Plin3整条氨基酸链在第423位氨基酸处有最大疏水值1.756,第268位氨基酸处有最小疏水值 -2.789, 总平均疏水性为-0.339,可以看出Plin3靠近N端前端表现出较强的亲水区域(score>1),中端靠近C端位置表现出较强的疏水性。由图4-B可知,Plin5整条氨基酸链在383位点有最大疏水值1.967,在193位点有最小疏水值-3.133,总平均疏水性为-0.380,Plin5靠近N端位置表现出较强的疏水性,靠近C端位置存在较强的亲水性。同时对Plin3、Plin5蛋白的信号肽及跨膜区域结构进行预测分析可知,两个蛋白均无信号肽、无跨膜区域结构。
注:A:Plin3蛋白疏水性分析;B:Plin5蛋白疏水性分析。Note: A: The hydrophobicity analysis of Plin3 protein. B: The hydrophobicity analysis of Plin5 protein.图4 长白猪Plin3、Plin5蛋白疏水性Fig.4 Hydrophobicity of Plin3 and Plin5 proteins in landraces
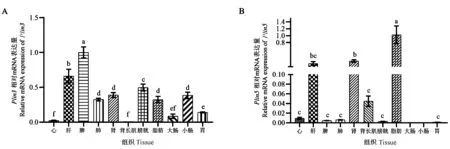
注:不同小写字母表示不同组织之间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between tissues at 0.05 level.图5 长白猪Plin3、Plin5基因在不同组织中的表达量Fig.5 Expression of Plin3 and Plin5 genes in different tissues of landraces
2.2.5 蛋白质磷酸化位点预测 预测结果显示长白猪Plin3共有53个磷酸化位点,其中丝氨酸上有30个磷酸化位点,苏氨酸上有21个磷酸化位点,酪氨酸上有2个磷酸化位点;Plin5共有25个磷酸化位点,丝氨酸上有18个磷酸化位点,苏氨酸上有6个磷酸化位点,酪氨酸上有1个磷酸化位点。之后,对Plin3、Plin5进行糖基化位点预测,两个蛋白均无N端糖基化位点;Plin3含有23个O端糖基化位点,Plin5含有10个O端糖基化位点。
2.3 长白猪Plin3、Plin5基因的组织表达谱
由图5-A可知,Plin3在长白猪的各个组织中均有表达,在脾中的相对表达量显著高于在其他10种组织中,其次是肝、膀胱、肾、小肠、肺、脂肪,在背长肌中的相对表达量最低。由图5-B可知,Plin5在脂肪组织中的相对表达量显著高于在其他组织,其次是肾、肝、背长肌、心、肺、脾、膀胱、胃,在大肠和小肠中几乎不表达,且在肾脏中的相对表达量除了与肝中的相对表达量差异不显著以外,与其他组织中的相对表达量均有显著差异。
3 讨论
本研究成功克隆了Plin3、Plin5基因全长序列,其中Plin3序列全长1 403 bp,编码439个氨基酸,Plin5序列全长1 397 bp, 编码458个氨基酸,与Genbank数据库中猪的Plin3、Plin5序列一致。2个基因在多个物种中均有表达,其中在小鼠和山羊中Plin3均编码437个氨基酸[24-25];Plin5在人和鼠物种上编码463个氨基酸[26],在不同物种中2个基因编码的氨基酸数量差异不大,证明2个基因的遗传距离较近。对两者氨基酸序列分析发现,Plin3和Plin5氨基酸序列与山羊和家牛的氨基酸序列同源性较高,进化树分析显示与山羊和家牛的亲缘关系也较近,推测2个蛋白质的保守性较强,此结果与郝娟等[25]在西农萨能羊和焦迪等[26]在陆川猪中的研究结果一致。
动物体内脂肪沉积的形成主要受脂质代谢平衡的影响,脂滴在脂代谢平衡中起重要作用。PAT蛋白是覆盖在脂滴表面的结构蛋白,包含两亲性螺旋结构[27],这些结构特征使其与其他蛋白质能够紧密结合。本研究预测Plin3、Plin5蛋白质结构发现,这两种蛋白质二级结构主要由α-螺旋组成,与其三级结构预测结果一致。进一步预测发现这两种蛋白质含有大量的疏水性残基,可紧密结合在脂滴表面。本研究还发现两种蛋白无信号肽、无跨膜结构和N端糖基化位点,但经预测其有多个磷酸化位点和O端糖基化位点。研究表明,腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)可诱导Plin3的S31和T216位点磷酸化,促进脂滴分解[28];儿茶酚胺可使Plin5的S140和S155位点磷酸化,增强脂肪分解[29]。同时,本研究预测Plin3和Plin5均与甘油三脂水解酶(patatin like phospholipase domain containing 2,PNPLA2)和含自水解酶域蛋白5(α/β-hydrolase domain containing 5,ABHD5)相互作用,Karczewska等[30]已证实PAT家族蛋白确与PNPLA2和 ABHD5相互作用。因此推测,Plin3和Plin5蛋白可通过蛋白互作形式调控脂质代谢,但在长白猪中如何发挥作用仍不清楚,因此本研究进一步分别探究了Plin3和Plin5基因在长白猪体内的表达情况。
本研究采用实时荧光定量PCR技术检测Plin3和Plin5在长白猪11个组织中的表达情况,其中Plin3在肝脏和脾脏中的相对表达量较高,而郝娟等[25]发现西农萨能羊Plin3在乳腺中的表达量最高,但该基因在这2个物种肌肉组织中的表达量均较低,表明Plin3的表达具有物种特异性。Plin5在长白猪的脂肪组织中表达量最高,其次是肾脏、肝脏,而焦迪[31]研究发现Plin5在陆川猪和杜洛克猪的肝脏中表达量最高,表明Plin5在相同物种不同猪品种之间的表达有一定差异,且以上组织的耗氧量均较高,由此推测Plin5与能量代谢相关。在Plin5的功能研究中,王天宇[32]研究发现在小鼠体内过表达Plin5时,解偶联蛋白1(uncoupling protein1,UCP1)含量增高,促进了白色脂肪棕色化,这表明Plin5参与调节脂肪组织的脂质代谢;在高脂饮食的小鼠模型中,Ma等[33]发现钙调素(calmodulin,CaM)缺失抑制Plin5蛋白分解,从而阻碍了肝细胞脂肪分解,导致非酒精性脂肪肝形成;Anastasia等[34]发现在高脂饮食下,Plin5缺失的小鼠,抑制NLR家族含嘧啶结构域3(NOD-like receptor protein 3,NLRP3)的激活,导致轻微的肝脏损伤;Kuramoto等[35]研究发现Plin5在心脏中也有重要功能,通过保护脂滴减少线粒体中脂肪酸的氧化来抑制过量的活性氧产生。综上,Plin3在大多数的组织中广泛表达,在调控脂肪分解代谢和肝脏脂肪变性的过程中起到重要作用;Plin5主要在氧化组织中表达,在脂质的储存方面起重要作用。综合以上结果可知,这两个蛋白质在脂代谢过程中发挥的特定作用取决于其所在的位置。但目前鲜见这两种基因在长白猪生长发育中分子机制的相关报道。因此,本研究可为两种基因在长白猪脂质代谢机制研究中提供一定的理论依据。
4 结论
本研究首次克隆了长白猪Plin3、Plin5基因的全长序列,其序列长度分别为1 403、1 397 bp。两个蛋白质的二级结构均以α-螺旋为主,且蛋白保守性强。Plin3在长白猪的脾脏和肝脏中相对表达量显著高于其他组织中的相对表达量,肌肉中相对表达量最低;Plin5在长白猪脂肪组织中的相对表达量最高,在大肠和小肠内不表达,肝脏组织和脂肪组织是对能量代谢活跃的器官。因此推测,Plin3、Plin5基因在脂质能量代谢方面发挥作用。
