铜胺氧化酶基因PpCuAO4在桃成熟中的功能鉴定
2022-09-21崔振国蒋亚博张郎郎冯建灿
王 伟 程 鑫 崔振国 蒋亚博 谭 彬 程 钧 张郎郎 冯建灿
(河南农业大学园艺学院/河南省果树瓜类生物学重点实验室,河南 郑州 450002)
桃(PrunuspersicaL.)果实味道鲜美,营养丰富,是一种深受人们喜爱的大众水果。然而,桃作为一种典型的呼吸跃变型果实,成熟后不耐贮藏,严重制约了其产业发展。乙烯是调控桃果实成熟衰老的关键植物激素[1]。研究表明,多胺(polyamine)作为一种乙烯作用拮抗剂,能够延缓桃果实成熟衰老,是一种具有潜力的天然果实贮藏保鲜剂[2]。
多胺是一种小分子脂肪族含氮碱,广泛存在于自然界各种有机生物体内,包括动物、植物、细菌和真菌等[3]。多胺在植物发育过程中起着至关重要的作用,能够参与花的分化和发育、叶片发育和衰老、果实发育和成熟、非生物胁迫和生物胁迫应答等众多生理生化过程[3]。植物体内最常见的3种多胺分别是腐胺(putrescine,Put)、亚精胺(spermidine,Spd)和精胺(spermine,Spm)[4]。植物多胺的合成起始于Put的合成。植物中Put生物合成主要由精氨酸脱羧酶(arginine decarboxylase,ADC)催化完成[5]。Put合成后作为前体物质在Spd合成酶(spermidine synthase,SPDS)和硫腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxylase,SAMDC)的催化下生成Spd。Spd则进一步在Spm合成酶(spermine synthase,SPMS)和SAMDC的催化下生成Spm[6]。此外,多胺合成代谢路径与一些其他重要物质代谢路径相互联系,构成复杂的代谢网络。例如,多胺合成与乙烯合成具有相同的前体物质腺苷甲硫氨酸(S-adenosylmeth-onine),目前已有许多研究表明增加其中任意一种物质的合成都会影响另外一种物质的合成,但这一观点还存在争议[7]。植物体内多胺的氧化分解主要由铜胺氧化酶(copper amine oxidase, CuAO)和多胺氧化酶(polyamine oxidase, PAO)参与完成。CuAO主要催化Put的氧化反应,同时产生氨(NH4+)、4-氨基丁醛(4-aminobutyrate)及过氧化氢(hydrogen peroxide, H2O2)等分解产物;4-氨基丁醛进一步转化为γ-氨基丁酸(γ-aminobutyric acid,GABA)[8]。有研究发现在拟南芥中,CuAO同样参与Spd的分解代谢[9]。PAO主要参与催化Spd、Spm及其乙酰化衍生物的分解代谢。根据功能可将PAO分为两类:第一类参与多胺末端分解反应,分解Spd和Spm并产生二氨基丙烷(diaminopropane,Dap)和H2O2等分解产物[4];第二类参与回复反应,即催化Spm到Spd以及Spd到Put的反应,同时产生H2O2等产物[10]。
有研究报道,在桃果实发育早期和成熟前,采用多胺处理均可延缓桃果实成熟[11-12]。汪开拓等[2]研究发现,采用Spd处理采收后的白凤水蜜桃可以显著降低桃果实贮藏期间腐烂率,并且可以促进多胺合成基因PpSAMDC、PpSPDS、PpADC等上调表达,同时抑制乙烯合成关键基因PpACS1、PpACO1表达水平,减少乙烯合成,延缓桃果实成熟衰老。此外,刘新婷等[13]发现Spd处理可有效延缓番木瓜果实软化,显著降低果实呼吸速率并延缓果实色泽的转变。除了外源多胺处理,研究发现利用基因工程在番茄中超量表达桃PpADC基因能够促进转基因植株Put积累,抑制赤霉素合成,最终导致植株生长矮化,开花和结果延迟[14]。另一方面,通过抑制内源多胺分解,同样可以延缓果实成熟。有研究发现采用PAO抑制剂处理可以显著延缓葡萄和桃果实成熟[11,15-16]。
在果实发育前期,多胺含量一般较高,随着果实的发育和成熟,多胺含量逐渐降低,并且该现象在呼吸跃变型和呼吸非跃变型果实中普遍存在[17-18]。研究发现,在富士苹果花后30~80 d,Put和Spm含量均呈现下降趋势[18]。番茄中的研究发现在果实快速发育阶段多胺合成基因SPMS和分解基因CuAO表达水平均显著升高,并且CuAO基因从破色期到成熟期均维持高表达水平,而SPDS1基因表达量在果实完熟期达到高峰[19]。进一步研究发现,与SlSPMS、SlADC和SlODC在成熟期的较低表达水平相比,SlSPDS2在番茄果实成熟中可能发挥主要作用[20]。前期研究发现,黄水蜜桃中Put、Spd和Spm含量均随着果实成熟逐渐降低,与此同时多胺合成关键基因PpADC、PpSPDS和多胺氧化酶基因PpPAO1表达水平均显著升高,PpPAO1介导的Spd和Spm的氧化分解直接导致多胺积累降低[11]。研究报道多胺分解产生的H2O2是一种信号分子,能够诱导果实成熟和逆境应答[21]。河南农业大学桃生物学与种质创新团队前期研究发现桃中有4个CuAO基因,分别是PpCuAO1~PpCuAO4,其中PpCuAO4介导的Put分解是导致桃果实发育和成熟过程中多胺积累降低的重要原因[22]。然而,CuAO介导的多胺分解在桃果实成熟中的作用,尤其是PpCuAO4在桃果实成熟中的功能仍然不清楚。基于此,本研究采用CuAO抑制剂处理验证CuAO介导的多胺分解在桃果实成熟过程中的作用,同时利用病毒诱导的基因沉默技术(virus induced gene silence,VIGS)分析PpCuAO4在桃果实成熟中的功能,旨在为进一步深入研究多胺调控桃果实成熟的机制提供重要的理论依据。
1 材料与方法
1.1 材料与试剂
供试材料选择种植在郑州市惠济区河南农业大学科教园区的7年生黄水蜜桃,采用独立主干树形,株行距为1.5 m×3.5 m,常规田间管理。黄水蜜桃为软溶质桃,成熟期在7月初,成熟后迅速出现呼吸高峰和乙烯释放高峰,果肉迅速软化。
1.2 试验方法
1.2.1 CuAO抑制剂处理 选取树龄大小一致和果实负载量适中的黄水蜜桃树,每株树从东、南、西、北4个方向随机选择4个枝条,选取生长状态及成熟度一致(均处于果实第二次膨大期)的桃果实各100个,在花后90 d分别用含0.1% Tween 20的1.0、5.0和10.0 mmol·L-1CuAO抑制剂氨基胍(aminoguanidine,AG)对桃果实进行喷施处理,每7 d喷施1次,连续喷施2次,同时采用含 0.1% Tween 20的清水处理作为对照。在桃果实成熟后采摘处理果实,于25℃黑暗条件贮藏,于采收后第0、第3 和第7天测定果实硬度。
1.2.2 VIGS沉默桃果实PpCuAO4基因 利用PCR扩增PpCuAO4基因cDNA非保守区序列,片段大小为325 bp,引物序列见表1。利用同源重组方法将所扩增片段插入到pTRV2载体中,构建完成重组质粒,并转化根癌农杆菌GV3101菌株。VIGS诱导桃果实基因沉默方法参考文献[23],具体方法如下:分别将含有重组质粒和pTRV2空载质粒的农杆菌GV3101菌液,以及含有pTRV1载体的GV3101菌液按体积比1∶1等量混合后,选取花后90 d的黄水蜜桃果实进行接种,利用注射法接种到果实靠近果柄的果肉中,每个果实均选取2处注射,每个混合菌液各注射50个发育状态一致的果实,注射10 d后采样。设置3次独立的生物学重复。

表1 基因克隆及定量分析所用引物序列Table 1 Primers used for gene cloning and qRT-PCR
1.2.3 基因表达分析 以注射针孔所在位置为中心,用手术刀切取半径约1 cm的侵染区域果实,用于检测PpCuAO4沉默效率。采用已接种pTRV1、pTRV2和未接种的果实为对照。桃果实总RNA提取参见上海生工柱式植物总RNA提取试剂盒(Spin Column Plant total RNA Purification Kit)说明。总RNA浓度及纯度采用Nanodrop 2000分光光度计(Thermo Scientific, 美国)检测,然后通过琼脂糖凝胶电泳确定RNA完整性。cDNA合成采用RNA反转录试剂盒(TaKaRa PrimeScriptTM RT reagent Kit,日本)。反转录的cDNA于-80℃保存备用。利用实时荧光定量技术(quantitative real-time PCR,qRT-PCR)检测PpCuO4及果实成熟相关基因PpACO1、PpACS、PpPIN1、PpGH3.3、PpPG和PpPMEI的表达。所用定量引物序列见表1,以PpEF2作为内参基因。基因表达分析采用ABI 7500Fast系统(Applied Biosystems,美国),运行程序采用95℃预变性5 min,95℃变性30 s,95℃退火3 s,60℃延伸30 s,40个循环,产物于12℃条件下保存。基因表达量分析采用2-△△Ct法计算。
1.2.4 桃果实多胺测定 采用乙腈浸提法提取多胺,具体方法如下:取2 g桃果肉于液氮中研磨至粉末,称取0.5 g粉末,加入2 mL 20%乙腈,于冰水浴中超声提取30 min;随后于4℃、10 000×g条件下离心3 min,取上清液,沉淀加入2 mL 20%乙腈再浸提1次;加入乙腈定容至5 mL;4℃、10 000×g条件下离心3 min,取上清液1 mL,采用0.22 μm有机相滤膜过滤,使用po-roshell 120 SB-C18反相色谱柱(Agilent,美国)上机检测。利用液相质谱(liquid chromatography-electrospray mass spectrometry,HPLC-MS)检测,流动相A为90%乙腈,流动相B为0.1%甲酸,流速设定为0.3 mL·min-1, 梯度洗脱。自由态多胺含量检测采用安捷伦1260串联6420A高效液相质谱(Agilent,美国)联用法,由南京钟鼎生物技术有限公司完成。
1.2.5 桃果实成熟相关生理指标测定 果实硬度测定:采用GY-4型压力测试仪(托普仪器,杭州)测定。
呼吸强度测定:将待测桃果实放入装有橡皮塞的密封盒子,于室温条件下密闭1 h后采用OXYBABY 6.0 O2/CO2顶空分析仪(WITT,德国)测定。
乙烯释放速率测定:将桃果实放入气密性良好的密封盒子中测量乙烯产量,并在室温条件下放置1 h,然后取1 000 μL气体样品并注入填充GC 2010 Plus气相色谱仪(Shimadzu, 日本)分析;检测器为氢火焰检测器,色谱柱为GDX-502型填充色谱柱;进样口温度110℃,色谱柱温度60℃,检测器温度150℃;载气为氮气,载气流速为40 mL·min-1。每个处理重复3次。
1.2.6 数据统计与分析 试验数据采用Excel 2016和SPSS 17.0进行处理及差异显著性分析,差异显著性分析检验方法为t检验,P<0.05。所用误差均为标准差(standard deviation, SD)。基因表达分析和果实生理指标测定均不少于3次生物学重复。使用SigmaPlot 12.5进行作图分析。
2 结果与分析
2.1 AG处理延缓桃果实成熟
为了探究CuAO介导的多胺氧化分解在桃果实成熟中的功能,分别采用1、5和10 mmol·L-13种不同浓度的AG处理黄水蜜桃果实。结果显示,采用5和10 mmol·L-1AG处理果实的硬度在采后第3和第7天不同程度地显著高于对照水平,并且5 mmol·L-1AG处理的效果更显著(P<0.001),而1 mmol·L-1AG处理的桃果实硬度与对照相比均无显著差异(图1)。说明AG处理可延缓黄水蜜桃果实软化,且 5 mmol·L-1AG处理效果最好,因此后续试验采用5 mmol·L-1AG处理。
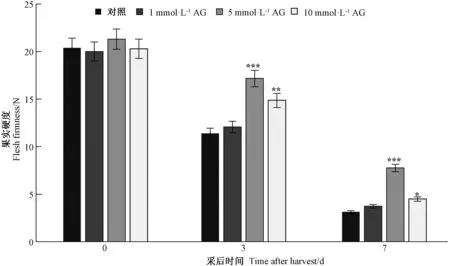
注:*、**、***分别表示与对照相比在0.05、0.01、0.001水平上差异显著。下同。Note: *, **, *** indicate significant differences between the AG treatment and control fruits a 0.05, 0.01, 0.001 level, respectively. The same as following.图1 不同浓度AG处理黄水蜜桃果实硬度测定Fig.1 The fruit firmness of Huangshuimi peach under the treatment of different concentrations of AG
由图2-A可知,与对照相比,5 mmol·L-1AG处理后黄水蜜桃果实着色明显延缓。同时发现桃果实硬度在采后7 d内呈明显下降趋势,但AG处理下桃果实硬度在处理第2、第3和第5天仍显著高于对照水平(图2-B)。乙烯释放量测定显示,桃果实采后乙烯释放量迅速上升,并在第3天达到高峰,随后逐渐下降,AG处理下果实乙烯释放量在前4 d及第7天依然显著低于对照组(图2-C)。果实呼吸强度结果显示,对照组果实呼吸强度在处理第2天略有上升,随后逐渐下降,而AG处理组桃果实呼吸强度整体呈现逐渐下降趋势,并且在处理第2至第4天显著低于对照水平(图2-D)。综上所述,5 mmol·L-1AG处理可显著延缓桃果实软化速度,降低乙烯释放量和呼吸速率,从而延缓桃果实成熟。
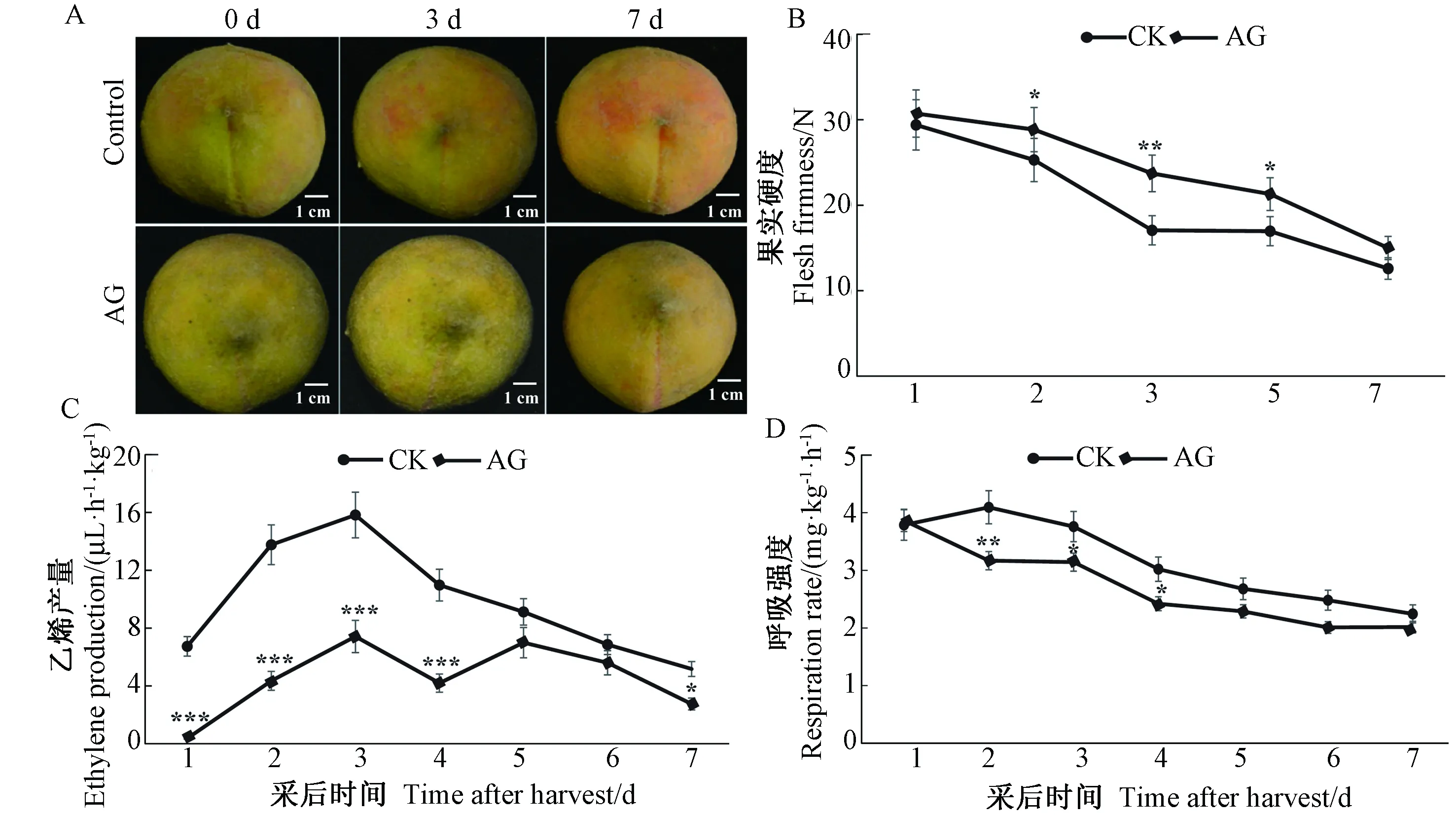
图2 5 mmol·L-1AG处理黄水蜜桃果实表型及成熟相关生理数据Fig.2 The phenotype and fruit quality traits of Huangshuimi peach under the treatment of 5 mmol·L-1 AG
2.2 AG处理抑制桃果实成熟相关基因表达
为了进一步解析CuAO抑制剂处理延缓桃果实成熟软化的分子机理,采用qRT-PCR技术分析AG处理后桃果实乙烯合成、生长素转运和细胞壁降解相关基因表达水平。结果显示,AG处理后桃乙烯合成关键基因PpACO1和PpACS的相对表达水平在采后第3和第5天均显著低于对照(图3-A、B)。同时,生长素转运和调节相关基因PpPIN1、PpGH3.3以及细胞壁降解相关基因PpPG、PpPMEI的相对表达水平均显著低于对照(图3-C~F)。上述结果表明,AG处理可以抑制乙烯合成、生长素转运和细胞壁降解相关基因表达,从而抑制乙烯合成、生长素转运和细胞壁降解,延缓桃果实成熟软化。
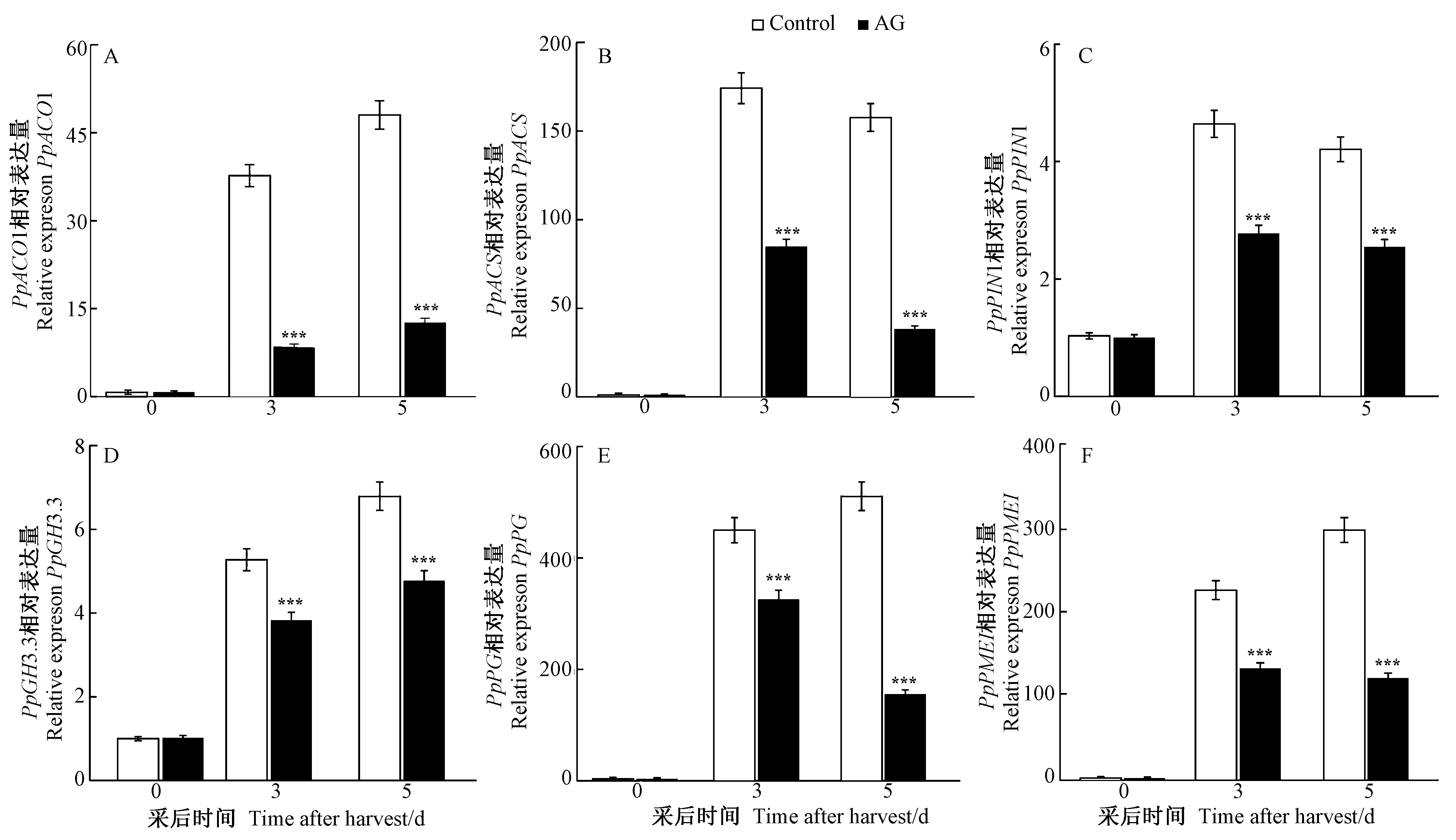
图3 5 mmol·L-1 AG处理黄水蜜桃果实乙烯合成和细胞壁降解相关基因表达分析Fig.3 The expression of ethylene synthesis and cell wall-degrading related genes of Huangshuimi peach under the treatment of 5 mmol·L-1 AG
2.3 沉默PpCuAO4基因延缓桃果实成熟
为进一步验证PpCuAO介导的多胺分解在桃果实成熟中的功能,采用VIGS技术沉默桃果实PpCuAO4基因,并分析果实成熟相关生理指标。结果显示,与注射TRV2空载质粒的对照果实相比,转基因桃果实注射部位呈现浅绿色,而对照果实注射部位着色与未注射部位无明显差异(图4-A)。基因表达分析显示,转基因桃果实PpCuAO4的相对表达水平仅为对照的18%(图4-B)。多胺含量测定发现,转基因果实Put含量显著高于对照组,而Spd和Spm含量略高于对照,但无显著差异(图4-C),说明沉默PpCuAO4后桃果实Put分解被显著抑制,积累增加。桃果实硬度测定显示,虽然对照和转基因桃果实采后硬度呈明显下降趋势,但转基因果实硬度在第1、第2、第3和第5天均显著高于对照组(图4-D)。转基因和对照果实在采后7天内乙烯释放量均呈现先升高后降低的趋势,其中在采后第1天达到高峰,随后逐渐下降,但转基因果实乙烯释放量均低于对照水平,尤其是在采后第1天和第2天差异达到显著水平(图4-E)。呼吸强度测定结果与乙烯释放量类似,转基因和对照桃果实呼吸强度同样呈先升高后降低的趋势,在采后第1天达到呼吸高峰,随后逐渐降低,但转基因桃果实呼吸强度始终低于对照水平,尤其是在采后第2 d转基因桃果实呼吸强度显著低于对照水平(图4-F)。上述试验结果充分说明,沉默PpCuAO4基因可显著抑制Put分解,降低果实软化速度,同时降低乙烯释放量和呼吸强度,从而延缓桃果实成熟。

注:A:沉默PpCuAO4基因桃果实表型观察,TRV2为空载对照;B:转基因桃果实PpCuAO4表达分析;C:转基因桃果实自由态多胺含量测定;D~F:分别为转基因桃果实硬度、乙烯释放量和呼吸强度测定。 Note: A: Phenotype of PpCuAO4-silenced peach fruit. TRV2 means empty vector. B: Expression level of PpCuAO4 in PpCuAO4-silenced and control peach fruits. C: Free polyamine concentration of PpCuAO4-silenced peach fruit. D~F: The firmness, ethylene release and respiration rate of PpCuAO4-silenced peach fruit, respectively.图4 VIGS沉默PpCuAO4桃果实表型观察及生理数据测定Fig.4 The phenotype and detection of fruit quality traits of PpCuAO4-silenced peach fruit
3 讨论
现有研究表明外源Spd和Spm处理可以延缓桃和葡萄果实成熟衰老[11-12,15],但会促进草莓果实成熟[24],而采用PAO抑制剂处理同样可以促进草莓果实着色和成熟[25-26],由此可见多胺对果实成熟的调控作用十分复杂,在不同类型果实可能发挥不同作用。本研究结果表明,采用CuAO抑制剂AG处理能够延缓桃果实成熟软化,且呈现一定的浓度梯度效应。为进一步解析CuAO介导的多胺分解影响桃果实成熟的分子机理,本研究分析了AG处理后黄水蜜桃果实乙烯合成、生长素转运及细胞壁降解相关基因表达水平,结果表明AG处理可显著抑制乙烯合成、生长素转运及细胞壁软化相关基因表达水平。然而,PpCuAO4在桃果实成熟中的功能尚不明晰。由于桃目前尚无稳定的遗传转化体系,本研究采用VIGS技术瞬时沉默了桃果实PpCuAO4基因,结果表明敲除PpCuAO4基因后Put积累显著增加,且采后转基因桃果实软化速度明显延缓,乙烯释放和呼吸作用均得到显著抑制。VIGS结果充分说明,PpCuAO4基因能够通过促进Put分解,从而正调控桃果实成熟。
随着对多胺调控果实成熟功能研究的不断深入,多胺在果实采后贮藏保鲜中的应用也受到广泛关注。其中,采用Put和Spd处理可以显著改善葡萄贮藏品质[27],并且可以通过抑制果实的呼吸作用和增加细胞膜透性,延缓果实硬度、可滴定酸、可溶性固形物和抗坏血酸含量的下降,从而保持无核白葡萄贮藏品质[28];陈志远等[29-30]发现Spm可以改善蓝莓果实贮藏品质,延长贮藏时间。上述研究结果表明,多胺不仅能够影响果实成熟,而且能够延缓采后果实衰老和品质劣变,减少病害发生,从而改善贮藏品质,延长货架期。然而,这些报道均通过施用外源多胺来达到增加多胺积累、延缓成熟衰老的目的,而通过减少果实多胺分解是否能够达到同样的效果尚不清楚。本研究通过外源CuAO抑制剂和敲除Put分解关键基因PpCuAO4基因均实现了增加Put积累和延缓桃果实成熟的目的,说明CuAO在果实成熟发挥重要作用,并且通过抑制CuAO介导的多胺分解同样可以延缓果实成熟,延长货架期。
与此同时,天然多胺提取复杂,且含量较低,而人工合成的多胺使用成本较高,严重制约了其在生产过程中的应用[31]。本研究探究了CuAO抑制剂AG处理在延缓桃果实成熟软化中的效果,结果表明AG处理具有较好的贮藏保鲜效果。同时,AG使用成本低,便于大范围使用,具有作为果实贮藏保鲜剂使用的潜力。随着CRISPR/Cas9技术的发展,利用基因工程技术培育高品质、耐贮运的水果新品种正在成为一种趋势。因此,进一步挖掘多胺调控果实成熟衰老的关键基因可为未来作物遗传改良提供重要的基因资源。
4 结论
本研究采用外源CuAO抑制剂AG处理证实了CuAO介导的多胺分解能够促进桃果实成熟,并利用VIGS技术进一步证明了PpCuAO4基因可以通过促进Put分解加速桃果实成熟,表明CuAO抑制剂AG具有作为一种桃果实贮藏保鲜剂的应用潜力,同时PpCuAO4可以作为利用生物技术培育耐贮运桃新品种的重要基因资源。
