亚洲棉NCED3基因克隆及其抗旱功能分析
2022-09-21王海涛李兴河甄军波刘琳琳迟吉娜张建宏
蔡 肖 王海涛 李兴河 甄军波 刘琳琳 刘 迪 迟吉娜 张建宏
(河北省农林科学院棉花研究所/农业农村部黄淮海半干旱棉花生物学与遗传育种重点实验室/国家棉花改良中心河北分中心,河北 石家庄 050051)
棉花(Gossypiumarboreum)是我国重要的经济作物之一。在全国水资源形势异常严峻的情况下,提高棉花的耐旱能力,利用好我国广大的干旱、半干旱土地,对保持棉花产业可持续发展、保障我国粮食安全具有重要意义[1]。植物抗旱反应涉及多种抗旱机制和信号传导途径,分子机理复杂[2]。研究表明,一些编码保护蛋白的基因(渗透调节和氧化还原相关酶、转运蛋白等)、干旱响应信号分子[钙离子信号、脱落酸(abscisic acid, ABA)信号和蛋白激酶等]和干旱相关转录因子[MYB(V-myb avian myelobastosis viral oncogene homolog)、WRKY、NAC(NAM、ATAF and Cuc)、亮氨酸拉链(basic leucine zipper, bZIP)和乙烯响应因子(ethylene-responsive factor, ERF)等]等通过信号感知、生理反应和逆境相关基因响应及表达调控等一系列细胞和分子信号调节防御机制来提高植物的耐旱能力[3-5]。虽然棉花抗旱相关基因挖掘研究已取得了一定进展[6-8],但基因数量仍非常有限,因此深入挖掘干旱相关功能基因,并解析其作用机制,对于创制棉花抗旱种质资源具有重要意义。
9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxy carotenoid dioxygenase,NCED)是ABA合成过程中的关键限速酶,被证实广泛参与植物生长发育进程及对非生物胁迫的应答[9-11]。植物中NCED基因多以基因家族的形式存在。拟南芥(Arabidopsisthaliana)中共鉴定出5个NCED基因(NCED2、NCED3、NCED5、NCED6和NCED9)[12-13]。随后许多高等植物如水稻(Oryzasativa)[14]、烟草(Nicotianatabacum)[15]、番茄(Solanumlycopersicum)[16]、谷子(Setariaitalica)[17]、苹果(Malusdomestica)[18]、草莓(Fragariavesca)[19]、葡萄(Vitisvinifera)[20]、甘蔗(Saccharum)[21]和毛竹(Phyllostachysedulis)[22]等的NCED基因也受到了研究者们的关注。研究表明,多种植物NCED基因的表达均受干旱胁迫的诱导[23-25]。过表达AtNCED3的拟南芥通过增加植株内源ABA水平提高对干旱胁迫的抗性[26]。过表达AtNCED3基因的水稻表现出对干旱胁迫的耐受性增强[27]。水稻nced3突变体对盐和干旱胁迫敏感,而OsNCED3超表达则提高了对盐和干旱胁迫的耐受力[28],OsNCED4和OsNCED5基因也被证实可以调节干旱胁迫下水稻ABA水平和抗逆性[29-31]。由此可见,NCEDs基因对逆境响应起着重要的调节作用,在植物抗旱性改良方面具有重要研究价值。
目前棉花中NCED基因相关研究相对较少。刘江娜等[32]克隆了1个陆地棉(G.hirsutum)GhNCED基因,发现干旱胁迫能强烈诱导该基因表达。喻娟等[33]将陆地棉GhNCED2基因转入烟草,发现干旱、盐和低温逆境能诱导转基因烟草GhNCED2基因大量表达。由于棉花NCED基因包含多个家族成员,系统了解每个成员的结构和表达特征,可以为深入挖掘干旱相关NCED基因提供理论依据。本研究前期对棉花类胡萝卜素裂解加氧酶(carotenoid cleavage oxygenase,CCO)基因家族进行鉴定分析,将棉花CCO基因家族分为CCD和NCED亚家族,分别鉴定出8个CCD成员(CCD1、CCD4a、CCD4b、CCD7、CCD8a、CCD8b、CCD-likea和CCD-likeb)和7个NCED成员(NCED3a、NCED3b、NCED3c、NCED5a、NCED5b、NCED5c和NCED6)[34]。结合二倍体亚洲棉干旱转录组测序分析,发现1个干旱胁迫后显著上调表达的NCED基因GaNCED3a(ID:Cotton_A_27981)。本研究在上述结果的基础上,克隆亚洲棉干旱响应基因GaNCED3,并通过实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)验证该基因的表达特征,通过转化拟南芥进行抗旱功能验证,以期初步明确GaNCED3在干旱响应中的功能,对于阐释棉花NCED基因的抗旱作用机制,利用基因工程手段改良棉花抗旱性具有重要意义。
1 材料与方法
1.1 试验材料
供试棉花材料为亚洲棉(G.arboreum)石系亚1号(Shixiya-1),遗传转化受体为拟南芥哥伦比亚生态型(Col-0),均由本研究室(河北省农林科学院棉花研究所分子育种研究室)保存。
本试验引物由苏州金唯智生物科技有限公司合成,总RNA提取采用LS1040Eastep®Super总RNA提取试剂盒(Promega,北京),反转录cDNA使用RR047A PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect real time)试剂盒(TaKaRa,北京),qRT-PCR采用RR820Q TB GreenTMPremix Ex TaqTMII (Tli RNaseH Plus)试剂盒(TaKaRa,北京),DNA聚合酶采用RR02 MALATag酶(TaKaRa,北京),DNA连接酶和限制性内切酶购自天根生化科技(北京)有限公司。农杆菌(Agrobacterium)GV3101由本研究室保存。丙二醛(malondialdehyde, MDA)含量和游离脯氨酸含量测定按照苏州科铭生物技术有限公司的丙二醛试剂盒(MDA-1-Y)和脯氨酸含量试剂盒(PRO-1-Y)说明书进行。
1.2 试验方法
1.2.1 亚洲棉种植及干旱处理 选取籽粒饱满的石系亚1号种子,NaClO3溶液灭菌2 min,无菌水漂洗3次,接种于无菌的1/2 MS培养基上,一周后取子叶、胚轴和胚根,并将生长一致的棉苗接种于Hogland’s营养液中进行水培。待棉苗长至两叶一心时进行17%(W/V)PEG6000模拟的干旱处理。分别剪取处理0、1、3、6和12 h的棉苗新叶和根系,置于液氮中冷冻,-80℃保存备用。石系亚1号在试验田常规种植,取三叶一心的根茎叶,以及开花期的花瓣、不同时期的胚珠和纤维,液氮速冻后保存于-80℃备用。
1.2.2GaNCED3基因克隆及植物表达载体构建 根据亚洲棉基因组序列数据库(https://www.cottongen.org/species/Gossypium_arboreum/bgi-A2_genome_v2.0)中GaNCED3基因(Cotton_A_27981)序列设计引物(表1),使用Eastep®Super总RNA提取试剂盒提取石系亚1号叶片总RNA,PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect real time)试剂盒反转录合成cDNA模板,用于扩增目的基因。扩增反应体系和扩增程序参照LATag酶使用说明书,反应体系总体积为50 μL。PCR产物进行电泳检测,切胶回收目的片段,采用限制性内切酶XbaⅠ和SacⅠ双酶切上述PCR产物和表达载体pBI121,利用T4 DNA连接酶连接,构建重组质粒pBI121-GaNCED3,将质粒转化农杆菌(Agrobacterium)GV3101,挑阳性菌落进行测序。
1.2.3GaNECD3表达分析 参照1.2.2的方法,取石系亚1号子叶、胚轴、胚根、叶、茎、根、花瓣、胚珠和纤维组织以及干旱处理0、1、3、6和12 h的叶片和根等组织提取总RNA并反转录合成cDNA模板。设计GaNCED3基因特异引物(表1),按照TB GreenTMPremix Ex TaqTMII (Tli RNaseH Plus)试剂盒说明,在CFX96 TouchTM荧光定量PCR仪(Bio-rad,美国)上进行qRT-PCR分析。以陆地棉组蛋白基因Histone3作为内参基因,每个样品进行3次生物学重复,采用2-△△CT法[35]对基因相对表达量进行分析。
1.2.4GaNCED3过表达拟南芥株系的获得 采用蘸花法,将包含重组质粒pBI121-GaNCED3的农杆菌GV3101侵染野生型(Col-0)拟南芥花序[36]。播种收获的T0代种子于含有50 mg·L-1卡那霉素的1/2 MS固体筛选培养基上,将正常生长的阳性植株转移到营养杯中种植并收获T1代种子。T1代种子在筛选培养基上播种,选择符合3∶1分离比的阳性植株收获T2种子,之后继续筛选,直到获得纯合转基因株系,用于候选功能验证试验。提取每一代抗生素筛选阳性的植株叶片DNA,以表达载体上nptII基因序列设计引物,进行PCR检测。
1.2.5 转基因拟南芥抗旱性分析 筛选到的纯合转基因拟南芥和野生型拟南芥的种子常规消毒后,点播于含100、200和300 mmol·L-1甘露醇的MS培养基和对照MS培养基上,每个株系点播30粒种子,3个重复。经4℃春化2 d后转入培养箱(22℃,16 h光照/8 h黑暗)正常培养,种子露白视为种子已萌发,种子萌发后其子叶能顺利平展并呈现绿色的视为绿苗,培养第12天时统计种子萌发率和绿苗率。纯合转基因拟南芥和野生型拟南芥的种子常规消毒后,点播于对照MS培养基上生长7 d,选取初始根长基本一致的幼苗移到含300 mmol·L-1甘露醇的MS培养基和对照MS培养基上,并行排列,7 d后统计根长。在MS培养基上生长7 d的不同株系拟南芥幼苗移入含营养土∶蛭石=2∶1的营养钵中,在培养箱(22℃,16 h光照/8 h黑暗)继续培养,每3 d左右浇一次水,3周后停止浇水,观察统计拟南芥表型变化,12 d后统计存活率。停止浇水后8 d取样测定MDA和游离脯氨酸含量,以正常浇水组为对照。
1.2.6 转基因拟南芥中胁迫响应基因的表达分析 将转基因株系和野生型拟南芥的种子消毒并播种在添加300 mmol·L-1甘露醇的培养基上,生长2周后,分别提取不同株系拟南芥的整株总RNA并反转录cDNA。设计胁迫响应基因DREB1A(dehydration-responsiveelement-bindingfactor1A),RD29A(responsivetodehydration29A),COR15A(coldregulated15A)和SOS1(saltoverlysensitive1)的特异引物(表1),以拟南芥Actin2作为内参基因,qRT-PCR检测胁迫响应基因的表达。qRT-PCR检测及表达量分析参照1.2.3进行。
2 结果与分析
2.1 GaNCED3基因克隆和特征分析
以亚洲棉石系亚1号基因组序列Cottton_A_27981为基础设计引物,利用逆转录PCR(reverse transcription PCR, RT-PCR)扩增技术克隆了亚洲棉GaNCED3基因,经测序比对,确定其开放阅读框(open reading frame, ORF)序列全长为1 794 bp,编码蛋白质包含597个氨基酸,分子量为65.48 kDa,等电点为6.58。该基因序列与参考基因组序列Cottton_A_27981的相似性为100%,该基因编码蛋白与拟南芥NCED家族中的AtNCED3蛋白同源性为72%。该基因定位于第7号染色体,其基因结构仅包含1个外显子,无内含子。

表1 本研究所用引物序列Table 1 Primers used in this study
2.2 GaNCED3基因表达分析
选取石系亚1号植株的不同组织检测了GaNCED3基因的表达模式。在营养器官中,GaNCED3基因在根和茎中的表达量较高,显著高于对照子叶。在生殖器官中,花瓣和5~25 DPA(开花后天数,days post-anthesis)纤维中的表达量显著高于子叶(图1)。在PEG干旱胁迫处理的根和叶中,该基因上调表达,在胁迫处理3 h的根中表达量最高,达到了对照根中的27.6倍(图2),表明GaNCED3可能在棉花干旱响应中发挥重要作用。

注:*表示子叶与其他样本之间存在显著差异(P<0.05)。Note: * indicated significant difference between cotyledon and other samples at 0.05 level.图1 GaNCED3基因组织表达分析Fig.1 Expression analysis of GaNCED3 in different tissues of G. arboreum
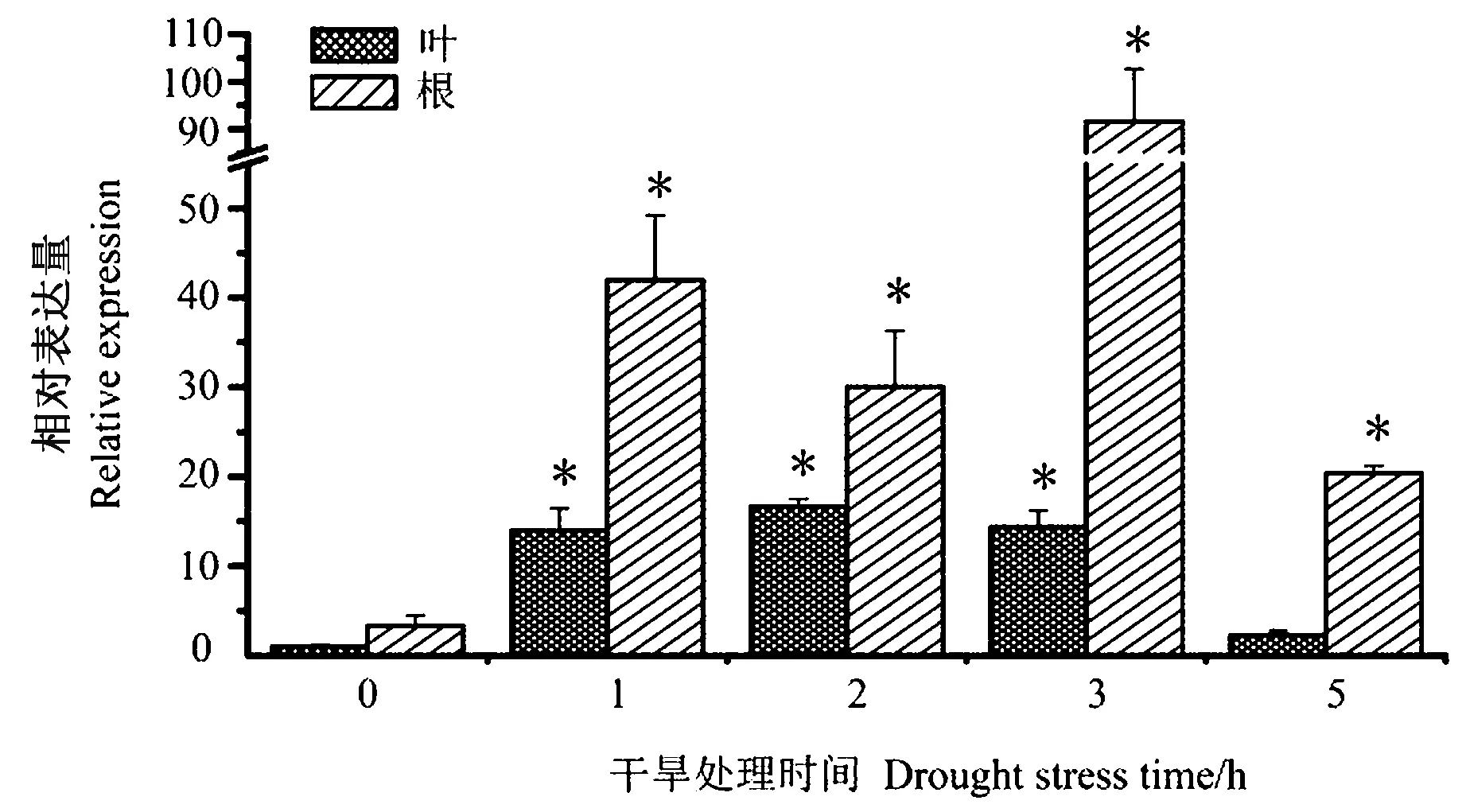
注:*表示0 h和其他干旱处理时间之间存在显著差异(P<0.05)。Note: * indicated significant difference between 0 h and other drought stress times at 0.05 level.图2 GaNCED3在干旱胁迫下的亚洲棉叶和根中的表达变化Fig.2 Expression analysis of GaNCED3 under drought stress in leaves and roots of G. arboreum
2.3 甘露醇干旱胁迫下转GaNCED3基因拟南芥种子的萌发率、绿苗率和根长分析
将构建的重组质粒pBI121-GaNCED3采用沾花法转化野生型Col-0拟南芥,采用抗生素筛选(图3-A)和PCR检测(图3-B)相结合的手段,获得纯合转基因拟南芥株系5个,分别是OE-1、OE-13、OE-16、OE-27和OE-28。qRT-PCR检测5个转基因株系中GaNCED3基因的表达水平(图3-C),选取GaNCED3基因表达量高的转基因拟南芥纯合株系OE-1、OE-16和OE-27,用于GaNCED3基因抗旱功能验证。
将野生型(wildtype, WT)和3个转基因拟南芥纯系(OE-1、OE-16、OE-27)的种子经无菌处理后,播种在含不同浓度甘露醇(100、200和300 mmol·L-1)的培养基上,以MS空白培养基为对照。培养第12天时,统计露白的种子数量和绿苗数量,统计种子萌发率和绿苗率。

注:A: 筛选卡那霉素抗性植株;B: 利用nptII基因特异引物进行转化植株的PCR检测;C: 拟南芥转基因株系中GaNCED3基因的表达水平。*表示WT与其他样本之间存在显著差异(P<0.05)。Note: A: Screening of kanamycin resistant plantlets. B: PCR identification of transgenic plants using specific primer of nptII gene. C: Expression analysis of GaNCED3 in Arabidopsis overexpression lines. * indicates significant difference between WT and other samples at 0.05 level.图3 GaNCED3转基因拟南芥的鉴定Fig.3 Identification of GaNCED3 transgenic Arabidopsis lines
由图4-A~C可知,随着甘露醇浓度的增加,拟南芥种子的萌发和生长受到了不同程度的抑制。在对照和100 mmol·L-1甘露醇处理条件下,转基因拟南芥纯合株系OE-1、OE-16和OE-27的萌发率和绿苗率略高于野生型,差异不显著。在200 mmol·L-1甘露醇条件下,3个转基因株系的萌发率虽略高于野生型,但无显著差异,但转基因株系的绿苗率显著高于野生型。在300 mmol·L-1甘露醇条件下,转基因和对照野生型株系的种子萌发均受到明显抑制,但转基因拟南芥株系的种子萌发率显著高于野生型,表明转GaNCED3基因提高了拟南芥种子和苗期的抗旱性。
选取在MS培养基上生长7 d、初始根长基本相等的幼苗移至含有300 mmol·L-1甘露醇的培养基上并平行排列,培养7 d后统计根长,结果如图4-D、E所示。在对照处理CK中,各个转基因株系和野生型拟南芥根长的差异未达到显著水平,但在含甘露醇的干旱胁迫培养基上培养7 d,转基因株系的根长均显著高于野生型,说明转GaNCED3基因的拟南芥株系对干旱胁迫的抵抗力更高。
2.4 自然干旱下转GaNCED3基因拟南芥植株表型变化及生理指标分析
将MS培养基上生长7 d的拟南芥移至营养土中培养3周后停止浇水,进行自然干旱处理,12 d后观察记录植株表型变化。从图5-A可以看出,正常培养条件下,野生型拟南芥与转基因植株表型无明显差异。干旱处理12 d后,野生型拟南芥叶片严重萎蔫、失水皱缩甚至整株死亡,而转基因株系中大多数植株能够存活,部分植株叶片颜色变深,呈紫红色,部分叶片萎蔫,这表明转GaNCED3基因拟南芥的抗旱能力比野生型拟南芥更强。
自然干旱处理前和处理后10 d,分别取样测定MDA和游离脯氨酸含量,以正常浇水组为对照。图5-B、C结果显示,正常浇水条件下,转基因和野生型植株叶片中的MDA含量和游离脯氨酸含量差异不显著(P>0.05)。自然干旱处理8 d后,野生型植株叶片MDA含量显著高于转基因植株(P<0.05),游离脯氨酸含量显著低于转基因植株(P<0.05),这表明转GaNCED3基因的拟南芥植株对干旱胁迫的耐性高于野生型植株。
2.5 甘露醇模拟干旱胁迫下拟南芥胁迫响应基因的表达分析
转基因株系和野生型拟南芥在添加300 mmol·L-1甘露醇的培养基上生长2周后,取整株提取总RNA,反转录合成cDNA,检测胁迫响应基因的表达。由图6可知,在正常浇水条件下,转基因株系中DREB1A、RD29A、COR15A和SOS1基因表达量均高于野生型。干旱处理后,DREB1A、RD29A和COR15A基因在3个转基因株系和野生型拟南芥中均明显上调表达,在转基因株系中上调倍数更高。SOS1基因表达量在干旱处理后较对照略上调,但株系间差异不显著。结果表明,转基因拟南芥中GaNCED3基因可能主要通过激活DREB1A、RD29A和COR15A等非生物胁迫响应基因的表达来调控转基因植株的抗旱性。
3 讨论
NCED基因家族编码9-顺式-环氧类胡萝卜素双加氧酶,结构特征高度保守。相关研究结果显示,棉花NCED基因共7个成员,包括3个NCED3基因(NCED3a、NCED3b、NCED3c)、3个NCED5基因(NCED5a、NCED5b、NCED5c)和1个NCED6基因。基因表达分析发现GhNCED3a_A/D和GhNCED3c_A/D对干旱响应强烈[34]。此外,利用亚洲棉干旱胁迫转录组数据对NCED基因进行表达分析,发现1个在干旱胁迫后显著上调表达的NCED基因——GaNCED3a(Cotton_A_27981)。本研究克隆的GaNCED3基因与已公布的亚洲棉基因组中的NCED3a基因(Cottton_A_27981)核酸序列相似度为100%,编码蛋白与拟南芥AtNCED3蛋白同源性最高,表明NCED3在植物进化过程中具有较高的保守性。
已有研究表明,NCED是ABA生物合成途径中的关键限速酶,其表达模式与体内ABA水平关系密切[37-38]。水稻OsNCED3、黄冠梨(PyrusbretschneideriXuehuali ×P.pyrifoliaShinsseiki)PbpNCED3和烟草NCED3等基因干旱胁迫下的表达量变化和内源ABA含量变化趋势一致,二者含量都随着干旱的加重而增加[14,24,39]。木薯(ManihotesculentaCrantz)MeNCED3、拟南芥AtNCED3和小麦(Triticumaestivum)TaNCED基因的表达均能被PEG处理显著诱导[12,40-41]。本研究中,GaNCED3在根中高表达,这与拟南芥AtNCED3、木薯MeNCED3的组织表达特性相似[12,40],与陆地棉GhNCED基因在茎叶中高表达、在根中表达量低的表达特性不同[32]。然而,GhNCED基因能够被干旱胁迫强烈诱导,且在胁迫6 h时表达量达到最大[32],这与本研究中GaNCED3受干旱胁迫诱导表达量快速升高的结果相似,表明棉花部分NCED基因参与了干旱胁迫应答。喻娟等[33]克隆1个逆境诱导表达基因GhNCED2并转化烟草,发现转基因烟草中GhNCED2表达呈现典型的响应逆境胁迫的特征,干旱、盐碱及低温胁迫均能诱导GhNCED2的大量表达,暗示着NCED基因不仅在抗旱方面发挥重要作用,在提高植物对多种逆境的抗性方面也具有重要的应用前景。
本研究将GaNCED3基因过表达载体转化拟南芥,模拟干旱处理发现,GaNCED3基因过表达株系抗旱性比野生型更强,这与拟南芥AtNCED3、水稻OsNCED3、烟草NtNCED3基因在干旱响应中发挥的功能相似[28,42-43]。MDA是膜脂过氧化最重要的产物之一,与膜脂过氧化作用密切相关。脯氨酸具有亲水性,对于稳定植物细胞和组织内的代谢过程具有重要作用。在逆境条件下,植物体内MDA和脯氨酸含量在一定程度上反映了植物的抗逆性。本研究中,MDA含量和游离脯氨酸含量测定结果表明,转基因株系细胞损伤和质膜过氧化程度低于野生型,可能是由于转GaNCED3拟南芥对干旱胁迫产生的大量活性氧等有害物的清除能力更强,有效提高了多胺、过氧化物酶等保护性物质含量,使植株对干旱胁迫的抗性水平更高。然而,转基因拟南芥株系中GaNCED3的表达量与ABA含量和重要抗旱基因的关系、调控干旱响应的信号转导机制还有待进一步深入研究,以阐明GaNCED3在干旱胁迫下的信号转导途径。
4 结论
本研究克隆了亚洲棉干旱诱导表达基因GaNCED3,过表达拟南芥提高了植株干旱胁迫下的萌发率,降低了细胞的损伤程度和过氧化水平,提高了转基因植株对干旱胁迫的抗性。本研究通过GaNCED3表达特性和转基因拟南芥的抗旱性分析,验证了GaNCED3基因在植物干旱胁迫响应中具有重要的应用价值。
